雙波長瑞利光散射技術檢測糕點類食品中的甜蜜素
江 虹,陳明朗
(長江師范學院化學化工學院,重慶 408100)
甜蜜素是一種人工合成添加劑,具有增強食品甜味的功能,它的甜度是蔗糖的30~50 倍,鑒于此,食品業在較多市售飲料及某些焙烤食品中均添加甜蜜素作為甜味型添加劑。隨著食品毒理學研究方法的發展,人們對食品添加劑可能對人體造成的慢性毒性、致畸、致癌、致突變等作用有了新的認識,并引起人們的高度重視。美國和日本已禁止使用甜蜜素作為食品甜味添加劑,中國、歐盟及新西蘭等國則對食品中添加甜蜜素作出嚴格規定。我國GB 2760—2014《食品添加劑使用衛生標準》中明確規定各種飲料中的甜蜜素不得超過0.65 g/kg,焙烤食品蛋糕及面包中的甜蜜素不得超過1.6 g/kg,餅干中的甜蜜素不得超過0.65 g/kg等。可見,對食品中甜蜜素含量進行研究有著重要意義。近年來,國內外對食品中甜蜜素檢測進行了大量的研究工作,主要方法有高效液相色譜法[1-4]、高效液相色譜-質譜聯用法[5-15]、電化學法[16-19]、分光光度法[20-21]、氣相色譜法[22-25]、氣相色譜-質譜聯用法[26]等。高效液相色譜法、氣相色譜法、液相色譜-質譜聯用法和氣相色譜-質譜聯用法的前處理工作相對較為繁瑣,日常運行費用較高;電化學法要求特殊電極,對實驗條件要求較高;分光光度法的靈敏度不高,選擇性欠佳。采用雙波長瑞利光散射(dual-wavelength Rayleigh light scattering,DWO-RLS)技術研究食品中甜蜜素的檢測方法,RLS技術是近年新發展起來的一種簡便、高靈敏(可達納克級)的檢測技術,已廣泛用于生物大分子、無機物及有機物的分析中,尤其在藥物分析中應用甚多[27-29],而在食品分析中相對較少[30]。本實驗以燦爛綠作探針,借助燦爛綠與甜蜜素反應生成具有2 個強散射峰的締合物,建立了簡便、快速測定甜蜜素的DWORLS方法,目前尚鮮見文獻報道。該法用于食品中低脂蛋糕、面包及餅干中甜蜜素的測定,結果滿意。
1 材料與方法
1.1 材料與試劑
低脂類蛋糕(1#、2#)、餅干(3#、4#、5#、6#)及面包(7#、8#、9#、10#)(脂肪<15%) 重慶市售;甜蜜素標準物質(純度99.3%) 中國食品藥品檢定研究院;燦爛綠(分析純) 上海邁瑞爾化學技術有限公司;三羥甲基氨基甲烷(Tris,分析純) 上海吉至生化科技有限公司;HCl(分析純) 重慶川東(化工)集團有限公司;超純水。
1.2 儀器與設備
F-2500型熒光分光光度計 日本日立公司;TD5A-WS離心機 湖南湘儀離心機儀器有限公司;KQ-200VDE超聲波清洗機 昆山市超聲儀器有限公司;pHS-3C精密酸度計 上海虹益儀器儀表有限公司;EL104電子天平 上海精密儀器儀表有限公司。
1.3 方法
1.3.1 溶液配制
甜蜜素標準溶液:準確稱取甜蜜素0.020 12 g,加水溶解后定容至100 mL,即配成1.00×10-3mol/L貯備液,取貯備液稀釋100 倍,配成1.00×10-5mol/L操作液,于冰箱4 ℃保存。燦爛綠溶液:稱取適量燦爛綠,用水溶解后配成1.00×10-4mol/L。Tris-HCl溶液:pH 3.0~9.8(用pH計測定0.20 mol/L Tris和0.10 mol/L HCl的混合液)。
1.3.2 樣品處理
準確稱取低脂蛋糕、餅干及面包樣品各2 g左右(精確至±0.000 1 g)于小燒杯中,加適量水,水浴中溫熱、攪拌,浸提10 min,加10 mL無水乙醇(沉淀蛋白),攪拌、熱水浴中超聲20~30 min,4 500 r/min離心5~10 min,上清液用水定容至100 mL,待用。
1.3.3 RLS強度的測定
取10 mL具塞比色管,準確加入0.00~2.50 mL甜蜜素標準操作液、1.00 mL pH 9.27 Tris-HCl溶液及3.00 mL燦爛綠溶液,用水稀至刻度。待反應20 min后,在熒光分光光度計(λex=λem=220 nm,Ex=2.5 nm,Em=5.0 nm)上掃描RLS光譜,用DWO-RLS(341 nm+470 nm)法測定溶液的RLS強度IRLS(體系)、I0(試劑空白)及RLS增強強度ΔIRLS(341+470)(ΔIRLS=IRLS-I0)。
1.4 數據統計及圖表繪制
所有實驗至少重復掃描3 次,平行測定3~5 份,各數據以平均值表示,用Excel作數據統計,Origin制圖,Word中插入表格制表。
2 結果與分析
2.1 甜蜜素與燦爛綠的RLS光譜特征
燦爛綠與甜蜜素的反應原理:燦爛綠在溶液中以陽離子形式存在,而甜蜜素在溶液中,分子上的Na+離去后以環己基氨基磺酸根陰離子形式存在。帶正電荷的燦爛綠與帶負電荷的甜蜜素以靜電引力結合生成二元離子締合物,使RLS顯著增強,并產生具有2 個強的特征瑞利散射峰的新光譜,在2 個特征散射峰處,甜蜜素濃度與RLS增強強度有一定的線性關系,可用于甜蜜素的定量分析。
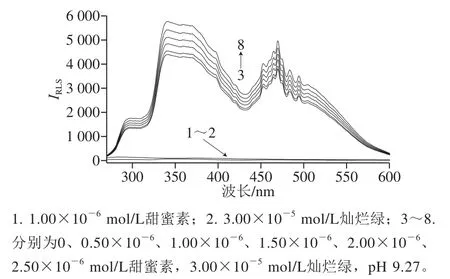
圖 1 甜蜜素與燦爛綠的RLSFig. 1 Rayleigh light scattering spectra of cyclamate and brilliant green
從圖1可知,甜蜜素溶液和燦爛綠溶液自身的RLS信號均十分微弱(曲線1和曲線2)。當在燦爛綠的堿性溶液(pH 9.27 Tris-HCl溶液)中加入不同濃度的甜蜜素標準操作液后,二者互相反應生成離子締合物,新物質的生成使RLS顯著增強,并產生具有2 個強的特征散射峰的新RLS光譜(曲線3~8),最大RLS峰位于341 nm,次大RLS峰位于470 nm,在296、452、463、484 nm及494 nm等多處出現小的RLS峰。在2 個強散射峰處,隨著加入的甜蜜素溶液濃度的增大,體系的RLS強度隨之增強,且呈良好的線性關系,因此,若選擇341 nm或470 nm作為測定波長,均可用單波長瑞利光散射(single wavelength Rayleigh light scattering,SWO-RLS)法測定甜蜜素的含量,且有高的靈敏度。采用DWO-RLS(341 nm+470 nm)法測定時,因散射強度具有加和性,可大幅提高方法的測定靈敏度(約為SWO-RLS法的2 倍)。故實驗選用DWO-RLS法定量測定甜蜜素。
2.2 適宜條件的確定
2.2.1 Tris-HCl溶液pH值及用量
取1.00 mL甜蜜素標準操作液、2.00 mL燦爛綠溶液,按1.3.3節RLS強度的測定方法,考察1.00 mL不同pH值的Tris-HCl溶液在用SWO-RLS法和DWO-RLS法測定時對甜蜜素-燦爛綠體系ΔIRLS的影響(n=3)。從圖2可知,當pH<7時,ΔIRLS值很小,說明溶液pH值不合適,甜蜜素與燦爛綠基本不反應或少量反應;當pH>7時,隨著pH值的逐漸增大,ΔIRLS隨之增大,當pH 9.27時,ΔIRLS達最大,之后有所下降;這說明甜蜜素與燦爛綠反應的最適pH值為pH 9.27,pH值大于或小于9.27,不利于甜蜜素與燦爛綠的完全反應,因此,ΔIRLS有所下降。隨即考察pH 9.27 Tris-HCl溶液用量對體系ΔIRLS的影響(n=3),結果表明,適宜用量為1.00 mL。從圖2還可知,用DWORLS法測定的靈敏度比單波長法高。
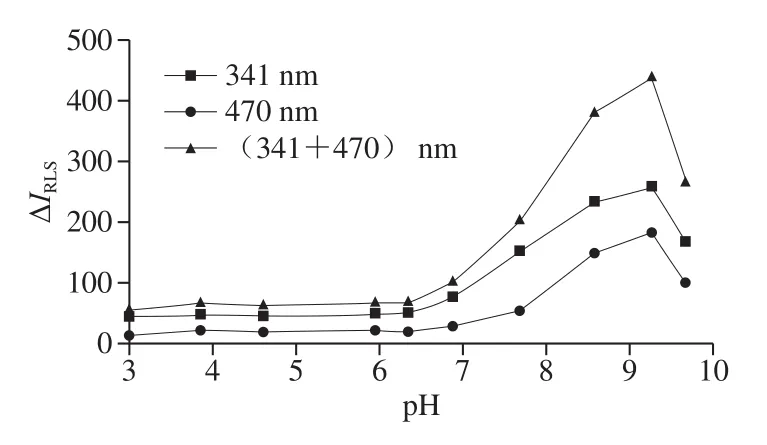
圖 2 溶液酸度對ΔIRLS的影響Fig. 2 Effect of solution acidity on ΔIRLS
2.2.2 燦爛綠濃度
取1.00 mL甜蜜素標準操作液、1.00 mL pH 9.27 Tris-HCl溶液,按1.3.3節RLS強度的測定方法,考察SWO-RLS法和DWO-RLS法測定時燦爛綠濃度對甜蜜素-燦爛綠體系ΔIRLS的影響,結果見圖3。當燦爛綠濃度為3.00×10-5mol/L時,ΔIRLS達最大,當燦爛綠濃度為0.50×10-5~3.00×10-5mol/L范圍時,隨著濃度增大,體系的ΔIRLS隨之增大;當燦爛綠濃度為3.00×10-5~4.00×10-5mol/L范圍時,隨著濃度增加,體系ΔIRLS不斷下降。原因是當燦爛綠濃度低于3.00×10-5mol/L時,因用量不夠,甜蜜素反應不完全;當燦爛綠濃度大于3.00×10-5mol/L時,用量過多導致自聚作用增強,影響其與甜蜜素的完全反應。從圖3還可知,用DWO-RLS法測定的靈敏度比SWO-RLS法高。
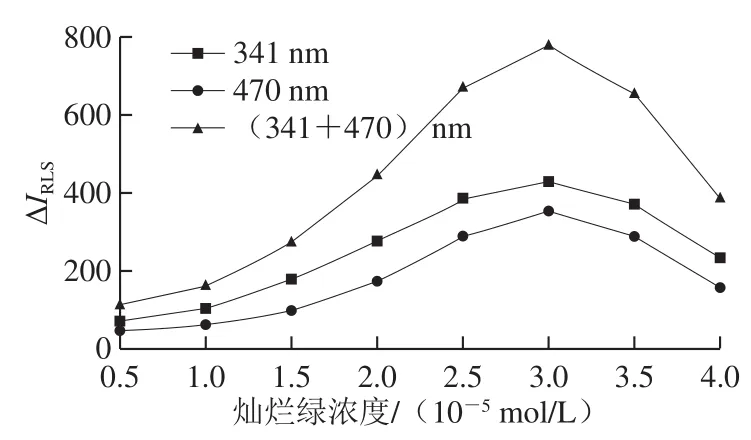
圖 3 燦爛綠濃度對ΔIRLS的影響Fig. 3 Effect of brilliant green concentration on ΔIRLS
2.2.3 試劑加入順序
取1.00 mL甜蜜素標準操作液、1.00 mL pH 9.27 Tris-HCl溶液和3.00 mL 燦爛綠溶液,按1.3.3節RLS強度的測定方法,考察這幾種物質的不同加入順序在用SWORLS法和DWO-RLS法測定時對甜蜜素-燦爛綠體系ΔIRLS的影響。結果表明,ΔIRLS相對最大(ΔIRLS(341)=422,ΔIRLS(470)=346,ΔIRLS(341+470)=768),靈敏度最高的試劑加入順序為甜蜜素溶液、Tris-HCl溶液、燦爛綠溶液。故實驗按此最佳試劑加入順序進行。
2.2.4 反應時間及穩定性
按選定的各物質的最佳條件及試劑的最佳加入順序,加入1.00 mL甜蜜素標準操作液、1.00 mL pH 9.27 Tris-HCl溶液和3.00 mL燦爛綠溶液,按1.3.3節RLS強度的測定方法,用DWO-RLS法考察甜蜜素與燦爛綠的反應在0~100 min內生成的新物質對ΔIRLS的影響。實驗表明,20 min內,隨著反應時間的延長,ΔIRLS逐漸增大,到20 min達最大(ΔIRLS(341+470)=824);20 min后,隨著反應時間的不斷延長,ΔIRLS不再增大,基本處于同一平臺。故實驗選在20 min后測定。
2.3 標準曲線及相關參數
按1.3.3節RLS強度的測定方法,配制0.00、0.50、1.00、1.50、2.00、2.50 mL甜蜜素標準操作液的標準系列溶液。用SWO-RLS法和DWO-RLS法測定各溶液的ΔIRLS(341)、ΔIRLS(470)及ΔIRLS(341+470),作ΔIRLS-ρ標準曲線,標準曲線的相關參數見表1。可見,用DWO-RLS測定的靈敏度比SWO-RLS法更高。DWO-RLS檢測樣品的定量限分別為1.05 mg/100 g(蛋糕)、0.974 mg/100 g(餅干)和0.994 mg/100 g(面包)。

表 1 甜蜜素標準曲線相關參數Table 1 Calibration curve equations, detection wavelengths, LOD and LOQ for cyclamate detected by different RLS methods
2.4 共存物質的影響
按1.3.3節RLS強度的測定方法,考察相對誤差≤±5%時,某些共存物質對測定0.201 mg/L甜蜜素的干擾情況,見表2。結果顯示,氨基酸、糖類及常見絕大多數陰、陽離子不干擾甜蜜素的測定。故本方法有良好的選擇性。
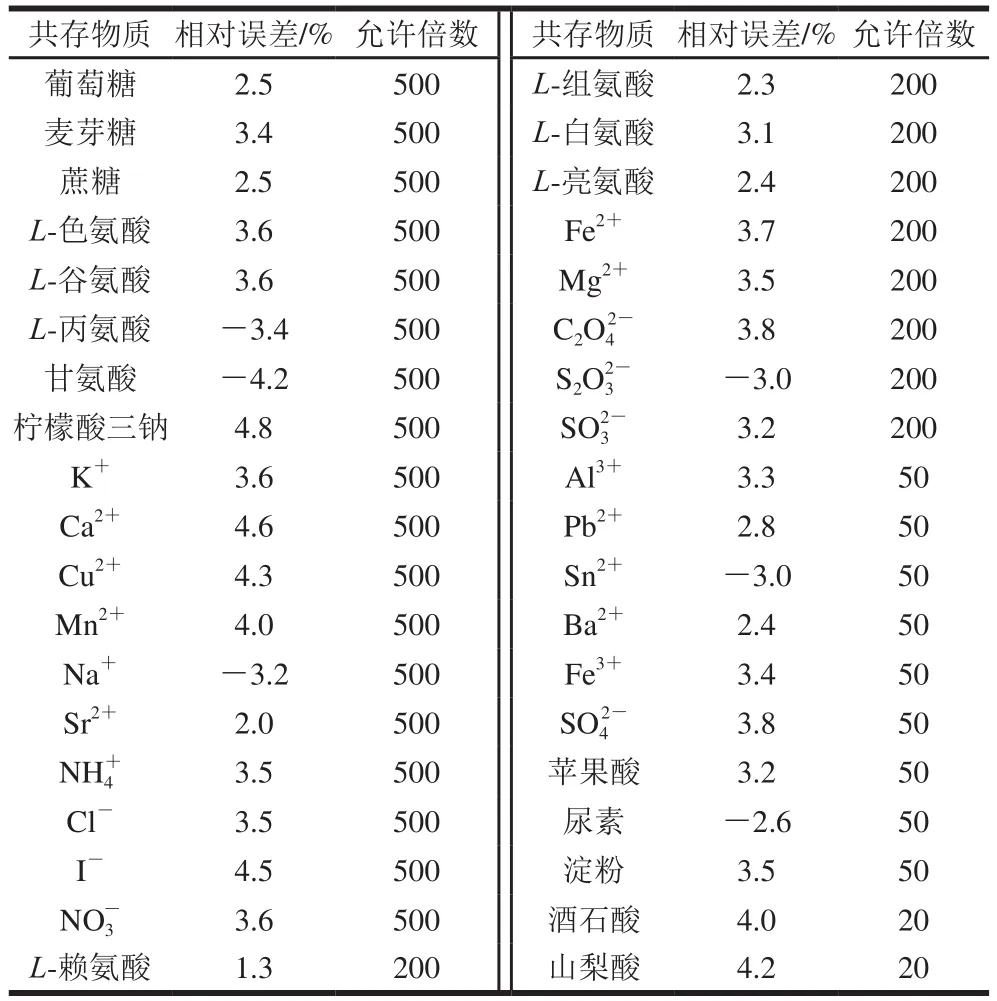
表 2 共存物質的影響Table 2 Effect of coexistent substances
2.5 樣品分析
2.5.1 樣品測定結果
移取1.3.2節已制備的各待測液0.30 mL代替1.3.3節中的甜蜜素標準操作液,并按1.3.3節方法加入其他試劑溶液,用水定容至10 mL。在選定的熒光儀條件下掃描RLS光譜,用DWO-RLS法測定341 nm和470 nm波長處待測液的甜蜜素含量(各平行測定5 份),計算出原食品樣中甜蜜素含量,并與國標法(GB 1886.37—2015《食品添加劑 環己基氨基磺酸鈉(又名甜蜜素)》)測定結果對照,結果見表3。
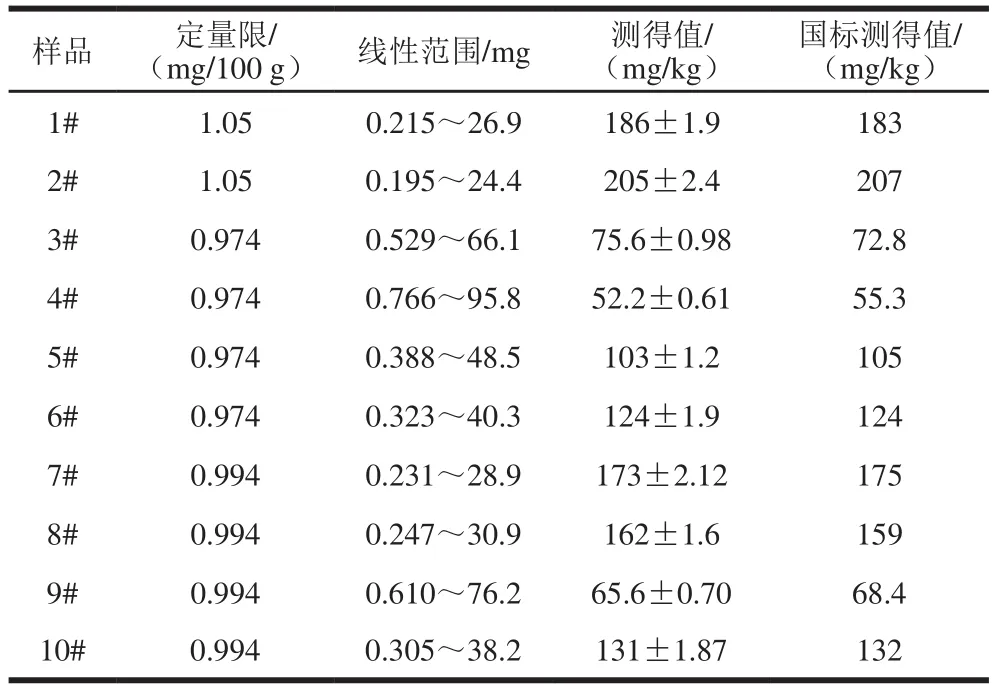
表 3 樣品分析結果Table 3 Analytical results of samples
2.5.2 加標回收實驗結果

表 4 樣品加標回收率(n=5)Table 4 Recoveries for spiked samples (n= 5)
按1.3.2節方法稱取已粉碎、混勻的各食品樣2 g左右(精確至±0.000 1 g),加適量水后,再加入0.50~2.50 mL范圍的甜蜜素標準貯備液,后續操作按1.3.2節樣品處理方法制備各待測液。取該待測液0.30 mL,按1.3.3節方法測定甜蜜素含量,并計算回收率及相對標準偏差(各平行測定5 份),以判斷新方法的準確度,結果見表4。樣品的加標回收率(n=5)為97.3%~103%,相對標準偏差(n=5)為1.1%~2.6%,說明本方法具有較高的準確度和精密度。
3 結 論
依據甜蜜素與燦爛綠的締合反應,采用DWO-RLS法測定低脂食品中的甜蜜素,具有方法簡便、操作簡單及有很高靈敏度的優點,方法選擇性良好,準確度和精密度符合定量分析要求,樣品處理安全、簡單,測定成本低,易于普及,適于糕點類食品的批量分析。

