川芎嗪對肌肉骨骼疾患大鼠比目魚肌鈣離子通道及細胞凋亡的影響及機制*
肖 凱, 楊 林, 周江紅, 高鑫峰, 趙晶晶, 黃若昆
(1武漢市第四醫院,華中科技大學同濟醫學院附屬普愛醫院骨外科,湖北武漢430030;2華中科技大學同濟醫學院附屬同濟醫院過敏反應科,湖北武漢430030)
肌肉骨骼疾患(musculoskeletal disorder,MSD)是指由于長期的受力而引起肌肉或骨骼的損傷,其主要特征包括疼痛和活動受限[1]。MSD 中骨骼肌細胞內Ca2+濃度增高是細胞損害的中心環節,Ca2+濃度的變化被證明在骨骼肌的興奮-收縮-松弛循環中起關鍵作用[2]。鈣超載是指細胞內鈣濃度的異常性升高,會導致線粒體腫脹,功能失調,造成細胞不可逆的損傷甚至死亡[3]。研究顯示,鈣離子發揮其生理學作用需經離子通道介導,L-型鈣離子通道Cav1.3是位于細胞膜的跨膜異源多聚體蛋白質,是目前具有藥理學意義的一類鈣通道,該通道被激活后,開放時間長,失活慢,是細胞興奮過程中外鈣離子內流的主要途徑,其活性程度與鈣離子內環境穩態的維持有關[4]。
川芎嗪是中藥川芎的有效成分之一,屬酰胺類生物堿,已被廣泛應用于臨床[5]。以往的動物實驗表明川芎嗪能保護廢用狀態下的大鼠骨骼肌細胞,并有效抑制細胞質中的鈣超載[6]。在心肌細胞的研究中表明,川芎嗪與細胞膜上未激活的L-型鈣離子通道結合,能夠減少鈣離子內流[7]。但川芎嗪在骨骼肌中是否能通過抑制L-型鈣離子通道阻止鈣超載目前尚未見相關報道。
本研究以靜態姿勢負荷構建大鼠MSD 模型,并通過檢測不同負荷時間下Ca2+-ATPase的活性反應比目魚肌細胞內鈣超載情況;最終選取負荷10 h 的比目魚肌,觀察細胞凋亡水平,檢測凋亡相關蛋白caspase-3、caspase-9 及L-型鈣離子通道Cav1.3、蘭尼堿受體1(ryanodine receptor type 1,RyR1)的表達情況,明確川芎嗪的作用效果及機制,為MSD 中藥治療方案提供參考資料。
材料和方法
1 主要試劑與儀器
磷酸川芎嗪購自北京燕京藥業有限公司(國藥準字11021964),研磨后用生理鹽水稀釋制備成灌胃藥液;TUNEL 細胞凋亡檢測試劑盒和MaxVisionTMHRP-Polymer anti-Rabbit IHC Kit 購 自Bio-Swamp;RNA 提取試劑盒和反轉錄試劑盒購自TaKaRa;SYBR Green 染料購自Lumiprobe;Ca2+-ATPase 測定試劑盒、全蛋白提取試劑盒、BCA 法蛋白定量測定試劑盒及DAB顯色試劑盒購自南京建成生物技術有限公司;超敏ECL 化學發光試劑盒購于上海碧云天生物技術研究所;兔抗大鼠caspase-3、caspase-9、Cav1.3、RyR1 和GAPDH 抗體(Ⅰ抗)和山羊抗兔IgGⅡ抗(Western blot 和免疫組化共用抗體)購自Abcam;其他常規試劑均為國藥產品分析純。凝膠成像分析系統(ABI);低溫冷凍離心機(Eppendorf);酶標儀(BioTek);熒光定量PCR儀(Life Technologies)。
2 實驗動物
42只SPF級4周齡、體重60~70 g的雄性SD大鼠(此周齡及體重的大鼠肌肉組織較小,便于物質擴散,利于實驗)由華中農業大學實驗動物中心提供,飼養于SPF 動物房。動物室內環境溫度(21±1)℃,濕度(50±15)%,12 h 明暗交替。動物自由飲去離子水,飼喂經輻照消毒的維持飼料(北京華阜康公司提供),暫養1周后開始實驗。
3 實驗方法
3.1 動物分組及靜態姿勢負荷構建大鼠MSD 模型[8]42 只SD 大鼠被隨機分成3 組:對照(control)組、MSD 模型組及川芎嗪組,每組14 只。根據負荷時間(2、5、8 和10 h)的不同,每組大鼠又分為4 個小組,負荷2、5、8 h 組每組3 只,負荷10 h 組每組5 只。實驗開始前0.5 h,對照組和MSD 模型組每只大鼠灌胃2 mL生理鹽水,川芎嗪組每只大鼠按6 g/L 劑量灌胃川芎嗪2 mL[8]。實驗開始后,對照組每只大鼠不施加任何負荷,MSD 模型組和川芎嗪組每只大鼠以夾板固定四肢持續施加持續性靜態姿勢負荷2 h、5 h、8 h和10 h。
3.2 實驗取材及Ca2+-ATPase 活性測定 分別于負荷2 h、5 h、8 h 和10 h 時頸部脫臼處死大鼠,輕柔游離并取下各小組大鼠兩側完整比目魚肌,取部分樣本充分勻漿,檢測勻漿樣本中總蛋白含量,后根據超微量Ca2+-ATP 酶測試盒說明書操作,依次經過酶促反應、定磷和公式換算:組織中ATPase 活性=(測定A值-對照A值)/(標準A值-空白A值)×標準品濃度×6×2.8/待測樣本蛋白濃度,獲得比目魚肌中Ca2+-ATPase 活性(U/mg prot)。將剩余一部分負荷10 h后的游離比目魚肌保存于4%甲醛中固定,另一部分于-80℃冷凍保存待檢。
3.3 TUNEL染色 取固定48 h的比目魚肌組織塊,用流水沖洗,去除殘留的固定液和雜質;用梯度濃度的乙醇逐級脫水;采用二甲苯溶液對組織塊進行透明處理;在恒溫箱中對組織塊進行浸蠟;采用石蠟對浸透蠟的組織塊進行包裹;切片機上切片,切片厚度為4~5 μm;將切片依次進行TUNEL 染色處理:烤片和脫蠟后水化,用蛋白酶K 工作液常溫孵育15~30 min,加50 μL TUNEL 反應混合液于樣品上,在濕盒、暗室中避光37℃孵育60 min,用PBS 沖洗3 次,加入50 μL 轉化劑-POD,在濕盒中避光37℃孵育30 min,用PBS 沖洗3 次,加入100 μL DAB 底物,于15~25℃孵育10 min,用PBS 沖洗3 次,蘇木素復染、脫水、透明,封片,光鏡下檢查凋亡細胞。
3.4 RT-qPCR 檢測比目魚肌caspase-3、caspase-9、Cav1.3及RyR1的mRNA 表達 根據NCBI上公布的大鼠caspase-3、caspase-9、Cav1.3、RyR1 及內參照GAPDH 的序列分別設計RT-qPCR用引物:caspase-3的上游引物序列為5"-CATGGAGATGAAGGAGTA-3",下游引物序列為5"-CCTGAATGATGAAGAGTT-3";caspase-9 的上游引物序列為5"-GTGTCCTACTCCACCTTC-3",下游引物序列為5"-TCTGCTTATAAACCCCTT-3";Cav1.3 的上游引物序列為5"-ATTTACATCCCGTTCCCT-3",下游引物序列為5"-AAGTTCCATCCGTTCCTA-3";RyR1 的上游引物序列為5"-TTTCATCCGTCACTCACA-3",下游引物序列為5"-CAGGCTCGTCTTCATCTT-3";GAPDH 的 上游引物序列為5"-CAAGTTCAACGGCACAG-3",下游引物序列為5"-CCAGTAGACTCCACGACAT-3"。所有引物由上海生物工程有限公司代為合成。取-80℃凍存的各組大鼠比目魚肌樣本,分別提取組織RNA,反轉錄成cDNA 單鏈作為模板,采用20 μL 反應體系:上下游引物各0.5 μL,SYBR Green Mix 10 μL,cDNA 模板1.0 μL,滅菌雙蒸水8 μL。反應程序:95℃3 min;95℃5 s,60℃30 s,72℃25 s,35 個循環;65℃5 min;95℃50 s。采用2-ΔΔCt法計算基因的相對表達量。
3.5 Western blot 檢測比目魚肌caspase-3、caspase-9、Cav1.3及RyR1蛋白的表達 取-80℃凍存的各組大鼠比目魚肌樣本,采用組織全蛋白提取試劑盒分別進行蛋白提取;用BCA 蛋白濃度檢測試劑盒進行濃度檢測;后取20 μg 蛋白和4 μL 2×SDS 上樣緩沖液混合均勻,100℃變性10 min后上樣,SDS-PAGE分離后轉至PVDF 膜上,用5%脫脂牛奶封閉1 h,PBS洗膜后分別加入Ⅰ抗[caspase-3(1∶1 000),caspase-9(1∶1 000),Cav1.3(1∶2 000),RyR1(1∶2 000),GAPDH(1∶1 000)],4℃孵育過夜;PBS 洗膜,加入HRP 標記的Ⅱ抗羊抗兔IgG 室溫孵育0.5 h;PBS 洗膜,用ECL 化學發光進行顯色。以GAPDH 作為內參蛋白,采用Quantity One 圖像處理軟件進行半定量分析。
3.6 免疫組化檢測比目魚肌caspase-3、caspase-9、Cav1.3 及RyR1 蛋白的表達 參照TUNEL 染色前期操作制作比目魚肌石蠟切片,切片厚度為3~5 μm;將切好的片子依次進行免疫組化染色處理:烤片和脫蠟;水化;采用0.01 mol/L 檸檬酸鈉緩沖溶液中高壓(125℃,103 kPa)修復15 min,自然冷卻后,PBS 洗3 min×3 次;將玻片置于3% H2O2中,濕盒孵育10 min,以消除內源性過氧化物酶的活性;PBS 沖洗3 min×3 次;封閉,將玻片置于0.5%BSA 中,濕盒孵育30 min,PBS 沖洗3 min×3 次;滴加Ⅰ抗[caspase-3(1∶300),caspase-9(1∶300),Cav1.3(1∶500),RyR1(1∶500)],4℃濕盒中孵育過夜,PBS 沖洗3 min×3次;將切片從4℃冰箱中取出,放置室溫下30 min 復溫,PBS 沖洗5 min×3 次,滴加MaxVision Ⅱ抗,濕盒中孵育,室溫下放置30 min,PBS 沖洗3 min×3 次;加入100 μL DAB 底物,于15~25℃孵育10 min;用PBS沖洗3 次;蘇木素復染、脫水、透明;封片,光鏡下觀察各指標陽性染色情況。
4 統計學處理
所有數據均采用統計軟件SPSS 19.0 進行分析處理。計量資料以均值±標準差(mean±SD)表示。同組不同時間點比較采用t檢驗,多組間數據比較選擇單因素方差分析,進一步兩兩比較采用Tukey 檢驗。以P<0.05為差異有統計學意義。
結果
1 川芎嗪提升MSD 大鼠比目魚肌Ca2+-ATPase活性
Ca2+-ATPase 活性檢測結果顯示,對照組各時點比目魚肌Ca2+-ATPase 活性正常平穩,差異無統計學顯著性(P>0.05);與對照組各時點比較,MSD 模型組大鼠各時點比目魚肌細胞Ca2+-ATPase活性均顯著降低(P<0.01);與MSD 模型2 h 亞組比較,MSD 模型5、8、10 h亞組大鼠比目魚肌Ca2+-ATPase 活性顯著降低(P<0.01);川芎嗪組大鼠各時點比目魚肌細胞的Ca2+-ATPase 活性均較MSD 模型組相應時點升高(P<0.05)。川芎嗪組大鼠隨施壓時間延長其比目魚肌細胞Ca2+-ATPase 活性逐漸升高(P<0.01),施壓10 h后達到高峰。見表1。
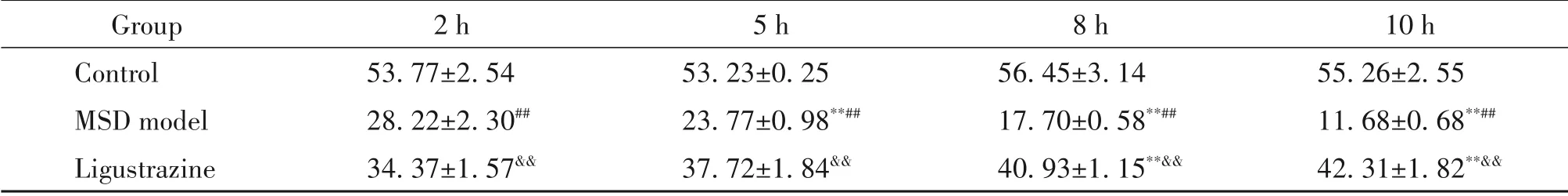
表1 三組大鼠不同時期比目魚肌Ca2+-ATPase活性變化情況Table 1. Changes of Ca2+-ATPase activity in soleus muscle of the 3 groups in different periods(×103 U/g. Mean±SD. n=3)
2 川芎嗪抑制MSD大鼠比目魚肌細胞凋亡
TUNEL 染色結果顯示,與對照組比較,MSD 模型組大鼠比目魚肌凋亡細胞(棕黃色)增多,而與MSD 模型組比較,川芎嗪組大鼠比目魚肌凋亡細胞減少,見圖1。
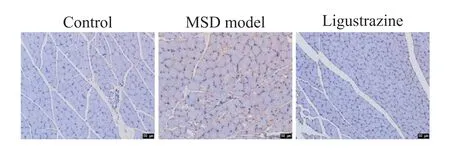
Figure 1. Apoptosis of soleus muscle cells in control,MSD model,and ligustrazine groups was detected by TUNEL staining. The brown yellow granules indicate apoptotic cells,and the number of apoptotic cells was increased in MSD model group. The scale bar=50 μm.圖1 TUNEL染色檢測比目魚肌細胞凋亡
3 川芎嗪對細胞凋亡及鈣離子通道相關基因表達的影響
RT-qPCR 檢測結果顯示,與對照組比較,MSD 模型組大鼠比目魚肌中caspase-3、caspase-9 及Cav1.3的mRNA 表達顯著增加(P<0.01),RyR1 的mRNA 表達水平顯著降低(P<0.01);而與MSD 模型組比較,川芎嗪組大鼠比目魚肌caspase-3、caspase-9 及Cav1.3 的mRNA 表達顯著降低(P<0.01),而RyR1的mRNA表達水平顯著增加(P<0.01),見圖2。
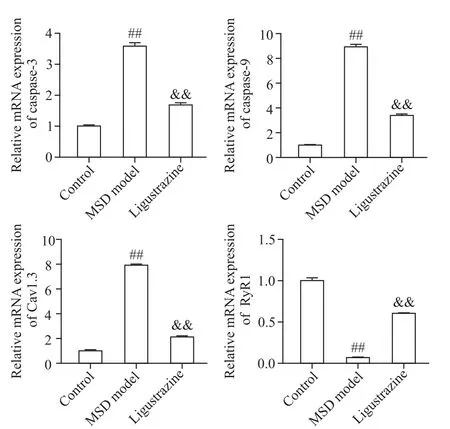
Figure 2. The mRNA expression of caspase-3,caspase-9,Cav1.3,and RyR1 was detected by RT-qPCR.Mean±SD. n=5. ##P<0.01 vs control group;&&P<0.01 vs MSD model group.圖2 RT-qPCR 檢測caspase-3、caspase-9、Cav1.3 及RyR1的mRNA表達水平
4 川芎嗪對細胞凋亡及鈣離子通道相關蛋白表達的影響
Western blot檢測結果顯示,與對照組比較,MSD模型組大鼠比目魚肌中caspase-3、caspase-9 及Cav1.3蛋白表達量顯著增加(P<0.01),RyR1蛋白表達量顯著降低(P<0.01);而與MSD 模型組比較,川芎嗪組大鼠比目魚肌caspase-3、caspase-9 及Cav1.3蛋白表達量顯著降低(P<0.01),而RyR1蛋白表達量顯著增加(P<0.01),見圖3。
此外,我們還通過免疫組化檢測了比目魚肌組織各蛋白的表達情況,與對照組比較,MSD 模型組caspase-3、caspase-9及Cav1.3蛋白的陽性染色(棕黃色)增加,而RyR1蛋白的陽性染色減少;相較于MSD模型組,川芎嗪組caspase-3、caspase-9 及Cav1.3 蛋白的陽性表達降低,RyR1 蛋白的陽性表達增加,見圖4。
討論
MSD 能夠引起肌肉組織結構、功能、代謝發生改變,主要累及骨骼肌細胞,造成細胞膜通透性增加、膜損傷加劇以及膜內外環境穩態發生變化[9]。比目魚肌是腿部骨骼肌重要結構之一,起自膝關節脛骨后端與腓骨頭、下方匯入跟腱止于足底,起旋轉腳面、提足作用[10]。Ca2+-ATPase 是骨骼肌維系肌漿網膜鈣離子穩態的重要蛋白,正常情況下Ca2+儲存在肌漿網中。肌細胞興奮時,誘發肌漿網釋放大量Ca2+,引起肌肉收縮[11]。Ca2+-ATPase 水解ATP 提供能量,通過不對稱地分布于膜內外豐富的Ca2+泵逆濃度梯度攝取胞漿Ca2+重新轉運回肌漿網內腔,解離肌原纖維結合的Ca2+,觸發肌肉舒張[12]。研究發現,大鼠在進行力竭運動后,心肌組織肌漿網Ca2+-ATPase 活性顯著降低[13]。本研究結果顯示,靜態姿勢負荷會導致大鼠比目魚肌中Ca2+-ATPase 活性下降,且呈時間依賴性;而川芎嗪干預逆轉了這一現象,顯著提升了Ca2+-ATPase 的活性,并趨于正常水平。此外,肌細胞L-型鈣離子通道Cav1.3 及RyR1 在Ca2+環境穩態的調節中扮演著重要作用[14]。L-型鈣離子通道(Cav1.2 和Cav1.3)在相對較低的膜電位下容易打開,使Ca2+進入細胞[15]。RyR 為鈣離子釋放通道,RyR1 為亞型之一[16]。本研究顯示川芎嗪干預能顯著調控MSD 大鼠比目魚肌中Cav1.3 的高表達及RyR1 的低表達狀態,推測川芎嗪可抑制肌細胞鈣離子進入通道,促進鈣離子釋放通道蛋白的表達,進而發揮鈣超載的拮抗作用。
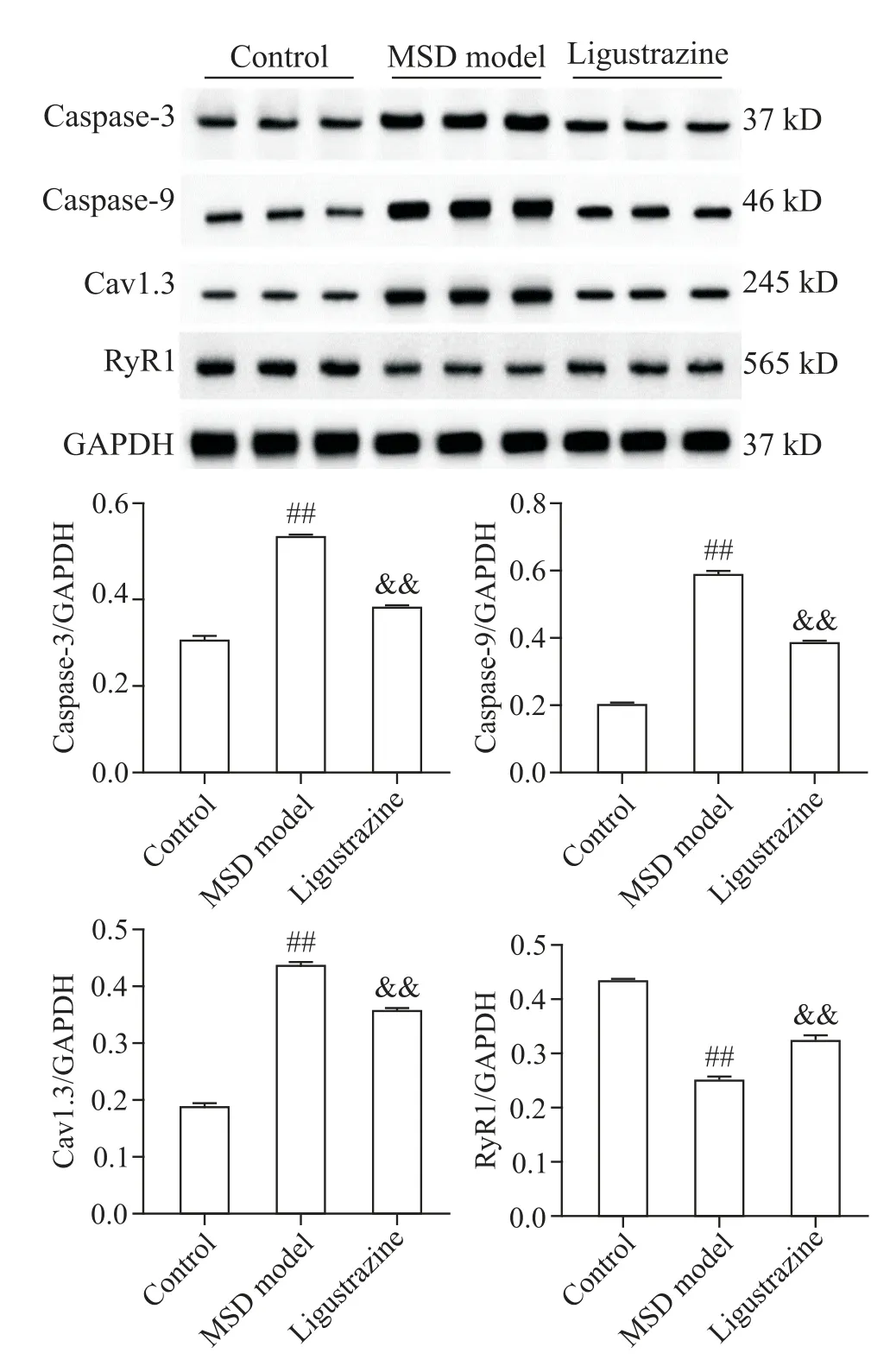
Figure 3. The protein expressions of caspase-3,caspase-9,Cav1.3 and RyR1 was detected by Western blot.Mean±SD. n=5. ##P<0.01 vs control group;&&P<0.01 vs MSD model group.圖3 Western blot 檢 測caspase-3、caspase-9、Cav1.3 及RyR1蛋白的表達水平
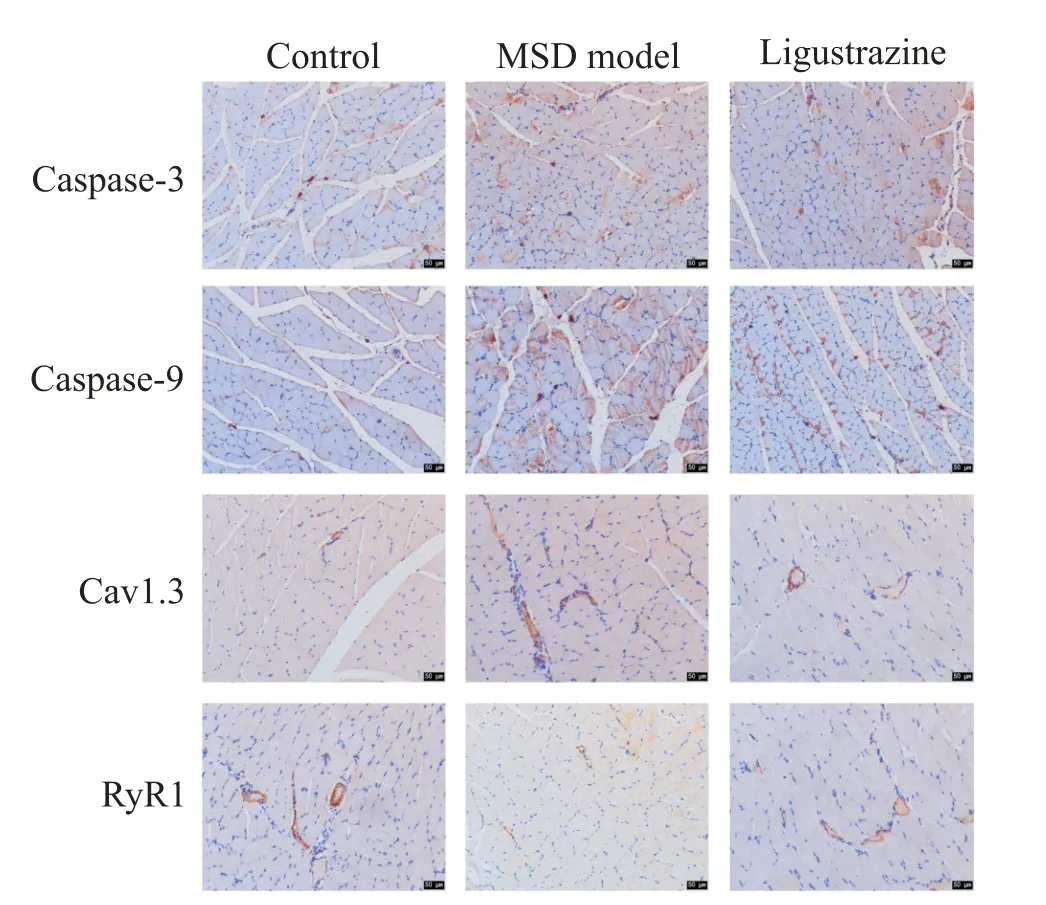
Figure 4. The expression of caspase-3,caspase-9,Cav1.3 and RyR1 was detected by immunohistochemistry. The positive expression of caspase-3,caspase-9,Cav1.3 and RYR1 protein was found in the brown yellow region. The scale bar=50 μm.圖4 免疫組化檢測caspase-3、caspase-9、Cav1.3及RyR1蛋白的表達
鈣超載被認為是造成細胞不可逆損傷的主要原因,持續性鈣超載可誘發細胞凋亡的發生[17]。已有研究表明,川芎嗪可通過抑制谷氨酸、KCl 誘導的神經細胞內鈣超載促進體外培養的大腦皮層神經細胞存活[18]。此外,川芎嗪的衍生物-川芎嗪硝酮也能顯著提高視網膜節細胞的存活率,并顯著增強大鼠視覺電生理的光反應幅度,其機制可能與降低由NMDA 受體所提高的cleaved caspase-3/caspase-3、Bax/Bcl-2的比值有關[19]。上述研究提示川芎嗪可拮抗鈣超載,緩解細胞凋亡,本研究結果與之相一致,川芎嗪能顯著抑制鈣超載介導的MSD大鼠比目魚肌細胞的凋亡,其機制可能與抑制caspase-3/-9 介導的凋亡信號通路有關。
綜上所述,川芎嗪能顯著提升靜態姿勢負荷后MSD 大鼠比目魚肌中Ca2+-ATPase 的活性,抑制Cav1.3 表達,促進RyR1 表達,進而拮抗負荷狀態下的鈣超載現象,并通過抑制凋亡信號通路緩解由鈣超載介導的細胞凋亡,但川芎嗪更詳盡的作用機制還需進一步研究。

