海洋酸化與磷濃度變化對龍須菜光合作用和ATPase活性的影響
衛燕云, 金鵬, 江瑩瑩 , 夏建榮, *
海洋酸化與磷濃度變化對龍須菜光合作用和ATPase活性的影響
衛燕云1, 金鵬2, 江瑩瑩2, 夏建榮2, *
1. 廣州大學生命科學學院, 廣州 510006 2. 廣州大學環境科學與工程學院, 廣州 510006
以大型海藻龍須菜()為實驗材料, 設置不同CO2濃度(400μL·L–1和1000μL·L–1)和磷濃度(0.5和30 μmol·L-1)實驗, 探討大氣CO2濃度升高對不同磷濃度培養下龍須菜生長、光合作用及ATPase活性的影響。結果顯示大氣CO2下, 磷加富導致龍須菜的相對生長速率和最大光合速率增加, 暗呼吸速率降低; 但高CO2濃度下, 磷濃度變化對三者的影響不明顯。不論是在大氣CO2濃度還是高濃度CO2下, 磷加富對葉綠素a、類胡蘿卜素含量和實際光化學效率均沒有明顯影響, 但導致ATPase活性均明顯增加。以上結果表明在高濃度CO2誘導海洋酸化環境中, 磷加富可以通過調節光合速率、暗呼吸速率和ATPase活性, 改變能量的利用效率調控其生長。
龍須菜; 二氧化碳; 生長; 光合作用; ATPase活性
0 前言
隨現代工業化發展, 大氣中CO2的濃度正不斷升高, 據IPCC預測, 到21世紀末, 大氣CO2濃度將升高到1000 ppm[1]。大氣中CO2濃度升高, 導致海洋酸化, 據估計至本世紀末, 海洋表層海水的pH將繼續下降0.3—0.4個單位[2]。藻類是海洋中的初級生產力的主要貢獻者, 在全球碳循環中起著非常重要的作用, 它們對大氣CO2濃度升高的響應已經引起廣泛關注。大氣CO2濃度升高對大型藻類的影響會呈現種間異質性[3]。CO2加富導致的海洋酸化可降低部分大型海藻石莼()和龍須菜(.)的光合作用[4], 但對另外一些種類的大型海藻, 無明顯影響或表現為正面促進[5-6],如江籬屬的[7]。
大氣CO2升高導致全球升溫, 增強海水分層、減低海洋混合層深度, 削弱從深海向表層海水的營養鹽補充, 從而導致海洋表層水體中營養鹽濃度(如磷濃度)降低[8-9]。同時近海水域受納的工、農業及生活廢水增加, 以及水產養殖業的污染日益嚴重, 海水中磷等營養鹽含量大幅度增加[10-11]。磷是大型海藻生長的必需的大量元素, 其存在于細胞的磷脂、核酸和核蛋白中。磷脂是生物體細胞質, 生物膜和很多酶的重要組成成分, 在生物的能量傳遞和新陳代謝中起著關鍵作用[12]。大型海藻在生長過程中通過吸收氮磷, 同化成自身需要的營養成分, 在近海碳循環中發揮著重要的作用。當氮磷營養鹽濃度較高時, 大型海藻具有儲存大量營養鹽的能力, 因此大型海藻是海洋生態系統中重要的氮庫和磷庫。研究表明, 海水中磷濃度加富, 對海藻光合磷酸化過程有明顯的促進作用, 最終刺激海藻的生長。海水無機磷濃度升高導致了海藻的生長和豐度增加[13]。高磷水平下, 海藻對磷的吸收速率、光合作用和色素含量都明顯的升高[12]。面對海洋酸化和富營養化, 大型海藻如何響應已越來越受到人們的關注。徐智廣等探討了不同 CO2濃度和磷水平對龍須菜的影響, 發現CO2加富會刺激龍須菜對磷的吸收, 同時磷濃度也能調節不同CO2濃度培養下龍須菜無機碳的利用[14], 但未涉及CO2加富和磷對龍須菜ATPase活性影響報道。本研究將在已有基礎上探究CO2加富和磷濃度對龍須菜ATPase活性影響。龍須菜()隸屬于紅藻門江蘺屬江蘺科, 生長快, 產量高, 其細胞壁富含瓊膠且質量較好, 是中國近岸重要的經濟海藻[15]。
本文利用龍須菜作為實驗材料, 分析不同CO2濃度與不同磷營養條件下龍須菜藻體的相對生長速率、光合作用、藻體內可溶性蛋白質、色素含量及ATP酶活等生理生化指標的變化, 探討了磷濃度變化可能影響海洋酸化對龍須菜的效應(包括ATP酶活性等), 旨在為未來海洋酸化環境中大型海藻的養殖提供理論依據。
1 材料與方法
1.1 實驗材料
本實驗所用龍須菜()于2018年7月采于廣東南澳島近海筏式養殖區采取, 于低溫條件運至實驗室, 用過濾的自然營養加富海水(pH=8.2, 鹽度為33, NO3-N: 10 μmol·L-1, PO43-P: 0.5 μmol·L-1), 通過濾空氣, 暫養3 d, 暫養條件為: 溫度20℃; 光照強度100 μmol photos ·m-2·s-1; 光暗周期為12 h: 12 h。選取生長狀況較一致的個體作為正式實驗材料。
將實驗材料置于裝有2 L培養液的錐形瓶中, 培養密度為0.4 gFW·L-1。實驗設置四個處理: 兩種不同CO2濃度(LC=400 μL·L-1和HC=1000 μL·L-1)和磷濃度(LP=0.5 μmol·L-1和HP=30 μmol·L-1NaH2PO4), CO2濃度通過CO2加富器(CE100D-3A; 武漢瑞華儀器設備有限責任公司; 武漢, 中國)來控制。光溫條件同暫養條件。每組設置三個重復, 通過通入不同CO2濃度空氣調控培養液中pH值分別為8.20±0.05和7.80±0.05, 每兩天更換一次培養海水, 培養7d后進行龍須菜進行各項生理指標的測定。
1.2 測定項目
1.2.1 相對生長速率(RGR)
分別測定實驗開始時藻體的鮮重(W0)和培養結束鮮重(Wt), 通過下列公式計算期間的相對生長速率(RGR):
RGR(% day-1)=ln(Wt/W0)/t ×100%
其中, W0為藻體初始重量(FW), Wt為實驗中第t天的藻體鮮重(FW)。
1.2.2 色素含量測定
葉綠素a(Chla)的測定計算參照Ritchie等[16]的方法, 類胡蘿卜素(Car)含量的測定參考Stickland[17], 用丙酮研磨一定鮮重的藻體, 定容, 離心, 取上清液測量其在波長480 nm、510 nm、647 nm、664 nm和750 nm處的吸光值。通過如下公式計算色素含量:
Chla=12.25×(A664-A750)-2.55×(A647-A750)
Car=7.6×(A480-A750)-1.49×(A510-A750)
1.2.3 可溶性蛋白含量(SP)的測定
采用考馬斯亮G-250染料結合法。取0.05 g藻體用0.1 mol·L-1的磷酸緩沖液(pH=6.8)研磨, 定容, 離心, 取0.5 mL上清液加5 mL考馬斯亮藍G-250, 混勻后595 nm測定其吸光度。其計算公式為:
SP=C×V1/V2×W×1000
式中: C為查得的牛血清標準曲線值(μg); V2為提取液總體積(mL); W為樣品鮮重(g); V1為測定時的加樣量(mL)。
1.2.4 P-I曲線測定
稱取鮮重0.05 g龍須菜放入存有5mL自然營養加富海水的反應杯中。在20℃下, 用氧電極(YSI Model 5300, Yellow Springs, OH, USA)測定反應杯中氧濃度的變化。光源由碘鎢燈提供, 不同光強(0-800 μmol photons·m-2·s-1)通過調節反應杯與光源之間的距離獲得, 光強用光量子測定儀(MQ-500, Apogee, UK)測定。
P-I曲線的參數值通過擬合曲線獲得, 光合效率(α)為P-I曲線在低光時的初始斜率, 光補償點(Ic)和光飽和點(Ik)通過Rd/α和Pm/α計算(Henley 1993),

式中Rd為暗呼吸速率, Pm為飽和光下的最大光合放氧速率。
1.2.5 葉綠素熒光參數測定
通過便攜式調制葉綠素熒光儀(PAM-2100, Heinz Walz GmbH, Germany)測定葉綠素熒光參數。弱測量光和光化光分別為0.01和100 μmol photons·m-2·s-1,飽和脈沖光為 5000 μmol photons ·m-2·s-1持續0.8 s。PSII的實際光能轉化效率(Yield)[18-19]通過以下公式計算:
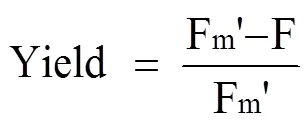
Fm'為光化光的最大熒光產量穩定水平; F為激發狀態下的實時熒光。
1.2.6 ATP酶活性測定
取培養后藻體0.05 g于STN(蔗糖-Tricine-NaCl溶液)緩沖液中研磨過濾, 加入激活液(0.25 mol·L-1Tris-HCl, pH=8.0, 0.5mol·L-1NaCl, 0.05 mol·L-1MgCl2, 50 mmol·L-1DTT, 0.5 mmol·L-1PMS)于室溫在白熾光50000 Lx下進行光激活6 min。再加入0.5 mL的反應液(0.5 mol·L-1Tris-HCl, pH=8.0, 0.05 mol·L-1MgCl2, 50 mmol·L-1ATP), 置于37℃水浴中(冰浴作空白)保溫10 min, 各加入0.1 mL20%的三氯乙酸停止反應, 離心后各取上清液測定ATP水解后的無機磷濃度[20]。酶活性用每毫克每分鐘蛋白質分解ATP釋放無機磷的含量來表示[ μmol Pi (mg Pro.min)-1]。
單位時間內葉綠素的ATP酶活力= C × VT×1000/(Vs × t × W)
式中: C為標準曲線上查得的無機磷含量, μmol/L; VT為反應體積, ml; W為可溶性蛋白的質量濃度, mg/ml; Vs為測定時取用體積, ml; t為反應時間, min。
1.2.7 統計分析
所有實驗的測定結果表示為平均值±標準差(n=3), 不同CO2濃度培養下磷的效應用t-檢驗進行統計顯著性分析, 以P<0.05作為差異的顯著性水平, 數據圖中不同字母表示有顯著差異。
2 結果
2.1 不同CO2濃度和P濃度對龍須菜生長的影響
圖1為不同CO2濃度和磷濃度培養下龍須菜的相對生長速率。在大氣CO2濃度培養下, 與低磷濃度培養相比, 高磷濃度培養的龍須菜其生長速率明顯加快, 其相對生長速率增加了17.84%(P<0.05, P=0.029); 但在高CO2濃度下, 兩種磷濃度培養下龍須菜的相對生長速率無顯著差異(P>0.05, P=0.30)。可見高濃度CO2培養抑制了磷對生長的促進效應。
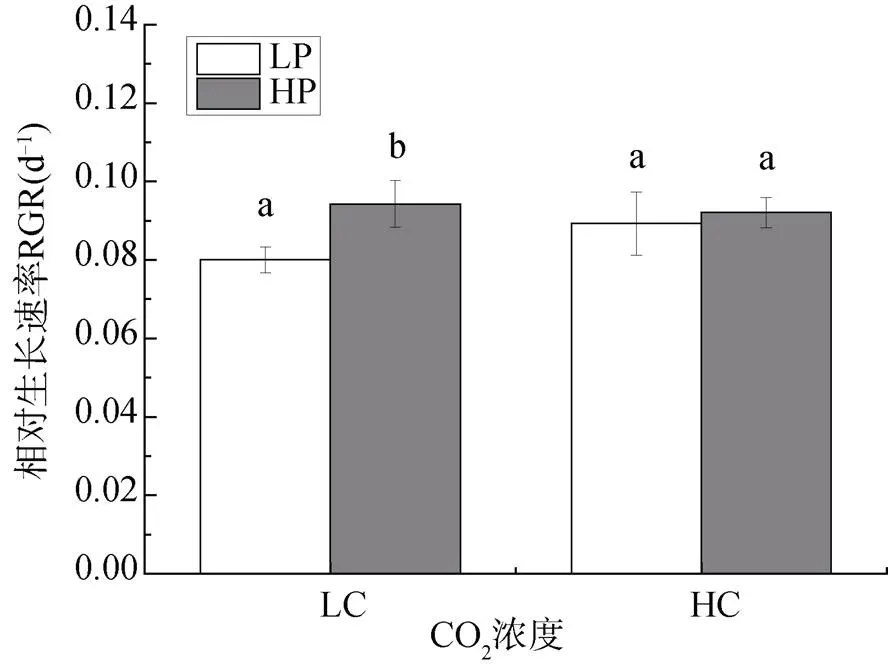
注: 不同小寫字母表示具有顯著性差異(P<0.05)。
Figure1 Relative growth rate ofgrown under different CO2and P concentrations. The different letters have a significant effect onat the same CO2concentration (< 0.05)(LC:ambient CO2level; HC:elevated CO2level; LP: low P concentration; HP: increased P concentration)
2.2 CO2濃度和P濃度對藻體色素含量的影響
不同CO2和磷濃度培養下龍須菜的葉綠素a (Chla)含量變化如圖2所示。結果顯示, 不論是在大氣CO2濃度還是高CO2濃度下, 磷濃度對龍須菜葉綠素a含量均無顯著影響(P>0.05)。與Chla含量趨勢一致, 兩種CO2濃度下, 磷濃度升高對龍須菜的類胡蘿卜素(Car)含量均無顯著影響(P>0.05) (圖3)。可見, CO2濃度升高并沒有改變磷對色素的影響效應。
2.3 CO2濃度和P濃度對藻體中可溶性蛋白含量的影響
不同CO2濃度和磷濃度培養對龍須菜藻體中可溶性蛋白的含量影響如圖4所示, 在大氣CO2濃度培養時, 低磷濃度和高磷濃度下可溶性蛋白含量分別為51.59±6.00和55.363±6.1mg·g-1FW; 高CO2濃度下, 分別為49.23±4.10和49.260±8.9 mg·g-1FW, 可見在不同CO2濃度培養下, 磷濃度變化均沒有對可溶性蛋白含量產生顯著影響(P>0.05)。
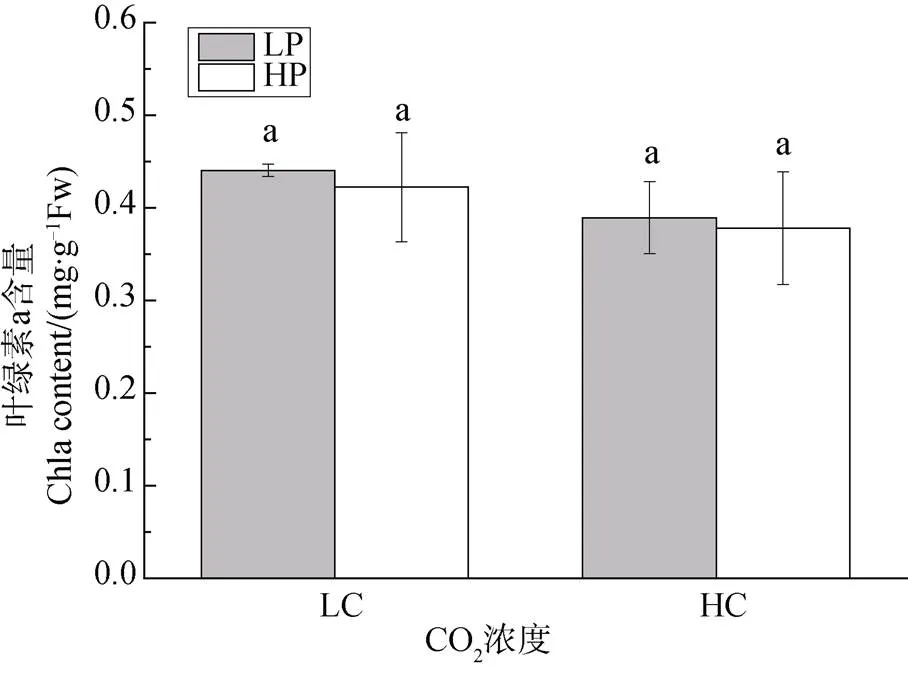
注: 不同小寫字母表示具有顯著性差異(P<0.05)。
Figure 2 The change of Chlcontent incultured under different CO2and P concentrations
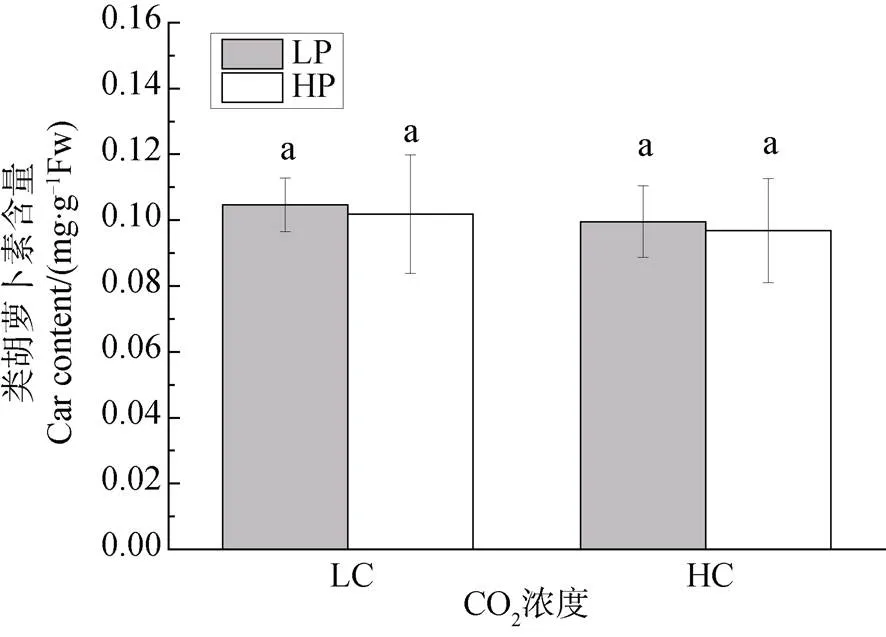
注: 不同小寫字母表示具有顯著性差異(P<0.05)。
Figure 3 Effects of different CO2and P concentrations on Car content of
2.4 不同培養條件對龍須菜光合作用光響應曲線(P-I 曲線)的影響
不同CO2和磷濃度培養下龍須菜的P-I曲線如圖5所示, 在大氣CO2濃度條件下, 與低磷濃度培養相比, 高磷濃度培養下Pm、和Ik明顯增加(P<0.05), 分別增加28.01%和35.56%, 而Rd降低33.77% (P<0.05), 但對α和Ic沒有明顯影響(P>0.05)。但在高CO2濃度培養下, 磷濃度變化對Pm、Rd、α、Ic和Ik沒有顯著影響(P>0.05)。因此, CO2濃度升高, 降低了龍須菜光合作用對磷濃度的敏感性。
2.5 不同CO2和磷濃度培養條件對葉綠素熒光參數Yield的影響
圖6表示不同CO2濃度和磷濃度培養下龍須菜實際光化學效率的變化。從圖中可以看出, 不論是在大氣CO2濃度還是高濃度CO2培養下, 磷濃度變化均沒有明顯影響實際光化學效率(P>0.05)。
2.6 不同CO2和P培養條件對龍須菜的ATPase活性影響
不同CO2和磷濃度培養的龍須菜藻體ATPase活性情況如圖7所示。培養期間無論是在低CO2濃度還是在高CO2濃度下, 龍須菜的ATPase活性均隨著環境中磷濃度的增加而增強。隨著磷的加富, ATPase活性分別提升了13.89%和18.11%(P<0.05)。
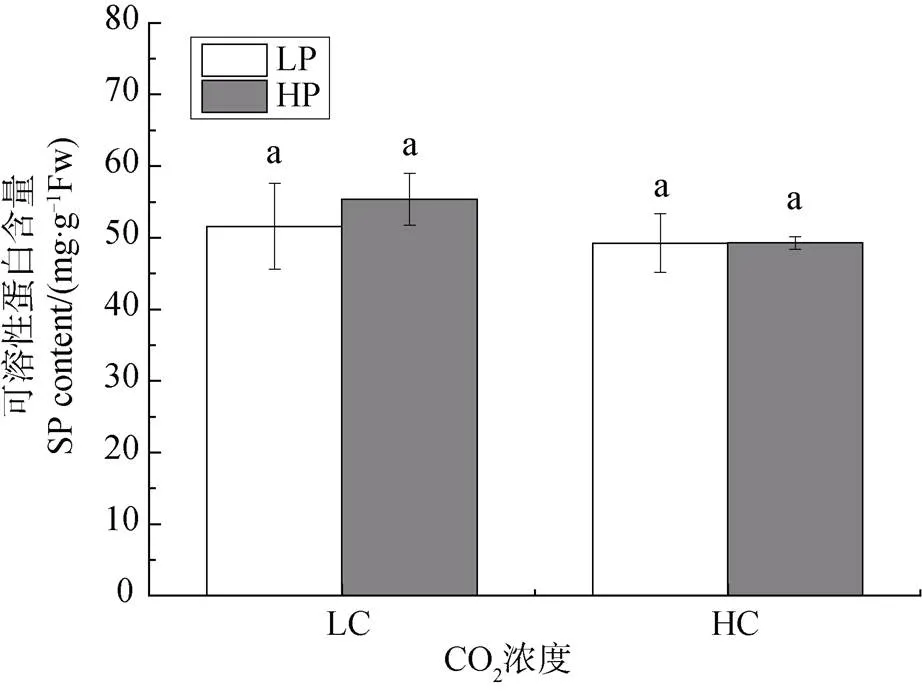
注: 不同小寫字母表示具有顯著性差異(P<0.05)。
Figure 4 The changes of soluble protein ingrown under different CO2and P concentrations
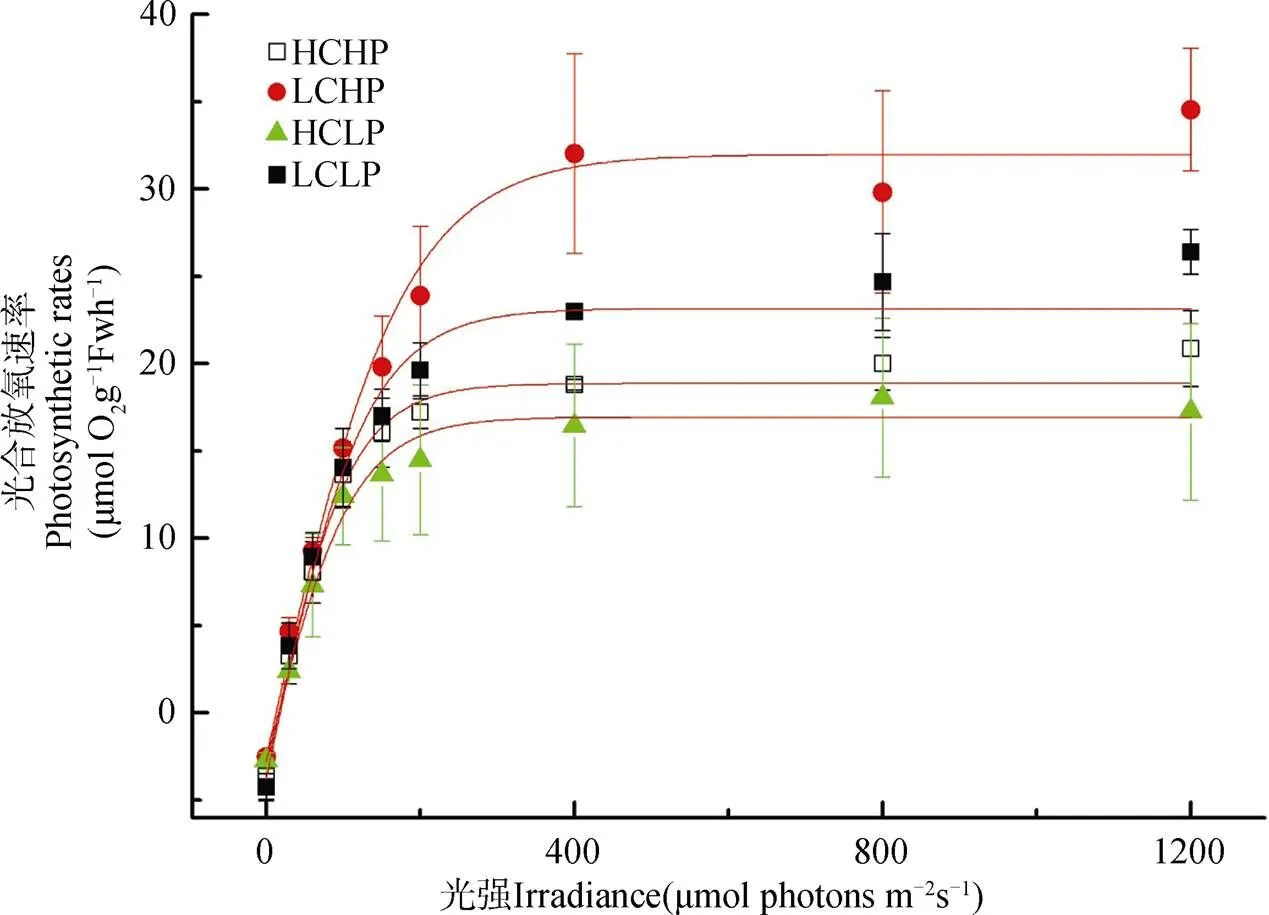
圖5 在不同條件培養下的龍須菜的P-I曲線
Figure 5 P-I curves ingrown under different CO2and P concentration.
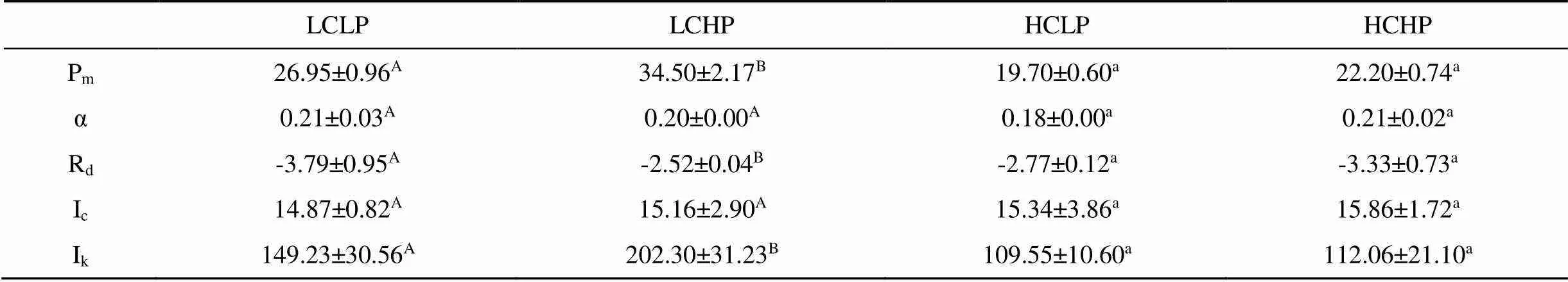
表1 在不同CO2和P濃度培養下龍須菜的 P-I 曲線參數
注: 表中同行不同字母表示不同處理間差異呈顯著水平(<0.05)。
最大光合速率Pm: μmol O2·g-1Fw·h-1; 光合效率α: ( μmol O2·g-1Fw·h-1) /(μmol photons·m-2·s-1); 暗呼吸速率Rd:μmol O2·g-1Fw·h-1; 光補償點Ic: μmol photons·m-2·s-1; 光飽和點Ik: μmol photons·m-2·s-1
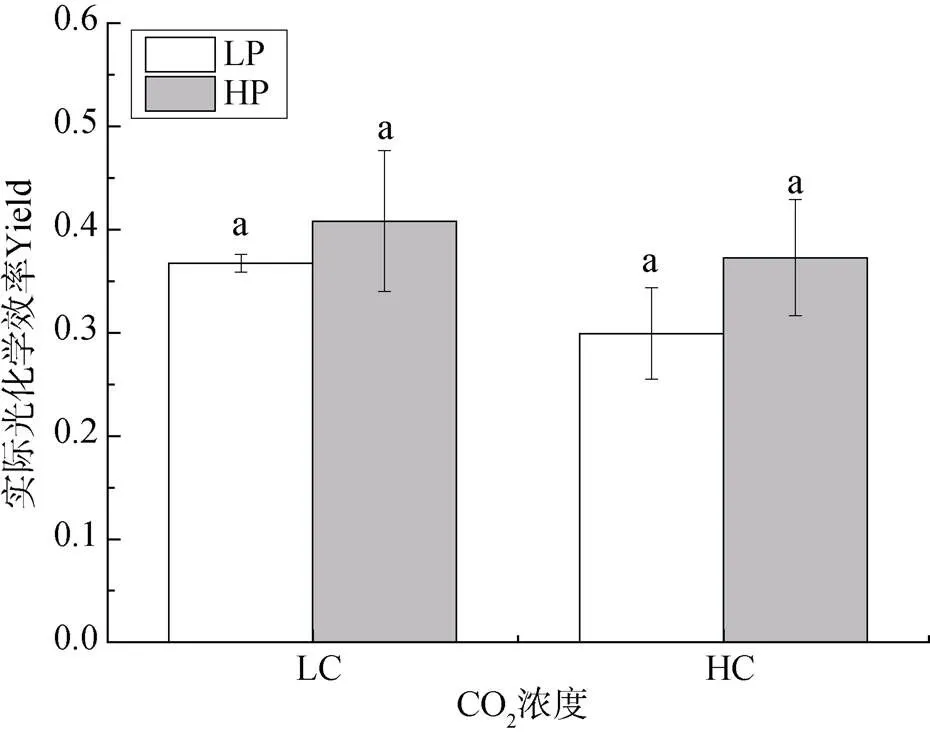
注: 不同小寫字母表示具有顯著性差異(P<0.05)
Figure 6 The changes of Yield ofgrown under different CO2and P concentrations
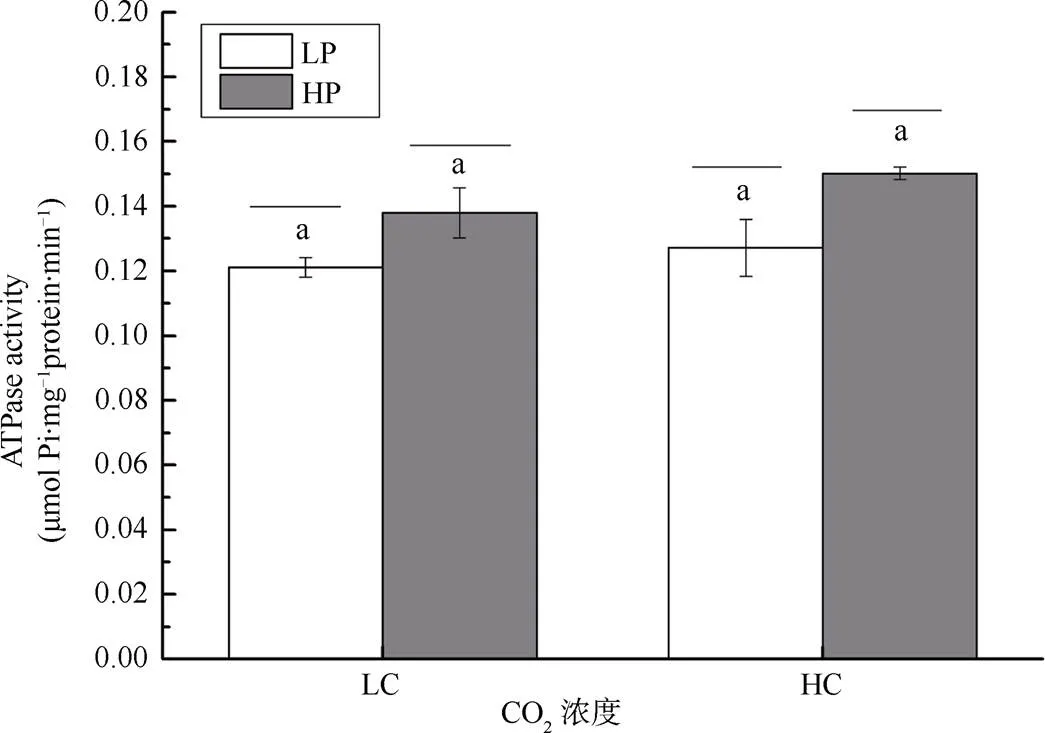
注: 不同小寫字母表示具有顯著性差異(P<0.05)
Figure 7 Effects of different CO2and P concentrations on ATPase activities in
3 討論
海藻的生長涉及一系列復雜的生理代謝過程, 磷是生物體的必需元素, 是三磷酸腺苷(ATP)傳遞能量的核心元素[21]。目前我們的研究結果顯示在正常大氣CO2濃度下, 較高的磷濃度導致龍須菜相對生長速率明顯增加, 這可能與磷加富可以促進RuBP的合成, 或提高Rubisco酶的活性有關[ 22-23]。但大氣CO2濃度升高所誘導的海洋酸化環境中高磷濃度并未對龍須菜的生長產生同樣的效應, 這一結果顯示海洋酸化環境中磷濃度增加對龍須菜的生長效應受到了一定程度上的抑制, 這與Xu 等(2007)的研究結果一致[29]。光合和呼吸是直接影響大型藻類碳代謝和生長的重要生理過程[26]。Farmaki 等(2014)的研究表明大氣CO2濃度下, 磷濃度增加可提高大型藻類的凈光合速率[11,25]。我們的研究結果也印證了這一點: 即正常大氣CO2濃度條件下, 磷濃度的增加明顯提高龍須菜的最大光合速率(Pm)和光飽和點(Ik), 同時暗呼吸速率(Rd)明顯下降, 表明磷加富可提高龍須菜的光合能力, 降低暗呼吸速率, 進而促進龍須菜的生長。而在高濃度CO2條件下, 磷加富對龍須菜的Pm、Ik以及Rd均無顯著影響。大型藻類普遍具有自身的碳濃縮機制(CCM), 通過CCM機制來滿足光合作用過程對無機碳的需求[25], 龍須菜光合作用中同樣具有CCM機制進行輔助, 而CCM機制正常運行需要足夠的能量供應, ATP在CCM機制中起了非常重要的作用[26]。
ATP酶的主要功能是催化細胞內ATP水解過程并釋放能量, 維持生命體的正常生命活動需求[31-32], 是生物體能量代謝的關鍵酶。磷是ATP的重要合成底物, 充分的磷供應可維持海洋藻類的無機碳利用過程中ATP合成、相關蛋白合成和酶的磷酸化需求[29-30]。具有正常活性的生命體可通過ATP分解與合成的偶聯循環, 使細胞內ATP含量穩定在一定水平, 但生物體代謝需要的能量愈多, 要求的循環速度就越快[31]。ATPase活性強弱可直接影響這一循環的速度。本研究發現不論是在正常CO2濃度還是高濃度CO2條件下, 高磷濃度下ATP酶活性均明顯增強, 表明高磷環境中細胞內能量的釋放增加。海洋酸化環境中, 雖然能量代謝速度增加, 但這一部分能量并沒有直接用于龍須菜的生長上, 原因可能是此部分能量用于細胞的其他代謝過程, 包括海洋酸化導致的海水中H+濃度增加可能會導致藻類生理調節機制的變化(如營養代謝、細胞膜氧化還原與膜蛋白、電子傳遞等)而引起負面效應[3]。海洋酸化對大型海藻生長的負面效應, 在緣管滸苔(Gao et al., 2018), 條斑紫菜(Gao et al., 2019)和鈍馬尾藻(Xu et al., 2017)中已經得到驗證, 這一現象的主要原因是環境pH下降擾亂了藻體內外的酸堿平衡, 導致藻體需分配更多能量用于內穩態的維持[5,33-34]。
Garcia-Sanchez等(1996)在高磷濃度培養下的藻體中發現藻體葉綠素a和可溶性蛋白含量都有明顯的升高[14]; 但徐智廣的研究顯示磷加富下藻體葉綠素a含量增加, 而藻體可溶性蛋白含量卻降低[29], 這可能與實驗所選擇的海藻種類及營養鹽濃度設置有關。本研究中龍須菜不管是在大氣CO2濃度還是高CO2濃度培養下, 藻體的葉綠素a和Car含量均沒有隨著磷濃度的變化而變化, 這與實際光化學效率與光合效率的變化是一致的, 這表明大氣CO2濃度升高并沒有影響葉綠素和Car合成, 對光能的捕獲和收集并沒有產生明顯的影響。可見高濃度CO2誘導海洋酸化環境中, 磷加富可以通過調節光合速率、呼吸作用速率和ATPase活性, 改變能量的利用效率調控其生長。
4 結論
大氣CO2培養下, 磷加富導致龍須菜的相對生長速率和最大光合速率增加, 暗呼吸速率降低; 但高CO2濃度下, 磷濃度變化對三者的影響不明顯。不管是在大氣CO2濃度還是高濃度CO2下, 磷加富對葉綠素a、類胡蘿卜素含量和實際光化學效率均沒有明顯影響, 但使ATPase活性明顯增加。以上結果表明在高濃度CO2誘導海洋酸化環境中, 磷加富可以通過調節光合速率、暗呼吸速率和ATPase活性, 改變能量的利用效率調控其生長。龍須菜近海養殖已初步產業化, 我們的研究對預測未來海洋酸化環境下海區營養物質(磷濃度)的變化對龍須菜產量的影響具有重要意義。但海洋實際環境較為復雜, 海洋酸化下其它環境因子特別是富營養化(氮濃度變化等)產生的生理學效應需要進一步深入探究。
[1] IPCC (Intergovernmental Panel on Climate Change). Climate change 2007: synthesis report[R]. New York, Cambridge University Press, 2007
[2] Sabine C L, Feely R A, Gruber N,. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305: 367– 371.
[3] 高坤山. 海洋酸化正負效應: 藻類的生理學響應[J]. 廈門大學學報(自然科學版), 2011, 50(2): 411–417.
[4] 鄒定輝, 高坤山, 阮祚禧. 高CO2濃度對石莼光合作用及營養鹽吸收的影響[J]. 青島海洋大學學報(自然科學版), 2001,31(6): 877–882.
[5] XU Zhiguang, GAO Guang, XU Juntian, et al. Physiological response of a golden tide alga () to the interaction of ocean acidification and phosphorus enrichment[J]. Biogeosciences, 2017. 14(3): 671–681.
[6] 徐軍田, 高坤山. 二氧化碳和陽光紫外輻射對龍須菜生長和光合生理的影響[J]. 海洋學報, 2010, 32(5): 144– 151.
[7] ANDRIA J R, VERGARA J J, Perez-Llorens J L. Biochemical responses and photosynthetic performance ofsp. (Rhodophyta) from Cádiz, Spain, cultured under different inorganic carbon and nitrogen levels [J]. European Journal of Phycology, 1999, 34(05): 497–504.
[8] Barker S, Diz P, Vautravers M J, et al. Interhemispheric Atlantic seesaw response during the last deglaciation[J]. Nature. 2009, 457: 1097–1102.
[9] 李小梅, 夏建榮. 氮磷營養限制影響三角褐指藻光合無機碳利用和碳酸酐酶活性[J]. 水生生物學報, 2013, 37(03): 405–412
[10] Fleming-Lehtinen V, Andersen J H, Carstensen J, et al. Recent developments in assessment methodology reveal that the Baltic Sea eutrophication problem is expanding[J]. Ecological Indicators, 2015, 48: 380–388.
[11] Farmaki E G, THOMAIDIS N S, PASIAS I N, et alEnvironmental impact of intensive aquaculture: investigation on the accumulation of metals and nutrients in marine sediments of Greece[J]. Science of The Total Environment, 2014, 485-486: 554–562.
[12] LOBBAN C S, HARRISON P J, DUNCAN M J. The physiological ecology of seaweeds[M]. Cambridge:, 1985
[13] DIAZ-PULIDO G. MCCOOK L J. Effects of nutrient enrichment on the fecundity of a coral reef macroalga[J]. Journal of Experimental Marine Biology and Ecology, 2004, 317(1): 13–24
[14] GAREIA-SANEHEZ M J, FEMANDEZ J A, NIELL F X. Photosynthetic response of P-deficientunder two different phosphate treatments[J]. Physiologia Plantarum, 1996, 96: 601–606
[15] XU Zhiguang, ZOU Duihui and GAO Kaoshan.. Effects of elevated CO2and phosphorus supply on growth, photosynthesis and nutrient uptake in the marine macroalga(Rhodophyta)[J].Botanica Marina, 2010, 53(2): 123–129
[16] 夏邦美, 張峻甫.中國海藻志(第二卷紅藻門第五分冊: 伊谷藻目, 杉藻目, 紅皮藻目)[M]. 北京: 科學出版社, 1999.
[17] Ritchie R J. Consistent sets of spectrophotometric chlorophyll equations for acetone, methanol and ethanol solvents[J]. Photosynthesis Research, 2006, 89(1): 27-41.
[18] STRICKLAND J D H, PARSONS T R. A Practical Handbook of Seawater Analysis[M]. Fisheries Research Board of Canada, Ottawa. 1972: 186–190.
[19] KITAJIMA M, BUTLER W. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone[J]. Biochimica et Biophysica Acta, 1975, 376(1): 105–115.
[20] GENTY B, BRIANTAIS J M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta, 1989, 990(1): 87–92.
[21] 郭培國, 李明啟. 雜交水稻及其親本光合特性的研究Ⅱ. 功能葉片的希爾反應、光合磷酸化、ATP酶活性和ATP含量[J]. 熱帶亞熱帶植物學報, 1997, 5(1): 65–70.
[22] RAO I M, TERRY N. Leaf Phosphate Status, Photosynthesis, and Carbon Partitioning in Sugar Beet: I. Changes in Growth, Gas Exchange, and Calvin Cycle Enzymes[J]. Plant Physiology, 1989, 90(3): 814–819.
[23] LAUER M J, PALLARDY S G, Blevins D G, et al. Whole Leaf Carbon Exchange Characteristics of Phosphate Deficient Soybeans (Glycine max L.)[J]. Plant Physiology, 1989, 91(3): 848–854.
[24] BREMBU T, MüHLROTH A, ALIPANAH L, et al. The effects of phosphorus limitation on carbon metabolism in diatoms[J]. Philosophical Transactions of The Royal Society B Biological Sciences. 2017, 372(1728): 20160406.
[25] CHEN Binbin, ZOU Duihui, MA Jiahai. Interactive effects of elevated CO2and nitrogen-phosphorus supply on the physiological properties of(Bangiales, Rhodophyta)[J]. Journal of Applied Phycology, 2016, 28: 1235–1243
[26] 鄒定輝, 高坤山. 大型海藻類光合無機碳利用研究進展[J]. 海洋通報, 2001, (5): 84–91.
[27] ZOU Duihui, XIA Jiarong, YANG Yufeng. et al. Photosynthetic use of exogenous inorganic carbon in the agarphyte(Rhodophyta)[J]. Aquaculture, 2004, 237: 421–431.
[28] WU Yaping, GAO Kunshan, RIEBESELL U. CO2-induced seawater acidification affects physiological performance of the marine diatom[J]. Biogeosciences, 2010, 7(9): 2915–2923.
[29] 徐智廣. 2種大型經濟海藻對海水中營養鹽供應的生理響應[D]. 汕頭: 汕頭大學, 2007.
[30] ZER H, OHAD I. Light, redox state, thylakoid-protein phosphorylation and signaling gene expression[J]. Trends in Biochemical Sciences, 2003, 28(9): 467–470.
[31] 劉春光, 金相燦, 邱金泉, 等. 光照與磷的交互作用對兩種淡水藻類生長的影響[J]. 中國環境科學, 2005, 25(1): 32–36.
[32] MORSOMME P, BOUTRY M. The plant plasma membrane H+-ATPase: structure、Function and regulation[J]. Biochim.Biophys. Acta, 2000, 1465: 1–16.
[33] Gao Guang, John B, Bao Menglin, et al. Ocean acidification and nutrient limitation synergistically reduce growth and photosynthetic performances of a green tide alga. Biogeosciences, 2018, 15: 3409–3420.
[34] GAO Guang, GAO Qi, BAO Menglin, et al. Nitrogen availability modulates the effects of ocean acidification on biomass yield and food quality of a marine crop. Food Chemistry, 2019, 271: 623–629.
[35] SONDERGAARD T E, SCHU L Z A, Palmgren M G. Energization of transport processes in plants. Roles of the plasma membrane H+-ATPase[J]. Plant Physiol. 2004, 136 (1): 2475–2482
[36] 陳穎, 劉柿良, 楊容孑, 等. 鎘脅迫對龍葵生長、質膜ATP酶活性及氮磷鉀吸收的影響[J]. 應用與環境生物學報, 2015, 21(1): 121–128.
Effects of ocean acidification and phosphorus concentration on photosyn-thesis and ATPase activity of
WEI Yanyun1, JIN Peng2, JIANG Yingying2, XIA Jianrong2,*
1.School of Life Sciences, Guangzhou University, Guangzhou 510006, China 2. School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006, China
The effects of different concentrations of phosphorus (0.5 and 30 μmol·L-1) on the growth, photosynthetic metabolism and ATPase activity ofwere examined under the conditions of low CO2concentration (390μL·L–1) and high CO2concentration (1000μL·L–1). The results were found that the relative growth rate and the maximum photosynthetic rate increased and the dark respiration rate decreased with the enrichment of phosphorus under ambient CO2, but the change of phosphorus concentration had no significant effect at the high level of CO2. At different CO2levels, phosphorus enrichment had no significant effect on chlorophyll a, carotenoid content or actual photochemical efficiency of, but enhanced ATPase activity significantly. The present study shows that high phosphorus regulates the growth ofby adjusting the photosynthetic rate, dark respiration rate and ATPase activity, and changing the efficiency of energy utilization at the high level of CO2.
; CO2; phosphorus; photosynthesis; ATPase activity
衛燕云, 金鵬, 江瑩瑩, 等. 海洋酸化與磷濃度變化對龍須菜光合作用和ATPase活性的影響[J]. 生態科學, 2021, 40(1): 1–8.
WEI Yanyun, JIN Peng, JIANG Yingying, et al. Effects of ocean acidification and phosphorus concentration on photosynthesis and ATPase activity of[J]. Ecological Science, 2021, 40(1): 1–8.
10.14108/j.cnki.1008-8873.2021.01.001
A
1008-8873(2021)01-001-08
2020-06-20;
2020-07-20
國家自然科學基金(41376156)
衛燕云(1996—), 碩士研究生, 主要從事藻類生理生態學研究, E-mail: 2111714024@e.gzhu.edu.cn
夏建榮, 博士, 教授, 主要從事藻類生理生態學研究, E-mail: jrxia@gzhu.edu.cn

