淡化海水的礦化方法淺析
王 琳,張程貽,牟春霞
(中國海洋大學環境科學與工程學院,山東青島 266000)
1 研究背景、目的及意義
地球上的水資源中約有97%為海水,淡水含量僅占3%,而淡水含量中78%存在于冰川中,難以被人們使用,因此,可供人類使用的淡水資源占地球水資源總量的1%[1]。我國淡水儲量占世界總淡水儲量的6%,但我國人口眾多,人均水資源量低,且我國水資源空間分布不均、季節分布不均,淡水資源短缺。海水淡化作為水資源的補充是解決沿海地區淡水資源短缺的重要途徑,也是沿海地區可持續發展的必然要求。
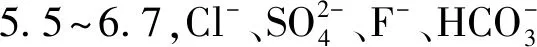
因此,對海水淡化水進行礦化處理,調節pH、提高堿度和硬度對市政管網的保護及用水安全具有重要意義。
2 礦化方法研究現狀
對海水淡化水進行礦化處理可調節海水淡化水的pH、堿度和硬度,使水質不會對輸水管造成腐蝕,且有益人體健康。現代醫學認為,飲用接近人體血液的弱堿性水有利于維持人體內的酸堿平衡,根據嬰兒、中年人、老年人的血液pH,可將pH值控制在7.2~7.5[11-13]。在一定pH下,水的堿度越高,水質越穩定,對管網的腐蝕性也會越低。根據以色列衛生部門頒布的淡化水水質標準規定,總堿度應大于80 CaCO3mg/L[14]。中國軍隊采用低礦化度飲用水礦化衛生標準,其中硬度為100~200 CaCO3mg/L[16]。構成硬度的離子包括Ca2+、Mg2+、Fe2+等,天然水中以Ca2+和Mg2+為主。以色列的淡化水水質標準規定Ca2+含量為80~120 mg/L,中國低礦化度飲用水衛生標準中Ca2+的含量為20~50 mg/L[14-16]。鎂是多種酶反應的輔助物和催化劑,缺鎂會增加多種疾病的患病風險,如高血壓、骨質疏松癥和腦血管疾病等。因此,可在海水淡化水中添加一定量的Mg2+,雖然以色列的淡化水水質標準中沒有規定,但世界衛生組織提出了10 mg/L的推薦含量[16]。
在礦化調節增加健康指數的同時也要注意檢測對管網的腐蝕性,目前公認水的化學穩定性控制指標為堿度、Ca2+的含量、CaCO3沉淀勢(CCPP)和朗格利爾飽和指數(LSI)[14]。CCPP是表示溶液中CaCO3沉積趨勢的定量參數,當CCPP>0時,會產生CaCO3沉淀,在管網內壁結垢,保護管網不會發生腐蝕;當CCPP<0時,CaCO3處于未飽和狀態,會腐蝕管網。因此,應控制CCPP>0且處于合適的范圍,過低可能會導致CaCO3沉淀的驅動力不夠,過高可能需要較高的pH值維持。世界衛生組織對CCPP的規定值為4~10 mg/L,以色列淡化水質要求為3~10 mg/L[14-16]。LSI可以判斷水中CaCO3結垢或溶垢的趨勢,判定水質的穩定性,當LSI<0時為溶垢趨勢;當0
2.1 添加藥劑法
添加藥劑法是指直接向海水淡化水中按比例用計量加藥裝置加入所需成分,如NaOH、NaHCO3、Na2CO3、CaO、CaCl2等。
(1)向海水淡化水中加入Ca(OH)2并加入CO2是比較常用的藥劑添加法,可以在增加淡化水堿度的同時添加Ca2+,降低水的腐蝕性,反應方程式如式(1)。
2CO2+ Ca(OH)2→ Ca(HCO3)2
(1)
工藝流程圖如圖1所示,其優點在于鈣和碳酸氫鹽以當量比為1∶1的比例礦化,但直接使用藥劑所需的成本較高,可用于小型海水淡化裝置,不適用于大型海水淡化工程。此方法可以直接添加藥劑也可以用石灰,但石灰有逆溶解特性,不易溶解。當石灰漿中Ca(OH)2的利用率低于96%且不使用飽和劑時,產水的渾濁度很可能大于要求的上限值(5 NTU),當石灰漿中Ca(OH)2的利用率達98%時,可使產水渾濁度達標[17]。沙特Madinat Yanbu-AL Sinaiyah反滲透海水淡化水廠,設計規模5×104m3/d,采用此方法提高淡化水穩定性。工程中Ca(OH)2前處理相對復雜,包括石灰筒倉、轉移輸送機、漿料制備和定量給料系統[18]。
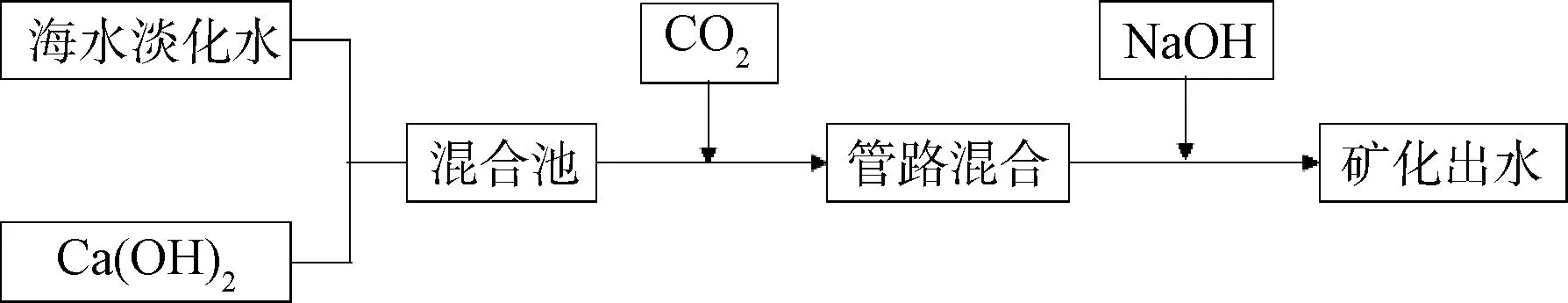
圖1 添加Ca(OH)2與CO2淡化水礦化工藝流程圖Fig.1 Flow Chart of Desalinated Water Mineralization Process with Ca(OH)2 and CO2
(2)投加Ca(OH)2和Na2CO3,反應方程式如式(2)。
Ca(OH)2+ Na2CO3→ CaCO3+ 2NaOH
(2)
該方法對硬度的調節影響不大,對堿度的調節也有限,通常用于含有一定堿度和CO2的水。
(3)投加CaSO4和NaHCO3,反應方程式如式(3)。
CaSO4+ 2NaHCO3→ Ca(HCO3)2+ Na2SO4
(3)
該方法在添加了堿度和Ca2+的同時還增加了硫酸根離子,飲用水中加入一定量的硫酸鹽可以改善口感,但需注意控制劑量,人體攝入過多的硫酸鹽后會出現腹瀉、胃腸道紊亂和脫水。另外,NaHCO3溶解度較低且吸潮性強,在空氣中易潮解,不便于運輸。
(4)投加CaCl2和NaHCO3,反應方程式如式(4)。
CaCl2+ 2NaHCO3→ Ca(HCO3)2+ 2NaCl
(4)
該方法可以調節堿度,增加Ca2+含量,但需要調節pH,且NaHCO3溶解度較低、價格高。另外,會引入Cl-,可能會進一步增加對管網的腐蝕。海南省三沙永興島海水淡化工程選用此方法進行礦化,設計規模1 000 t/d,出水水質達到《生活飲用水衛生標準》(GB 5749—2006)的要求[19]。
以上方式操作運行均較為簡便,易于維護,但所需藥劑用量較大,價格較高,且部分藥品不易于運輸儲存,可以用于小型的淡化水裝置,但不適于大型海水淡化工程。
2.2 與其他水源混合
海水淡化水可以與海水、地下水、自來水等含有礦物質的水源混合,增加水中的礦物含量,增強水質的穩定性。但混合的水源必須是經過處理,可以直接使用的,不會產生化學和生物安全隱患的水。處理的方式和程度取決于水質的優劣,如對于受到藻類過度繁殖、地表徑流和其他人為污染源潛在影響的微污染源水,可以采取顆粒活性炭過濾等強化處理措施[20]。如果水質污染更加嚴重,難以通過簡單過濾處理時,還可以通過一定的化學和生物處理,對摻混水源進行凈化和消毒。
在利用地表水作為摻混水源時,因地表水水質受季節和環境影響變化較大,單純只通過摻混,無法保證全年范圍的水質穩定[21]。史昱驍等[22]用自來水與淡化水分別按5∶1、4∶1、3∶1、2∶1的摻混比混合,研究水樣的pH和總鐵在管網中的含量變化,在摻混比為3∶1時,干管水樣總鐵含量變化范圍最小;在摻混比為3∶1~5∶1時,pH的波動變化較小,水質具有較好的緩沖能力。楊洋等[8]研究表明,礦化出水與淡化水按照體積比為1∶6混合后,所需的Ca2+可以滿足要求,但還需加入100 mg/L的NaHCO3使堿度滿足要求。混合其他水源會提高水質的穩定性和經濟性,但摻混水源需要根據水質進行預處理。同時,摻混水源可能含有其他物質,給消毒帶來困難,消毒后若生成較多消毒副產物,會給人體帶來危害。
2.3 溶解礦石法
將淡化水通過有礦石的濾床,通過溶解礦石中的CaCO3等礦物實現對海水淡化水的礦化。溶解礦石法是目前最簡單且應用最為廣泛的處理海水淡化水的方法[23]。目前多用石灰石作為礦化的原材料,但石灰石在微酸性條件下溶解速率很慢,因此,在淡化水通入礦石濾床前會降低淡化水的pH。
(1)在淡化水通入石灰石濾床前通入CO2調節pH,反應方程式如式(5)。
CaCO3+ CO2+ H2O → Ca(HCO3)2
(5)
工藝流程圖如圖2所示,與CO2和Ca(OH)2反應的方法對比表明,理論上使用石灰石獲得相同的再礦化產物,石灰石溶解法需要的CO2量減半。Hasson等[24]對CO2溶解石灰石進行了研究,認為石灰石的溶解速率是與水質組成有關的函數,石灰石床接觸器的合理設計取決于式(6)~式(7)。何國華等[25]通過對CO2溶解石灰石法進行實驗室研究,利用正交試驗發現,通過調節CaCO3投加量、CO2通入體積流量和攪拌速率可使水質相對穩定,達到在現有鑄鐵管道安全送水的目的。陳紅等[26]對麥飯石、白云石、石灰石、進口礦石對反滲透淡化水的調質效果進行了對比分析,結果顯示進口礦石經過加工處理,出水中的堿度、硬度均較高,但Ca2+較低且pH較高。
(6)
(7)
其中:R——CaCO3溶解速率,mol/(s·cm2);
Q——水的流速,m/s;
S——石灰石的表面積,m2;
[CO2]——水中溶解CO2濃度,mg/L;
[CO2]0——進入反應釜前水中CO2濃度,mg/L;
[CO2]e——平衡時水中CO2濃度,mg/L;
S0——石灰石床層比表面積,m2/g;
ST——石灰石的平均表面積,m2;
k——反應速率常數,mol/(L·s);
ε——床層孔隙度;
V——石灰石床層的體積,m3;
dp——石灰石的粒徑,mm;
φ——石灰石形狀系數;
L——石灰石填料層高度,m;
uapp——表層流速,m/s;

圖2 CO2溶解石灰石淡化水礦化工藝流程圖Fig.2 Flow Chart of CO2 Dissolved Limestone Desalinated Water Mineralization Process
(2)在淡化水通入石灰石濾床前加入硫酸調節pH,反應方程式為式(8)~式(9)。
CaCO3+ H2SO4→ CaSO4+ H2O + CO2
(8)
CaCO3+ CO2+ H2O → Ca(HCO3)2
(9)
Lehman等[27]研究了石灰石溶解反應器中不同淡水流速和不同硫酸用量對產水水質的影響。左世偉等[28]研究了pH、石灰石顆粒粒徑和裝填高度、淡水流量及反應溫度等因素對硫酸溶解石灰石法礦化效果的影響。楊洋等[8]利用雙極膜電滲析技術產生硫酸調節淡化水的pH,再通過方解石顆粒實現海水淡化水的礦化,避免了酸的消耗。
考慮到Mg2+對人體的作用,有學者在礦化后增加了可以添加Mg2+的步驟。如Birnhack等[23]采用硫酸溶解方解石,將溶解的過量Ca2+與Mg2+進行離子交換反應,最終使水中Mg2+的質量濃度達到了12.15 mg/L。部分學者注意到白云石的主成分為CaMg(CO3)2,研究白云石對淡化水的礦化效果,不需多余的步驟即可增加Mg2+含量。Hasson等[29]研究表明,用低CO2含量酸化的脫鹽水可以顯著促進溶解MgO,并且不會使脫鹽水酸化。李東洋等[4]研究了溫度、pH、白云石粒徑、固液接觸時間對白云石礦化淡化水的影響。
用CO2調節時需要所有的礦化水均通過石灰石濾床,而硫酸處理只需要小部分淡化水通過石灰石濾床。但硫酸溶解方解石法的最大缺點是溶解的Ca2+和堿度比例是2∶1,甚至更大,因此,使用硫酸溶解方解石礦化時還需要后續的調節堿度工序。田利等[30]用海水淡化水礦化后的水進行防腐性能研究,結果表明礦化后的水的腐蝕性能仍不能達到標準,還需要加入緩蝕劑,飲用水可加入硅酸鈉緩蝕劑。因此,目前的溶解礦石法還需要進一步的研究,以滿足目前生產生活的多種需要。
2.4 經濟效益對比
直接添加藥劑法所需添加的藥品用量較大,且價格較高,應用于大型海水淡化廠時經濟效益不高,如2011年印尼Adipala 電廠投加CaCl2和NaHCO3溶液,噸水處理價格為0.43元/m3[31]。與其他水源混合法將淡化水與自來水、海水、地表水等水源混合,成本主要來自于后續處理過程,Glueckstern等[32]的研究表明,在某些地區可以用苦咸水與海水淡化水混合,比添加藥劑更加經濟。溶解礦石法所需的藥劑較少,添加的礦石純度高、價格便宜。2012年王奕陽等[13]的研究表明,噸水處理價格約為0.114 1元/m3。2016年龔淑艷等[33]計算的噸水理論運行費用為0.254元/m3,中試運行費用為0.549元/m3。河北曹妃甸反滲透海水淡化工程,規模5萬m3/d,運行兩年后礦化成本為0.091元/m3[31]。
3 結語
海水淡化可以補充淡水資源,對解決沿海地區的水資源短缺及應急用水具有重要意義,目前淡化海水多通過管網進入自來水廠進行后續處理后應用于工業。淡化海水出水水質中的堿度及硬度等都較低,不適合直接飲用,且納入現有城市供水管網會對管網造成腐蝕,因此,需對淡化海水進行礦化處理。本文對現有的礦化過程進行總結對比,分析各種礦化方法的優缺點。在實際礦化工藝選擇中,需綜合考慮工程規模、工程需求、工程效益等因素。未來仍需創新和優化礦化方法,得到經濟性更高、出水水質更好、適應性更強的礦化工藝,使礦化工程得到進一步推廣應用。

