肌骨共病視閾下肌骨共減綜合癥的生物學機制探究
徐帥 余鋒 徐道明 趙春竹 吳文忠
1.淮陰師范學院體育學院,江蘇 淮安 223300 2.南京中醫藥大學附屬醫院,江蘇 南京 210029 3.青島大學附屬醫院,山東 青島 266000
肌肉(muscle)與骨骼(skeleton)相毗鄰,是機體不可分割的兩個重要部分,共同組成肌骨系統(musculoskeletal system)以完成機體行進、站立和運動功能,以及機體免疫、內分泌、神經調節和營養等。《健康中國行動(2019—2030年)》指出,截至2018年底,我國60歲及以上老年人約2.49億,65歲及以上約1.67億。老齡化的快速發展,使得老年人機體退化受到重視。其中,肌肉退化引發的肌少癥(sarcopenia),骨骼衰減引發的骨質疏松癥(osteoporosis)[1],嚴重威脅老年人生命健康安全。隨之,肌骨交互機制深入探析,肌肉和骨骼可通過分泌性因子進行互相調節。雙能X線吸收測試儀(dual energy X-ray absorptiometry,DXA)亦驗證了肌肉和骨骼之間的相關性,這也為研究肌少癥和骨質疏松癥共發病提供了研究導向。在肌骨共病的相關論述中,2016年肌少癥和骨質疏松癥相伴病證,被統稱為“活動障礙綜合征”(dysmobility syndrome)[2],2019年又引出了“肌骨共減綜合癥”(osteosarcopenia)相關論述[1],亦說明肌骨共減綜合癥受到學術持久的關注,肌少癥和骨質疏松癥串擾(crosstalk)為肌骨共病機制提供了新的研究靶向。
1 肌骨流行病學探析
機體成分大約在同一時段內會出現肌肉耗損和骨質流失現象。肌肉質量在25歲左右達到峰值,30歲后即出現肌肉質量丟失,50歲時肌肉纖維數量略微減少,60歲后進入快速衰弱狀態。2010年歐洲老年人肌少癥工作組(European Working Group on Sarcopenia in Older People,EWGSOP)將肌少癥癥狀劃分為:前肌少癥(肌肉質量下降)、肌少癥(肌肉質量下降、伴隨肌力下降或身體功能喪失)和嚴重肌少癥(肌肉質量下降、肌力下降、身體功能喪失)。與肌肉流失現象類似,機體骨量在30歲前為骨量上升期,在30歲左右達到峰值,隨后進入骨量減少階段,該現象在絕經婦女中表現的更為嚴重。研究表明,肌肉質量的增減與骨密度(bone mineral density,BMD)的增減呈正相關。
肌少癥和骨質疏松癥嚴重威脅老年人健康,已成為老年醫學關注的研究重點。亞洲地區老年人肌少癥的患病率為4.1 %~11.5 %,我國大陸高齡農村男性肌少癥患病率為6.4 %,女性肌少癥患病率為11.5 %[3],其中70歲以上男性肌少癥患病率為13.2 %,女性肌少癥患病率為4.8 %[4]。預計到2050年全球罹患肌少癥人數將高達5億人。根據國家衛生健康委員會2018年公開發布的首個中國骨質疏松癥流行病學調查結果分析指出,50歲以上人群患病率為19.2 %,且中老年女性問題尤甚,50歲以上女性患病率達32.1 %,遠高于同齡男性的6 %,而65歲以上女性患病率更是達到了51.6 %,骨質疏松癥已經成為我國50歲以上人群的重要健康問題。
2 肌少癥和骨質疏松癥的生物學機制探析
2.1 肌少癥的生理功能特點
肌少癥被視為老年人機體衰老過程,2018年EWGSOP會議(簡稱EWGSOP2)將肌少癥重新定義為:一種進行性、廣泛性,與跌倒、骨折、身體殘疾和死亡等不良后果發生可能性增加的肌肉疾病。肌少癥的肌肉質量指數是指女性<5.67 kg/m2、男性<7.23 kg/m2的特異性均值。肌少癥的變化基于機能中營養、激素、代謝、免疫功能減弱,以及運動單元、肌纖維退化,肌肉質量和肌肉力量顯著下降。肌少癥中肌肉質量變化受到了更為深入的關注[5]。除此以外,肌肉纖維丟失的肌肉量減少、或肌纖維萎縮也是造成肌少癥的原因之一。
肌少癥發生機制包括以下特征:激素導致的變化:類固醇激素(corticosteroids)、生長激素(growth hormone,GH)和胰島素樣生長因子-1(insulin-like growth hormone 1,IGF-1)表達水平改變、甲狀腺功能異常、胰島素抵抗;年齡導致的變化:性激素水平下降、細胞凋亡、線粒體紊亂;廢用性缺陷導致的變化:久坐不動、機體活動受限引發的機能退化;以及神經退行性疾病;營養不良;惡病質等[6]。最新研究發現,肌肉質量下降會增加代謝綜合癥發生,而代謝綜合癥惡化又可進一步增加冠心病、高血壓等心腦血管疾病的患病率。
2.2 骨質疏松癥的生理功能特點
肌少癥患者的髖部骨折風險高,老年人臀肌體積增加有助于降低髖部骨折風險[7]。即肌少癥會引發骨微結構變化,骨質疏松是以低骨量為特征的骨骼疾病,易出現骨微結構退化和骨折風險。50~65歲女性雌激素缺乏,可影響至絕經后15~20年之久,其中雌激素的缺乏與骨小梁吸收加快有關,使得骨穩態失衡,引起骨質疏松癥發生;男性主要特征是骨皮質和骨小梁丟失[8]。美國國家骨質疏松基金會(The National Osteoporosis Foundation,NOF)建議對65歲以上女性和70歲以上男性進行BMD檢測[9]。基于BMD的檢測,BMD值減1個標準差(SD)為正常,降低(1~2.5)SD為骨質減少,降低2.5 SD以上為骨質疏松癥。
骨質疏松癥根據其發病原因可分為兩種,一原發性骨質疏松癥,通常與年齡和性激素缺乏有關,使得骨小梁持續惡化。絕經女性與雌激素生成減少有關;老年男性與性激素結合球蛋白活性減弱有關。二繼發性骨質疏松癥,由合并癥和/或藥物引起,涉及鈣、維生素、炎癥反應和性激素失衡機制,男性過度飲酒,糖皮質激素和性腺功能減退易引起骨質疏松;女性高鈣尿癥、鈣吸收不良、甲狀旁腺功能亢進癥、維生素D缺乏癥、甲狀腺功能亢進癥等易引起骨質疏松[10]。
3 肌骨共減綜合癥的生物學機制探析
肌少癥和骨質疏松癥的病理生理學揭示了機體重疊特征(圖1)。針對300多例髖部骨折女性的研究,58 %患有肌少癥[11]。男性肌骨共減綜合癥患者骨折風險增加3.5倍[12]。即機體患有肌少癥/骨質疏松癥后,在導致肌肉/骨骼質量下降的基礎上,會引發骨骼/肌肉功能的代償性衰減,最終引起并發性機體功能喪失,導致肌骨共減綜合癥的生成和進一步惡化,引發機體殘疾和骨折死亡率的風險顯著提高。
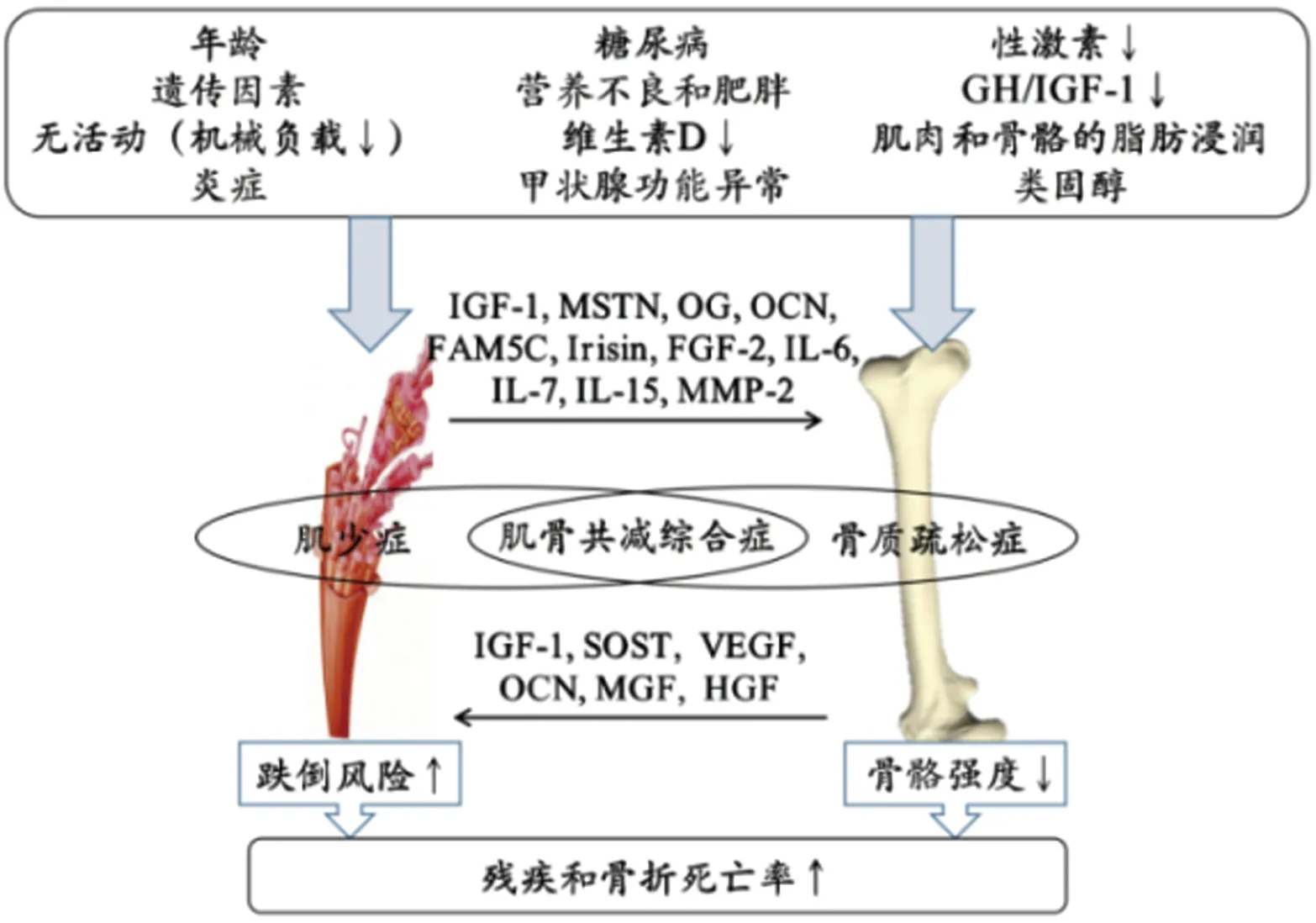
圖1 肌骨共減綜合癥的生物學機制示意圖[11]Fig.1 Schematic diagram of the biological mechanism of osteosarcopenia
在肌骨共減綜合癥的肌肉生理機制中,IGF-1可共同結合肌肉和骨骼合成代謝,具有成骨作用,促進成骨細胞存活,IGF-1通過PI3K/AKT/mTOR信號增強成骨細胞前體(osteoblast precursors cells,OBPC)增殖[13]。與WT小鼠相比,IGF-1-/-小鼠骨小梁減少;肌肉中IGF-1過表達會引起肌肉質量提高,引起骨量增加[14]。肌肉生長抑制素(myostatin,MSTN)對肌肉生長具有負調節功能,可增強肌纖維化,并抑制骨骼修復,嚴重肌肉創傷和肌肉損傷可增加MSTN表達,損害骨骼愈合水平。骨誘導因子(osteoglycin,OG)抑制早熟成骨細胞分化。骨鈣素(osteocalcin,OCN)屬于細胞外非膠原骨基質糖蛋白,OCN-/-小鼠出現骨質減少和骨礦物質含量降低現象。序列相似家族5成員C(family with sequence similarity 5 member C,FAM5C)在成骨細胞分化過程中表達增加[14]。鳶尾素(Irisin)對骨骼具有合成代謝功能,對BMD和骨骼機械特性能夠產生積極的影響[15],有效改善后肢垂懸小鼠骨質疏松。在肌組織中成纖維細胞生長因子2(fibroblast growth factor-2,FGF-2)通過胞吐作用從細胞內輸出,對骨形成有積極作用,促進新骨生成[16]。白細胞介素(interleukin,IL)中IL-6、IL-7和IL-15參與肌骨共減綜合癥生理調節,IL-6屬于骨骼前吸收細胞因子,促進骨形成,IL-6缺失會引起骨質疏松。IL-7處理的雌性小鼠中B淋巴細胞生成和骨量變化與年齡匹配的卵巢切除術小鼠相似。IL-15過度表達以及IL-15水平的全身升高會導致骨量增加[17]。運動和機械負荷會增加肌肉細胞中基質金屬蛋白酶-2(matrix metalloproteinase-2,MMP-2)分泌水平,MMP-2缺陷小鼠骨質減少和骨折愈合延遲[18]。
在肌骨共減綜合癥的骨骼生理機制中,IGF-1參與到肌肉調節過程,局部輸注IGF-1導致肌肉肥大[19]。骨硬化素(sclerostin,SOST)屬于骨骼積聚負性調節物,通過阻斷低密度脂蛋白受體相關蛋白(low-density-lipoprotein receptor-related protein,如LRP5和LRP6)來抑制經典Wnt信號[20],骨髓間充質基質細胞分泌的血管內皮生長因子(vascular endothelial growth factor,VEGF)可刺激成肌細胞增殖[11]。OCN可間接調控肌肉糖脂代謝,發展肌肉耐力,誘導肌肉代謝,提高葡萄糖攝取和線粒體生成,OCN-/-小鼠會出現β細胞增殖、葡萄糖耐受不良和胰島素抵抗等現象[21]。機械負荷增加骨細胞MLO-Y4細胞中IGF-1、力生長因子(mechanogrowth factor,MGF)、VEGF和肝細胞生長因子(hepatocyte growth factor,HGF)分泌水平[22]。研究發現,發生肌肉損傷時MGF可先于衛星細胞激活發生,促進衛星細胞增殖,骨源性HGF可促進功能性肌肉重塑,增強肌肉再生[23]。
綜上所述,肌骨共減綜合癥被認為是肌少癥和骨質疏松癥共病的肌骨機能狀態[24]。針對肌骨共減綜合癥的預防或緩解中,除醫療手段以外,運動干預肌少癥中抗阻運動(resistance exercise,RE)是肌蛋白合成的刺激因素,也是提高老年人肌肉力量和身體素質的有效方法[25];骨質疏松癥采用直接應力刺激,能夠有效改善骨骼質量,緩解骨質流失。由此在肌骨共減綜合癥治療中,正視運動干預手段,形成有效“體醫融合”過程,將肌肉刺激骨骼,骨骼刺激肌肉相結合,可有效延緩老年人肌骨共減綜合癥。
4 總結與展望
肌少癥和骨質疏松癥是與年齡相關的全身性、進行性疾病。肌肉和骨骼作為機體運動器官,不僅存在網絡通信作用,共同承擔機體運動、免疫、內分泌、營養等交互功能,同時二者發生發展過程受到彼此間的相互調節。伴隨整合醫學和交叉機制逐步延伸,關于肌骨系統學說相關論述報道一直穩定增長,為應對肌少癥和骨質疏松癥提供了新的研究機制,以此進一步了解其生理病理作用。而旨在將肌骨共減綜合癥延伸貫通,更深入靶向的研究[26],需要引入更廣泛的干預機制或手段:其一,引入體育科學研究機制,推進體醫學融合,引入美國運動醫學會“運動是良醫”理念,做好運動處方在肌骨共減綜合癥的介導和干預;其二,引入營養學研究機制,增加維生素D、食物攝取等營養干預,可有效抑制或緩解肌骨共減綜合癥的發生或惡化;其三,引入整合醫學研究機制,在探析肌骨共減綜合癥過程中,需要將肌肉和骨骼相關聯,作為有機整體,探索共通靶因子。以上手段的探索將為進一步改善肌骨共減綜合癥提供新的著力點和應對策略。

