過氧化氫誘導小鼠骨髓間充質干細胞衰老細胞模型的建立
徐 飛,鄭澤航,徐漢青,楊 卿
(華中科技大學同濟醫學院附屬同濟醫院骨科,湖北省武漢市430030)
隨著中國老齡化社會的進展,衰老相關性研究逐漸成為熱點。人體骨骼也會隨著年齡的增長而發生衰老,其中骨髓間充質干細胞(bone marrow stem cell,BMSC)的衰老對骨骼系統的衰老起著至關重要的作用。研究衰老BMSC的特性及生物學功能需要大量的衰老細胞,而衰老細胞的增殖能力較差,無法通過傳統的傳代培養方法來快速獲取足量的細胞。現階段獲取衰老BMSC的方法主要有以下幾種:①直接從衰老個體的骨髓中分離提取衰老的間充質干細胞,但高齡小鼠比較難獲得,且分離提取的細胞量較少,難以進行細胞擴增;②分離培養正常的BMSC,經過體外培養與傳代處理獲得自然衰老的BMSC,但此過程時間較長,通常需要多次傳代培養[1];③通過化學與射線照射等方法造成細胞DNA損傷,獲得衰老的BMSC模型[2]。
為了建立一種快速、有效且穩定的獲得小鼠衰老BMSC的方法,本文根據相關文獻及前期預實驗[3-5],采用200 μmol/L過氧化氫(H2O2)處理正常的小鼠BMSC 2 h[5],處理完畢后,檢測相關衰老指標來確認所獲得的細胞為衰老的BMSC,以期建立一種快速有效且穩定的衰老BMSC模型。
1 材料和方法
1.1 小鼠骨髓間充質干細胞的分離、培養及鑒定
取3周齡C57BL/6小鼠(華中科技大學實驗動物中心提供),收集其雙側股骨與脛骨,取髓腔內細胞全骨髓培養法進行培養,獲得BMSC,具體分離培養及鑒定方法參考文獻[6]。
1.2 H2O2誘導衰老骨髓間充質干細胞模型
取所分離的第3代小鼠BMSC,以1×104個/cm2細胞接種于25 mL培養皿中,培養皿中含5 mL完全培養基[α-MEM(Hyclone公司,美國),10%胎牛血清(Gibico公司,美國),1%抗生素]。對照組加入1 μL PBS(Hyclone公司,美國);造模組加入1 μL H2O2(Sigma公司,美國),其終濃度為200 μmol/L,兩組細胞均處理2 h,處理結束后更換為完全培養基繼續培養72 h。
1.3 骨髓間充質干細胞生長曲線的繪制
將兩組細胞以1×104個/cm2接種于96孔板,每孔150 μL,每天同一時間點取出96孔板,每孔加入20 μL MTT(5 g/L)(Invitrogen公司,美國),培養4 h后,去上清加入DMSO測定各孔光密度(490 nm),共測定7天,以此繪制時間光密度BMSC生長曲線。
1.4 SA-β-gal染色
將兩組細胞以1×104個/cm2接種于48孔板,細胞完全貼壁后,進行衰老表型β-半乳糖苷酶(senescence associated β-galactosidase,SA-β-gal)染色(Solarbio公司,中國),衰老的BMSC于鏡下呈藍色。SA-β-gal陽性細胞的計算:每組鏡下隨機視野計數100個細胞,統計出SA-β-gal陽性細胞個數,并計算百分比。
1.5 端粒功能失調誘導病灶分析
將兩組細胞以1×104個/cm2接種于12孔板(Corning公司,美國),每孔里放置圓形載玻片,讓細胞貼于載玻片上生長,細胞貼壁后,進行端粒功能失調誘導病灶(telomere dysfunction-induced foci,TIF)分析。簡要操作如下:4%多聚甲醛(Sigma公司,美國)室溫固定后,加入1%Triton-X100(Sigma公司,美國)通透細胞;10% BSA(Abcam公司,美國)封閉后加一抗53BP1(Abcam公司,美國)和γH2AX(Abcam公司,美國)雙染;熒光二抗(Abcam公司,美國)染色后,DAPI(Invitrogen公司,美國)染核。封片,然后共聚焦顯微鏡(Cell insight CX5,Thermo Fisher,美國)下觀察并拍照。TIF陽性細胞的計算:以53BP1和γH2AX共定位的點代表TIF,每組計數50個細胞,每個細胞存在53BP1和γH2AX共定位的點(顯示為黃色點)即認為是TIF陽性細胞,統計兩組陽性細胞百分比。
1.6 RNA提取與基因表達分析
將兩組細胞分別取1×106個進行RNA提取操作,具體如下:每組細胞加入0.5 mL TRIZOL(Invitrogen公司,美國)進行充分裂解后,加入0.1 mL三氯甲烷,孵育完成后進行離心,細胞RNA位于上清中,吸取上清液,加入等量異丙醇,進行離心操作,RNA位于EP管的底部,吸去上清后以75%乙醇洗滌,并調整兩組總RNA至同一濃度。將所提取的RNA反轉錄為cDNA。Real-time PCR分析兩組細胞衰老相關基因p16、p21、p53的表達情況。所用引物序列見表1。
1.7 統計學方法

表1 Real-time PCR引物序列
2 結 果
2.1 兩組BMSC生長情況的比較
細胞生長曲線如圖1所示,造模組BMSC生長明顯較對照組緩慢(P<0.05)。
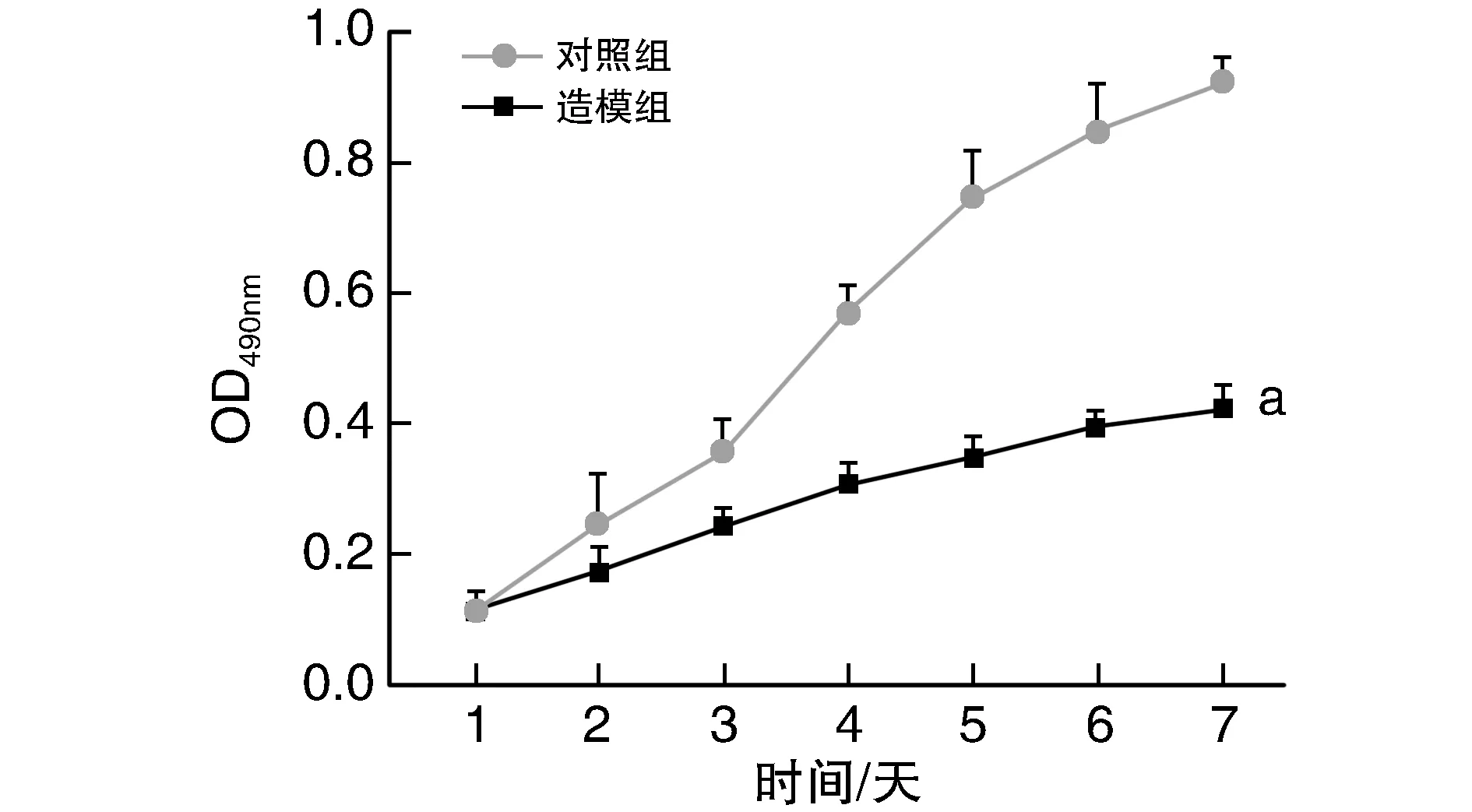
圖1 兩組BMSC生長情況的比較a為P<0.05,與對照組比較。
2.2 兩組BMSC SA-β-gal陽性細胞的比較
造模組BMSC的SA-β-gal酶活性增強,SA-β-gal陽性細胞(染色呈藍色)較對照組多(圖2A)。造模組SA-β-gal陽性細胞比例明顯高于對照組(P<0.05;圖2B)。

圖2 兩組BMSC SA-β-gal陽性細胞的比較A為SA-β-gal染色結果(200×),藍色為SA-β-gal陽性細胞;B為SA-β-gal陽性細胞直方圖。
2.3 兩組BMSC TIF陽性細胞的比較
造模組BMSC TIF陽性細胞較對照組多,差異具有統計學意義(P<0.05;圖3)。
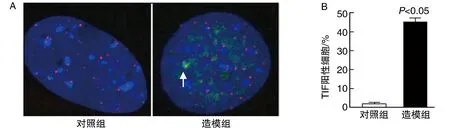
圖3 兩組BMSC TIF陽性細胞的比較A為TIF染色結果(200×),造模組BMSC存在53BP1/γH2AX共定位點的陽性細胞(白色箭頭所示);B為BMSC TIF陽性細胞直方圖。
2.4 兩組BMSC p16、p21和p53基因表達的比較
與對照組比較,造模組p16、p21和p53表達均明顯增加(P<0.01,P<0.05;圖4)。
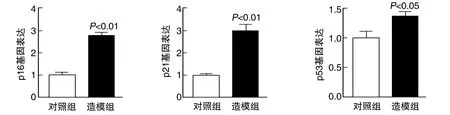
圖4 兩組BMSC p16、p21和p53基因表達的比較
3 討 論
細胞與機體的衰老是生命的基本現象。通過體內或體外的反復細胞分裂,獲得衰老細胞的方式耗時耗力且量少。本研究通過H2O2的誘導處理,正常的BMSC發生DNA損傷,導致細胞衰老[7]。衰老的細胞表現出細胞生長緩慢,SA-β-gal染色陽性,端粒功能障礙誘導的損傷灶(TIF)陽性及相關衰老基因p16、p21、p53表達增加。本研究以此得到的衰老細胞模型有效且快速。
H2O2誘導處理正常的BMSC后,細胞內活性氧(reactive oxygen species,ROS)大量聚集,ROS可引發DNA損傷,蛋白質氧化損傷,形成蛋白質交聯聚合物等,通過相關細胞通路阻滯細胞周期的進程,誘導細胞衰老,使細胞生長緩慢甚至停滯[8]。
SA-β-gal作為特異性衰老細胞的標志物最早在1995年被Dimir等[9]提出,他們觀察到在pH為6.0時,僅有衰老的細胞為β-gal染色陽性,其原因為衰老細胞的內源性溶酶體-半乳糖的過度表達和積累。
端粒的主要功能是保持染色體完整性,可保護DNA免受DNA雙鏈斷裂影響。ROS可引起端粒功能障礙,DNA損傷反應。持續的DNA損傷應答,可導致細胞生長停滯,發生細胞衰老。當DNA損傷時,H2AX發生磷酸化,募集DNA修復蛋白進行DNA修復。γH2AX與53BP1等復合體共定位于DNA損傷處進行應答反應,使細胞進入生長停滯,并可能啟動衰老程序[10-11]。因此,通過尋找細胞內53BP1和γH2AX共定位的點可以辨別衰老細胞。
氧化應激使得細胞p16、p21、p53基因表達增加。p16、p21、p53在細胞衰老和細胞周期中起關鍵調控作用[12-13]。p16表達增加可阻止細胞周期通過G1/S檢測點使得細胞生長停滯;與此同時,p53的上調可激活p21基因,抑制cyclinA/E-CDK2的活性,阻止細胞周期的進行[14-15]。
劉洋等[3]為建立人胎盤源間充質干細胞的衰老模型,采用H2O2來誘導處理,成功地得到了衰老模型,其H2O2處理濃度和時間與本研究相同。與之不同,郭柏銘等[4]也采用了H2O2誘導大鼠間充質干細胞的方法成功地獲得了衰老模型,但其處理方法為500 μmol/L H2O2處理24 h,其可能原因為所處理的細胞不同,郭柏銘等[4]所得到的是衰老的大鼠BMSC,而本研究為小鼠BMSC。
綜上所述,通過200 μmol/L H2O2處理小鼠BMSC 2 h,可獲得較好的細胞衰老模型,此模型細胞生長慢,SA-β-gal染色陽性率高,TIF陽性細胞多,且p16、p21和p53基因的表達明顯增高,可用于衰老BMSC相關實驗研究。

