過氧化氫對W1118品系果蠅壽命、生育能力、運動能力及抗氧化能力的影響
劉 波,漆輝洲,王五洲,馬 云,肖方竹,郭思思,何淑雅
(南華大學公共衛生學院,湖南省衡陽市421001)
過氧化氫(hydrogen peroxide),俗稱雙氧水,分子式為H2O2,溶于水、醇、醚等[1],廣泛應用于醫用、食品及工業消毒等領域,易分解為水和氧氣,無殘留毒性,不會造成環境的再次污染[2-3]。過氧化氫作為一種強氧化劑,可破壞線粒體功能和損傷脫氧核糖核酸(deoxyribonucleic acid,DNA)誘導氧化應激,增加活性氧(reactive oxygen species,ROS)含量,進而啟動由Caspase介導的細胞凋亡途徑[4],且ROS在各種信號通路介導的細胞增殖和炎癥反應中也起著重要作用[5-6];一旦過氧化氫作用于細胞濃度超過某個水平,細胞會發生氧化應激反應,可導致細胞內發生不可逆轉的損傷[7]。
果蠅具有飼養簡便、反應靈敏、75%的基因與人類疾病相關基因同源等優點[8],且其發育過程和代謝機制與哺乳動物類似,故較多地將其應用于衰老或壽命等方面的研究[9]。本研究以W1118品系果蠅為實驗對象,通過喂食含過氧化氫的培養基,觀察果蠅的生長情況,研究過氧化氫對果蠅的壽命、生育能力、運動能力及抗氧化能力的影響,以期為過氧化氫對果蠅生長發育影響的研究提供證據。
1 材料和方法
1.1 材料
W1118品系果蠅,由本實驗室傳代保存。過氧化氫(上海雙儉);丙酸(巴斯夫);瓊脂粉(康倍斯);酵母粉、蔗糖、黃豆粉及玉米粉(均購自沃爾瑪超市);PBS緩沖液(賽默飛);谷胱甘肽(glutathione,GSH)和過氧化氫酶(catalase,CAT)試劑盒(默沙克);恒溫箱(湖南中美)。
1.2 果蠅培養
玉米-酵母培養基,恒溫25 ℃,相對濕度65%。基礎培養基的配制:取130 g玉米粉、77 g蔗糖、30 g大豆粉、13 g瓊脂粉以及900 mL蒸餾水倒入鍋中,煮沸30 min,待溫度降至55~60 ℃,加入6 mL丙酸和20 g酵母粉攪拌均勻后立即倒入培養管中,冷藏后使用[10-11]。過氧化氫培養基:在基礎培養基中添加不同量的過氧化氫,攪拌均勻后倒入培養管中,配制成最終含400、800和1 200 mmol/L過氧化氫的培養基,0 mmol/L過氧化氫的基礎培養基為對照組。
1.3 果蠅壽命測定
收集未交配的處女蠅和雄果蠅,隨后隨機挑取雌雄果蠅各50只放入基礎培養基和含400、800、1 200 mmol/L過氧化氫的培養基中,每組設5個平行管。每日18:00對果蠅存活情況進行觀察和記錄,培養過程中每隔2天更換一次新鮮培養基,持續觀察直至果蠅全部死亡。記錄數據并計算最高壽命(最后10只死亡果蠅的平均壽命)、壽命和半數死亡時間。
1.4 果蠅生育能力測定
在準備好的基礎培養基中放入果蠅,產卵12 h后移除親本,然后根據實驗要求采集1日齡幼蟲,分別放入到基礎培養基和含400、800、1 200 mmol/L過氧化氫的培養基內進行充分培養。各組培養基中均放置50只幼蟲,每組設5個平行管,觀察蛹化和羽化情況。蛹化率(%)=蛹化總數/卵總數×100%;羽化率(%)=羽化總數/卵總數×100%[12]。
1.5 果蠅羽化后48 h死亡率測定
在各濃度培養基羽化的成蟲中,均隨機挑選20只成蟲,每組設5個平行管,每隔8 h觀察成蟲存活情況直至48 h,以確定幼蟲羽化為成蟲后48 h的死亡率。果蠅羽化后48 h死亡率(%)=羽化后48 h死亡果蠅總數/羽化果蠅總數×100%。
1.6 果蠅運動能力測定
收集3日齡果蠅,分別放入基礎培養基和含400、800、1 200 mmol/L過氧化氫的培養基中,培養7天后,每組隨機挑取50只果蠅且每組設5個平行管,輕晃果蠅至培養管底部并塞好瓶塞,記錄5 s內果蠅到達培養管頂部的數量。攀爬指數(%)=5 s內到達頂部的果蠅數/果蠅總數×100%[13]。攀爬指數越高說明運動能力越強,反之越小。
1.7 果蠅抗氧化活性測定
收集3日齡果蠅,從基礎培養基對照組和含400、800、1 200 mmol/L過氧化氫的培養基處理組中每組隨機各挑取雌、雄果蠅20只于離心管中,每組設5個平行管,加入適量的PBS緩沖液,在液氮中充分研磨成10%組織勻漿[14],4 ℃ 2 500 r/min離心15 min,取上清,嚴格按照默沙克公司的試劑盒操作說明測定GSH含量和CAT活力。
1.8 統計分析
2 結 果
2.1 過氧化氫對果蠅壽命的影響
400 mmol/L過氧化氫處理組雌雄果蠅半數死亡時間、最高壽命及雌果蠅壽命與對照組相比均明顯延長(P<0.05),1 200 mmol/L過氧化氫處理組雌雄果蠅半數死亡時間、壽命及最高壽命與對照組相比均明顯縮短(P<0.05;圖1);濃度為800 mmol/L條件下,雄果蠅平均壽命與對照組相比明顯縮短。
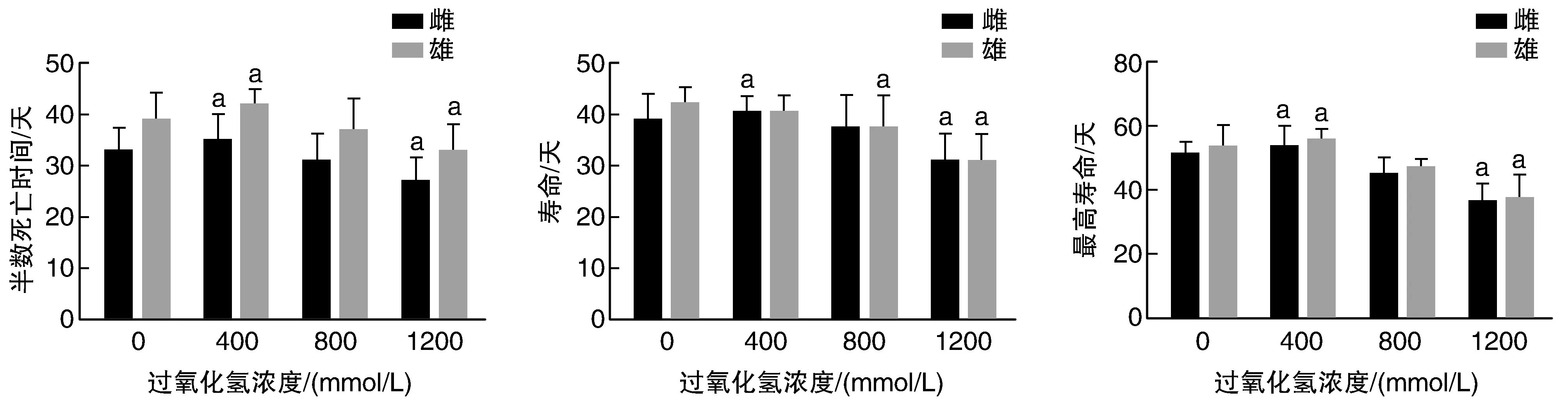
圖1 過氧化氫對果蠅壽命的影響a為P<0.05,與0 mmol/L對照組比較。
2.2 過氧化氫對果蠅生育能力的影響
在800 mmol/L和1 200 mmol/L條件下,果蠅的蛹化率明顯低于對照組(P<0.05;圖2);不同濃度過氧化氫處理組果蠅的羽化率均明顯低于對照組(P<0.05),且果蠅生育能力隨著過氧化氫濃度的提高而逐漸減弱,呈劑量依賴性關系。
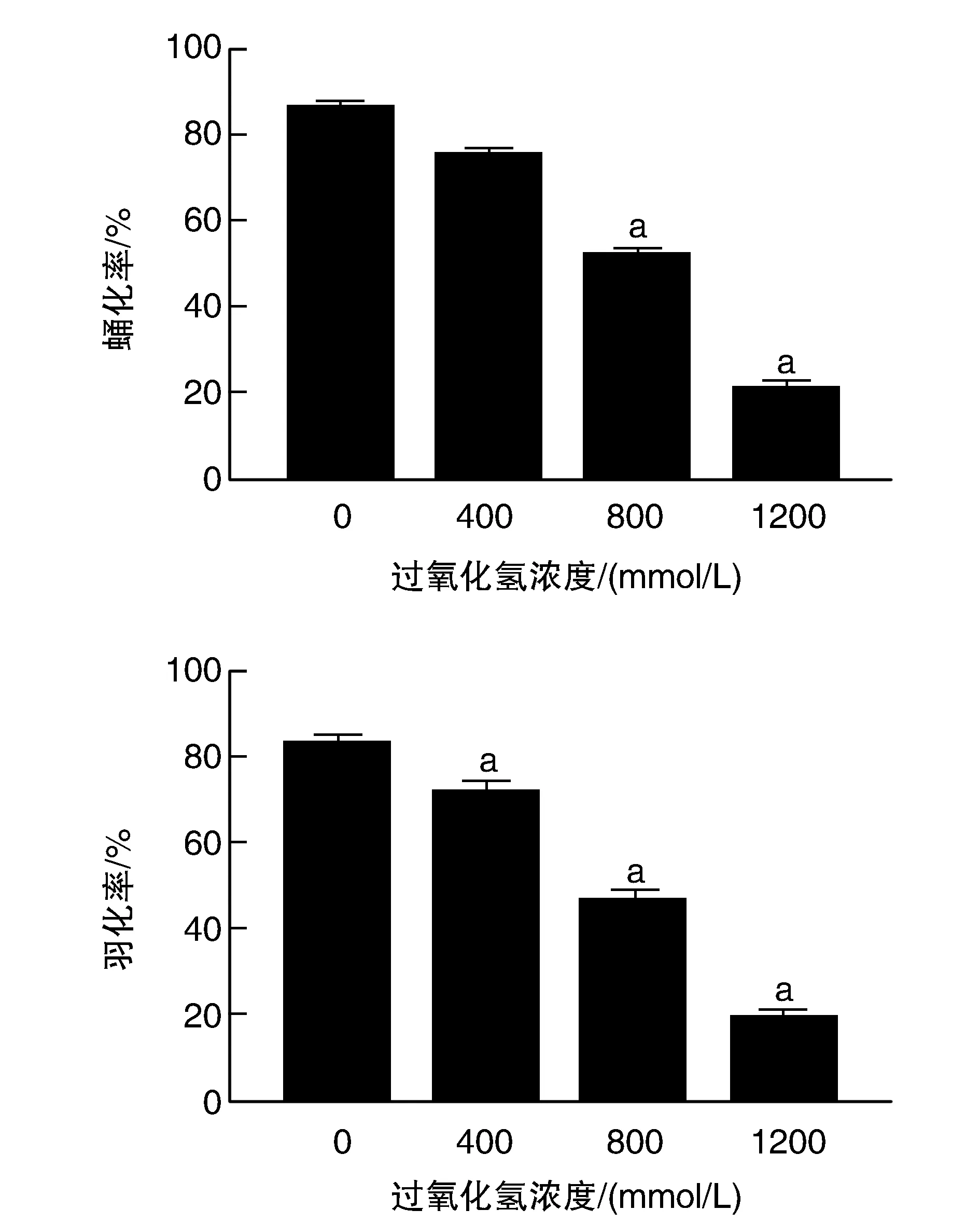
圖2 過氧化氫對果蠅生育能力的影響a為P<0.05,與0 mmol/L對照組比較。
2.3 過氧化氫對果蠅羽化后48 h死亡率的影響
400、800、1 200 mmol/L過氧化氫處理組果蠅羽化后48 h死亡率明顯高于對照組P<0.05;圖3),且果蠅羽化后48 h死亡率隨著過氧化氫濃度的提高而逐漸升高,呈劑量依賴性關系。
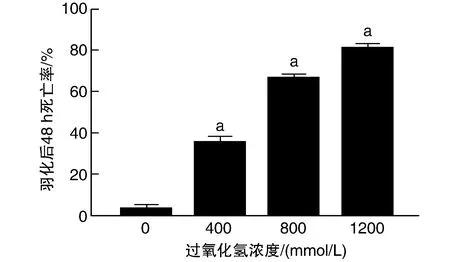
圖3 過氧化氫對果蠅羽化后48 h死亡率的影響a為P<0.05,與0 mmol/L對照組比較。
2.4 過氧化氫對果蠅運動能力的影響
400、800 mmol/L、1 200 mmol/L過氧化氫處理組果蠅的運動能力與對照組相比均明顯減弱(P<0.05;圖4),且隨著過氧化氫濃度的提高而逐漸減弱,呈劑量依賴性關系。
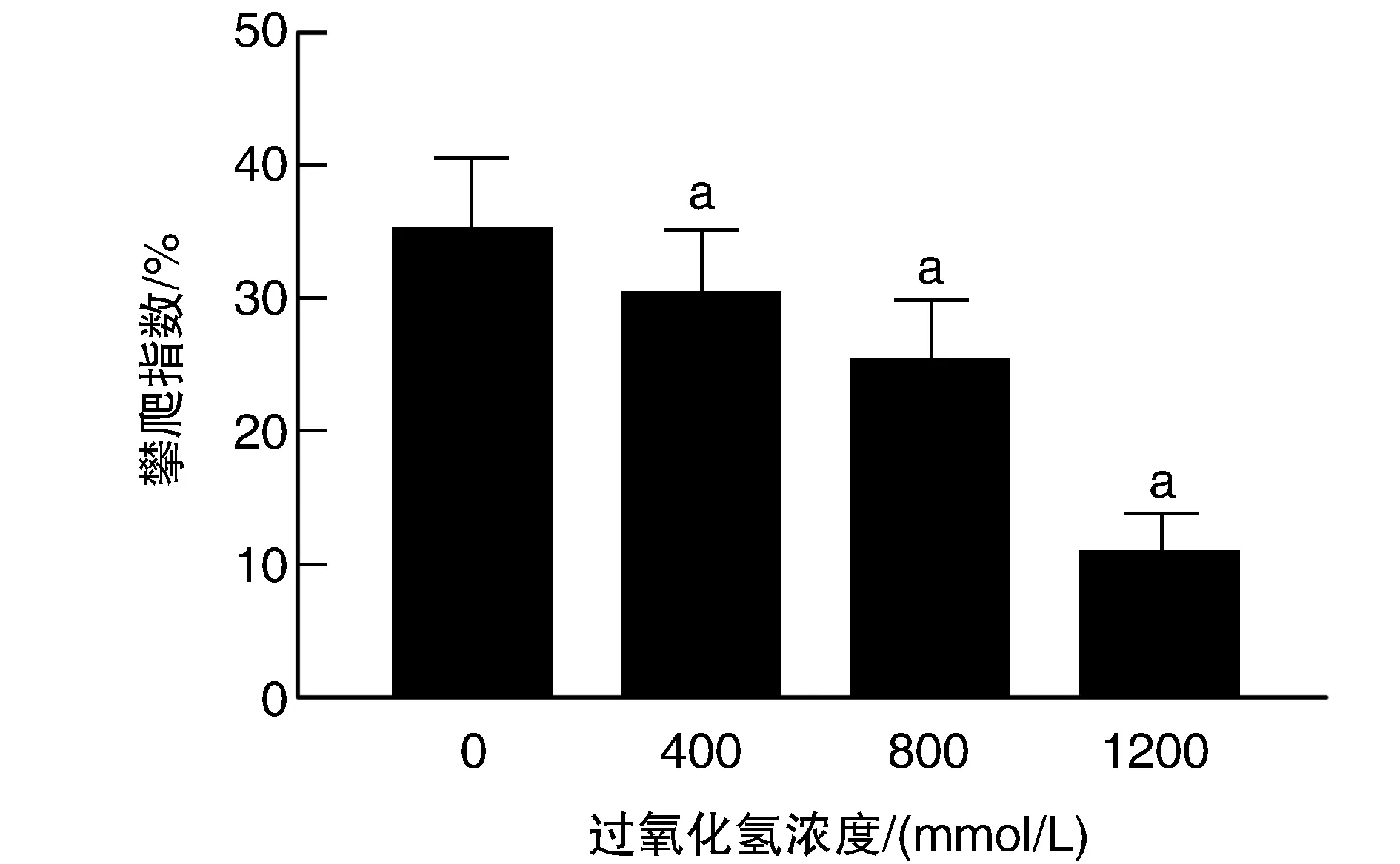
圖4 過氧化氫對果蠅運動能力的影響a為P<0.05,與0 mmol/L對照組比較。
2.5 過氧化氫對果蠅抗氧化活性的影響
800、1 200 mmol/L過氧化氫處理組果蠅GSH含量和CAT活力與對照組相比均明顯降低(P<0.05;圖5)。

圖5 過氧化氫對果蠅抗氧化活性的影響a為P<0.05,與0 mmol/L對照組比較。
3 討 論
過氧化氫常用于醫用、環境和食品等領域的消毒,其對革蘭氏陽性菌、革蘭氏陰性菌、細菌孢子和病毒等有抗菌效果,產生抗菌作用的機制可能是過氧化氫降解釋放的ROS導致DNA鏈斷裂[15];同時,過氧化氫可經皮膚、消化道及呼吸道等不同途徑進入人體產生一定的毒性[16-17],產生毒性的機制主要有三種:腐蝕損傷、氧氣生成和脂質過氧化[18]。果蠅易于操作,喂養簡單,繁殖力高、染色體數目少,且其代謝途徑、生理功能和發育階段與哺乳動物類似等特性,故常被用作生物模型來研究動物行為、發育和抗衰老和抗氧化等[19-20]。本研究以W1118品系果蠅為研究對象,研究過氧化氫對果蠅壽命、生育能力以及運動能力的影響,并以GSH含量和CAT活力為指標評價了果蠅的抗氧化能力。結果表明:隨著過氧化氫濃度的增加,果蠅蛹化率和羽化率降低、運動能力減弱、羽化后48 h死亡率升高;當過氧化氫為400 mmol/L時,果蠅體內GSH含量和CAT活力較對照組升高,可能是由于果蠅在低濃度過氧化氫刺激時,激活了果蠅體內的保護機制,誘導產生了GSH和CAT,進而及時清除自由基,避免自由基對果蠅的進一步損傷,而當過氧化氫濃度較高時,果蠅機體產生的自由基超過了機體的清除能力,即GSH和CAT產生的速度跟不上機體內自由基增加的速度,從而造成果蠅組織細胞的損傷,使GSH含量和CAT活力降低;當過氧化氫濃度為1 200 mmol/L時效果最為明顯(P<0.05),這時果蠅體內GSH含量和CAT活性與對照組相比明顯減少(P<0.05);當過氧化氫濃度較高時,果蠅可能因此提前衰老、死亡、運動能力減弱甚至喪失生育能力。
昆蟲受到脅迫后會產生較多的ROS[21]。低水平的ROS對機體無害且在信號傳輸中起著很重要的作用[22]。當體內ROS水平超過一定濃度時可導致昆蟲機體氧化損傷[7],為了有效防止ROS對機體的破壞,昆蟲體內可形成一個包括酶和非酶組分的抗氧化系統網絡[23]。過多的自由基細胞膜中的不飽和脂肪酸發生反應,可破壞生物大分子如DNA、蛋白質等的結構,進而導致機體疾病甚至死亡[24-25]。過氧化氫可通過破壞正常線粒體功能和損傷DNA誘導氧化應激,本研究果蠅GSH含量和CAT活性減少,說明過氧化氫降低了果蠅對自由基及其產物的清除能力,從而造成果蠅功能障礙。
本研究結果表明,果蠅壽命縮短、生育能力和運動能力下降的同時,其體內GSH含量和CAT活性也相應減少,說明過氧化氫對果蠅壽命、生育能力和運動能力的不利影響可能與其誘發的氧化損傷有關,機制可能是通過降低體內抗氧化組分含量從而減弱抗氧化損傷的能力,使得體內自由基積累導致損傷加劇,從而減弱了果蠅的生育能力和運動能力、加速了果蠅的死亡進程等。影響果蠅的生理生化功能的因素是多方面的,也是一個復雜且值得探討的課題。本研究為過氧化氫對果蠅生長發育的危害提供了理論依據,可為農業園林害蟲防治工作提供參考意見,一定程度上可促進農業園林業的發展,同時也可規范當下新冠肺炎疫情防控消殺用品等的正確使用。

