CD14+CD16-HLA-DR+與PD-1單抗治療非小細胞肺癌的療效及預后的關系研究*
孫 璐,王 巍,李 嬋,姚學敏,么偉楠,陳明達,宋君利,賈敬好
河北省唐山市人民醫院腫瘤內科,河北唐山 063000
肺癌是目前全球范圍內病死率及發病率均處于第一位的嚴重惡性腫瘤,有研究指出,80%以上的肺癌患者屬于非小細胞肺癌[1]。近年來我國臨床中綜合運用化療、手術、放療、靶向治療等方案進行綜合干預,但非小細胞肺癌患者的臨床預后仍難以令人滿意,患者的5年生存率仍不足兩成[2]。非小細胞肺癌腫瘤細胞中常異常高表達程序性死亡配體-1(PD-L1),其可與活化后的T細胞表面表達的程序性死亡受體-1(PD-1)結合并起到抑制免疫應答的作用,加速促進腫瘤細胞免疫逃逸,并可有效提高腫瘤微環境抵抗免疫的效果。患者體內的免疫抑制狀態在非小細胞肺癌的發生和發展過程中具有十分重要的作用,免疫細胞亞群及細胞因子還可能進一步調控遠處轉移、腫瘤血管生成,免疫抑制微環境也可能進一步調控腫瘤的進展[3]。免疫治療的臨床療效與腫瘤微環境中免疫抑制細胞群有關,主要的抑制細胞群有髓系抑制性細胞和調節性T細胞[4]。人體內髓系抑制性細胞常被標記為CD14+CD16-HLA-DR+和CD14+CD16-HLA-DR-/low兩種亞群。雖然PD-1單抗對患者進行治療具有一定的臨床療效,但PD-1單抗的臨床療效與患者髓系抑制性細胞種類的關系及其是否可作為影響患者臨床療效和預后的影響因素,相關報道較為罕見。本研究選擇本院收治的非小細胞肺癌患者作為研究對象,分析CD14+CD16-HLA-DR+與PD-1單抗的臨床療效和患者預后的相關性,為臨床應用提供依據。
1 資料與方法
1.1一般資料 選擇本院2018年6月至2019年4月收治的60例非小細胞肺癌患者作為研究對象。年齡>50歲者37例,≤50歲者23例;男46例,女14例;有吸煙史者40例,無吸煙史者20例;依照患者組織病理學檢查結果,鱗癌28例,腺癌27例,其他5例;依照患者腫瘤分化程度結果,高分化5例,中分化32例,低分化23例;依照患者TNM分期結果,Ⅰ期13例,Ⅱ期14例,Ⅲ期13例,Ⅳ期20例;CD14+CD16-HLA-DR+患者37例(CD14+CD16-HLA-DR+組),CD14+CD16-HLA-DR-/low患者23例(CD14+CD16-HLA-DR-/low組),兩組年齡、性別、吸煙史、病理組織學檢查結果、腫瘤分化程度、TNM分期一般資料比較,差異無統計學意義(P>0.05),見表1。納入標準:(1)患者年齡不小于18歲;(2)經細胞學和組織病理學檢查,所有患者均確診為非小細胞肺癌;(3)入組前未接受其他抗腫瘤方案進行治療;(4)美國東部腫瘤協作組(ECOG)評分不高于2分;(5)患者器官臟器功能嚴重受損(血清肌酐≤1.5倍正常上限值、肌酐清除率≥50 mL/min、血小板計數≥100×109/L、中性粒細胞絕對值≥1.5×109/L、血清膽紅素≤1.5倍正常上限值、丙氨酸氨基轉移酶和天門冬氨酸氨基轉移酶均≤2.5倍正常上限值);(6)患者本人及其法定監護人均對本研究知情并簽署知情同意書。排除標準:(1)腫瘤病灶為復發性腫瘤;(2)原發于其他臟器或部位腫瘤的肺部轉移病灶;(3)入組前兩周存在急性炎癥或長期存在慢性炎癥;(4)妊娠或哺乳期女性;(5)存在其他腫瘤;(6)存在自身免疫性疾病;(7)伴隨出現腫瘤相關出血;(8)不遵醫囑用藥和治療;(9)患者本人或其法定監護人申請主動退出本研究。本研究經本院倫理委員會批準實施。

表1 CD14+CD16-HLA-DR+組患者及CD14+CD16-HLA-DR-/low組患者臨床資料的比較[n(%)]

組別n腫瘤分化程度高分化中分化低分化TNM分期Ⅰ期Ⅱ期Ⅲ期Ⅳ期CD14+CD16-HLA-DR+組373(8.11)21(56.76)13(45.95)8(21.62)8(21.62)9(24.32)12(32.43)CD14+CD16-HLA-DR-/low組232(8.7)11(47.38)10(43.48)5(21.74)6(26.09)4(17.39)8(34.78)χ20.2981.653P 0.8620.648
1.2方法
1.2.1治療方法 本研究中所有患者均在入組后及時依照美國國立綜合癌癥網絡指南中推薦的給藥方案給予鉑類化療方案進行干預治療,包括培美曲塞二鈉聯合卡鉑/順鉑方案、多西他賽/紫杉醇聯合卡鉑/順鉑方案、長春瑞濱聯合卡鉑/順鉑方案、吉西他濱聯合卡鉑/順鉑方案等,后患者經影像學檢查仍為進展,此時采用PD-1單抗(派姆單抗,美國,默沙東)進行治療,以21 d為1個周期,持續治療6個周期,每個周期開始第1天給予2 mg/kg的PD-1單抗進行靜脈滴注。
1.2.2檢查方法 在患者入組后接受治療前采集空腹靜脈血5 mL,使用密度梯度離心法分離并提取患者外周血中淋巴細胞,所用的人外周血淋巴細胞分離液購自南京福麥斯生物科技有限公司,并嚴格遵照試劑盒說明書進行操作提取。共提取5份,每份100 μL,分別加入:(1)PE/Cy7-IgG1k熒光抗體和FITC-CD4熒光抗體;(2)PE Armenian Hamster IgG熒光抗體、PE/Cy7-CD16熒光抗體和FITC-CD4熒光抗體;(3)PE-HLA熒光抗體、PE/Cy7-CD16熒光抗體和FITC-CD4熒光抗體;(4)PE-IgG1k熒光抗體、PE/Cy7-CD16熒光抗體和FITC-CD4熒光抗體;(5)PE-DR熒光抗體、PE/Cy7-CD16熒光抗體和FITC-CD4熒光抗體。將5組細胞懸液避光震蕩后孵育20 min,依照試劑盒說明書進行操作,后使用流式細胞儀(德國,美天旎)檢測淋巴細胞中各因子的表達情況。
1.3觀察指標 本研究中參照患者影像學檢查結果并根據RECIST Version1.1對患者的臨床療效進行評估,其中患者腫瘤消失且持續時間不低于4周則判定為完全緩解,患者腫瘤最大徑之和減少30%以上且持續時間不低于4周則判定為部分緩解,患者出現其他新發腫瘤或可觀測腫瘤最大徑之和增加20%以上則判定為進展,患者病情介于疾病進展和部分緩解之間則判定為穩定。此外,本研究對患者進行長期隨訪追蹤,記錄患者生存率,總生存時間(OS)為患者確診至死亡或失訪時間。
2 結 果
2.1患者治療后的臨床療效 結果顯示,所有患者經治療后完全緩解1例,部分緩解19例,穩定29例,進展11例。
2.2CD14+CD16-HLA-DR+組患者及CD14+CD16-HLA-DR-/low組患者治療臨床療效的比較 結果顯示,CD14+CD16-HLA-DR+組患者完全緩解和部分緩解共16例,穩定19例,進展2例;CD14+CD16-HLA-DR-/low組患者完全緩解和部分緩解共4例,穩定10例,進展9例,兩組患者治療臨床療效比較,差異有統計學意義(χ2=12.003,P=0.007)。
2.3患者生存情況分析 結果顯示,所有患者治療結束后1年內共死亡7例。CD14+CD16-HLA-DR+組患者治療后1年內共死亡1例,CD14+CD16-HLA-DR-/low組患者治療后1年內死亡6例,CD14+CD16-HLA-DR+組患者生存率明顯優于CD14+CD16-HLA-DR-/low組患者,差異有統計學意義(P<0.05)。
2.4CD14+CD16-HLA-DR+表達情況與患者治療臨床療效及預后的關系分析 Logistic回歸模型分析結果顯示,CD14+CD16-HLA-DR+是非小細胞肺癌采用PD-1單抗治療后臨床療效及預后的獨立影響因素(P<0.05),見表2。
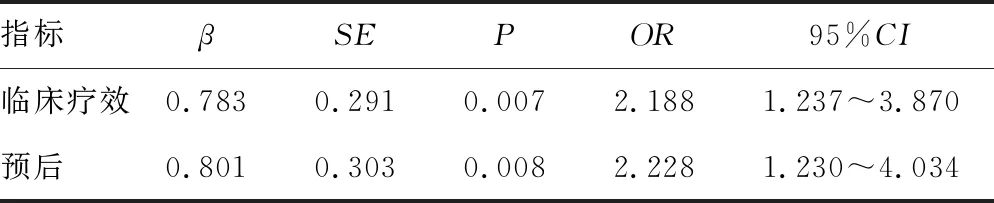
表2 CD14+CD16-HLA-DR+表達情況與患者治療臨床療效及預后質量關系分析
3 討 論
有研究指出,臨床中常依照生物學行為不同將肺癌分為小細胞肺癌和非小細胞肺癌,其中非小細胞肺癌占全部肺癌的80%以上[5]。國內研究指出,我國近年來65%以上的肺癌患者在確診時其病情已發展至晚期,且大部分早期患者在診斷后最終將進一步轉移和復發,目前我國肺癌臨床5年生存率仍不足10%[6]。有研究指出,在全部腫瘤譜系中僅有一小部分腫瘤發生于胚系突變,絕大多數腫瘤的發生與環境因素和體細胞突變密切相關,其中不同形式的慢性炎癥和環境因素改變可能促進腫瘤的發生、發展[7]。近年來隨著相關研究的不斷深入,免疫系統的異常改變在腫瘤發生發展過程中所起到的重要作用也逐漸被揭示,且兩者間的關系也隨著越來越深入的研究而被全球范圍內的學者所認同,因此也有大量的免疫治療方案在臨床中得以廣泛應用并取得了較理想的臨床療效[8]。
正常的生理狀態下人體內的免疫系統可及時有效地識別并清除微環境中異常突變的腫瘤細胞,但腫瘤細胞也會為了進一步生長和生存采取不同策略對抗免疫系統,有效實現抑制機體內正常的免疫系統,并在體內的多重抗腫瘤免疫應答系統中得以幸存[9]。有學者將腫瘤細胞逃避免疫應答系統稱為免疫逃逸,并提出抗腫瘤-免疫循環概念以進一步系統地理解腫瘤免疫的多步驟、多環節及其復雜性[10]。不同腫瘤可通過多途徑和多環節影響抗腫瘤免疫系統,異常抑制免疫系統的有效識別和殺傷作用,協助腫瘤細胞逃避免疫系統,產生免疫耐受并可能進一步促進腫瘤的發生、浸潤、轉移和發展[11]。抗腫瘤免疫系統的效應機制主要包括體液免疫和細胞免疫兩大體系,其中在抗腫瘤免疫系統中細胞免疫是主要的實現形式,而體液免疫在其中主要起輔助作用,和細胞免疫相互協同共同殺傷腫瘤細胞[12]。相較于健康者,肺癌患者外周血中NK細胞、CD4+T細胞、CD8+T細胞、CD4+T細胞/CD8+T細胞等淋巴細胞亞群比例多出現明顯異常,結果表明肺癌患者體內免疫系統功能處于失衡狀態,因此可采用免疫治療方案對其進行干預治療[13]。
有研究指出,PD-1可通過PD-1非依賴性和PD-1依賴性機制加速體內腫瘤特異性T細胞凋亡,并可通過PD-1依賴性信號通路有效抑制免疫細胞增殖,導致腫瘤細胞出現免疫逃逸反應[14]。在T細胞的活化過程中當PD-1與PD-L1特異性結合后可抑制T細胞活化,進而有效降低,甚至消除T細胞的殺傷作用,負向調節人體內的免疫應答反應[15]。PD-1單抗是目前全球范圍內研究最多、最廣也最深入的一類抗體,也是目前臨床中應用較多的抗腫瘤免疫治療藥物。
本研究結果顯示,采用PD-1單抗治療后非小細胞肺癌患者均具有較好的臨床療效。相較于CD14+CD16-HLA-DR-/low患者,CD14+CD16-HLA-DR+患者采用PD-1單抗治療的臨床療效更佳,且患者的生存期更長,PD-1單抗可有效競爭性結合免疫細胞中PD-1而阻斷腫瘤細胞中PD-L1與其結合,有效避免免疫細胞被腫瘤細胞識別和抑制,采用PD-1單抗治療后可有效恢復受抑制的T細胞恢,復腫瘤識別功能,并實現重新激活和重塑受抑制的免疫系統而達到抗腫瘤的作用。但CD14+CD16-HLA-DR+及CD14+CD16-HLA-DR-/low患者治療臨床療效存在明顯差異,其可能與CD14+CD16-HLA-DR+患者治療后腫瘤組織中浸潤的T細胞增殖水平較高有關,同時,可進一步增加病灶區周圍T細胞的數量,此外,CD14+CD16-HLA-DR+還可有效對抗腫瘤對T細胞的抑制作用,分泌大量干擾素提高免疫殺傷能力。在腫瘤組織內PD-L1多處于異常高表達狀態,當其與免疫細胞中PD-1結合后可有效調控腫瘤浸潤CD8+T細胞功能,因此臨床中可以采用靶向調節PD-1和PD-L1類化合物進行治療而起到抗腫瘤的作用。在腫瘤患者體內還存在多種免疫抑制性細胞,如髓系抑制性細胞、調節性T細胞等,其中髓系抑制性細胞促進腫瘤生長和轉移能力可進一步細分為重塑腫瘤病灶區微環境、負向調控免疫系統保護腫瘤細胞被免疫細胞殺傷,為腫瘤病灶的遠處和淋巴轉移提供合適的微環境,促進腫瘤細胞產生腫瘤干細胞、加速腫瘤的上皮間充質轉化,而CD14+CD16-HLA-DR+及CD14+CD16-HLA-DR-/low屬于重要的髓系抑制性細胞。在采用PD-1單抗治療后,相較于CD14+CD16-HLA-DR-/low,CD14+CD16-HLA-DR+患者體內的免疫抑制因子、轉化生長因子、一氧化氮合酶、白細胞介素等水平處于低表達狀態,因此其誘導Treg細胞表達和抑制T細胞功能均減弱,進而可能增強PD-1單抗治療的臨床療效[16]。但受限于臨床樣本數較少,研究時間較短并未開展大范圍長時間的臨床追蹤,本研究并未平行對比多種PD-1單抗治療的臨床療效,還有待于后續進一步深入分析探討。
綜上所述,采用PD-1單抗對非小細胞肺癌患者治療后,可顯著提高患者臨床療效,且CD14+CD16-HLA-DR+患者治療的臨床療效以及患者的預后生存期明顯提高。

