復(fù)方柴金解郁片對抑郁癥失眠大鼠腦內(nèi)GABA受體表達(dá)的影響
劉 燦,黃會珍,趙洪慶,鄒蔓姝,王葉情,李春艷,王宇紅,李強(qiáng)翔
(1.湖南中醫(yī)藥大學(xué),中藥粉體與創(chuàng)新藥物國家重點(diǎn)實(shí)驗(yàn)室培育基地/科技創(chuàng)新中心,湖南 長沙 410208;2.寧夏醫(yī)科大學(xué)附屬人民醫(yī)院,寧夏 銀川 750001)
抑郁癥是一種常見的精神障礙疾病。這種疾病已經(jīng)影響了全球3億多人,我國抑郁癥發(fā)病率約為5.23%[1]。據(jù)統(tǒng)計(jì)近90 %的抑郁癥患者有睡眠障礙[2],失眠是最常見的睡眠障礙之一,根據(jù)“精神疾病診斷和統(tǒng)計(jì)手冊”第四版的標(biāo)準(zhǔn),全球失眠率約為6%-10%[3],已成為重大的公共衛(wèi)生問題。因此,有效的防治抑郁癥失眠對于抑郁癥的病程和結(jié)局有重要意義。
目前,抑郁癥失眠的發(fā)病機(jī)制尚未完全闡明,其發(fā)生可能與腦內(nèi)谷氨酸(glutamate,Glu)和γ-氨基丁酸(gamma-amino butyric acid,GABA)含量異常導(dǎo)致氨基酸的比值失衡有關(guān)[4-5]。本實(shí)驗(yàn)陽性藥選擇文拉法辛和地西泮兩種西藥合用治療,使患者產(chǎn)生心理抵抗,且相較于西藥治療抑郁癥,中藥治療抑郁癥立足于整體調(diào)節(jié)、辨證論治,可實(shí)現(xiàn)多環(huán)節(jié)、多靶點(diǎn)、多途徑調(diào)控,具有標(biāo)本兼治、療效明顯、安全有效等優(yōu)勢。復(fù)方柴金解郁片由柴胡、貫葉金絲桃和姜黃等中藥組成,具有“疏肝理氣、健脾養(yǎng)心、安神解郁”的功效,主要治療及預(yù)防肝郁脾虛、心神失養(yǎng)所致的輕中度抑郁癥伴有失眠。故本文通過慢性不可預(yù)見性輕度應(yīng)激(chronic unpredictable mild stress,CUMS)聯(lián)合睡眠剝奪制作抑郁癥失眠大鼠模型,復(fù)方柴金解郁片進(jìn)行干預(yù),利用曠場、糖水偏好和戊巴比妥鈉閾上和閾下劑量實(shí)驗(yàn)評價復(fù)方柴金解郁片對抑郁癥失眠模型大鼠行為學(xué)的影響,并從Glu/GABA比例失調(diào)方面評價其保護(hù)海馬和下丘腦的機(jī)制。
1 材料與方法
1.1 實(shí)驗(yàn)動物SPF級♂ SD大鼠72只,體質(zhì)量(180-220) g,購自湖南斯萊克景達(dá)實(shí)驗(yàn)動物有限公司,生產(chǎn)許可證號SCXK(湘)2016-0002,飼養(yǎng)于湖南中醫(yī)藥大學(xué)SPF級動物房中,使用許可證號為SCXK(湘)2019-0009。實(shí)驗(yàn)條件為:室溫(25±2)℃、房間相對濕度(50±5)%、保持12 h/12 h光暗周期,動物自由攝取食物與水。
1.2 試劑與儀器鹽酸文拉法辛緩釋膠囊(批號:AG6898A,規(guī)格:75 mg/粒),購自湖南中醫(yī)藥大學(xué)第一附屬醫(yī)院,生產(chǎn)廠家:Pflzer Ireland Pharmaceuticals,分包裝廠家:惠氏制藥有限公司;地西泮片(批號:181006,規(guī)格:2.5 mg/片),購自湖南中醫(yī)藥大學(xué)第一附屬醫(yī)院,生產(chǎn)廠家:山東信誼制藥有限公司;復(fù)方柴金解郁片浸膏(臨床成人生藥量為90 g·d-1,每克浸膏相當(dāng)于3.92 g生藥),由湖南中醫(yī)藥研究院提供;兔抗GABAAR多克隆抗體(批號:bs-4112R)、兔抗GAD67多克隆抗體(批號:bs-1302R),購自北京博奧森生物技術(shù)有限公司;Glu酶聯(lián)免疫試劑盒(批號:20200505);GABA酶聯(lián)免疫試劑盒(批號:20200505),購自上海晶天生物科技有限公司。梯度PCR儀購自杭州晶格科學(xué)儀器有限公司;超微量核酸蛋白濃度測定儀購自英國Bio Drop公司;T10BS25型全自動勻漿儀購自德國IKA公司;ECO型PCR擴(kuò)增儀購自美國illumina公司;Chemi Doc XRS+Imager型化學(xué)發(fā)光系統(tǒng)購自美國BIO-RAD公司。
1.3 抑郁癥失眠模型的建立[6-7]d 1-14除空白組外均進(jìn)行CUMS,包括:① 禁食24 h;② 禁水24 h;③ 4 ℃冰水浴4 min;④ 傾籠45 ℃;⑤ 噪音4 h;⑥ 潮濕墊料24 h(200 mL/籠);⑦ 晝夜顛倒24 h;⑧ 電壓70 V,電流2 mA,足底電擊1 min;⑨ 夾尾1 min。每天1-2種刺激,同種刺激不能連續(xù)出現(xiàn)。從d 15開始,進(jìn)行多平臺水環(huán)境睡眠剝奪,根據(jù)前期對比觀察72 h快速睡眠剝奪和慢性睡眠剝奪這兩種方式,本實(shí)驗(yàn)采用慢性睡眠剝奪,每天15 ∶00-9 ∶00(+1)進(jìn)行18 h睡眠剝奪,連續(xù)21 d,剝奪箱為103 cm×56 cm×30 cm的玻璃水箱,箱內(nèi)置11個直徑為6.5 cm圓形平臺,大鼠在平臺上進(jìn)入快動眼睡眠(rapid eye movement sleep,REMS)時全身的肌張力下降,頭部及毛發(fā)接觸到水面而不能完全入睡,達(dá)到睡眠剝奪的目的。正式造模前5 d對大鼠進(jìn)行每天30 min適應(yīng)性平臺站立訓(xùn)練。睡眠剝奪箱上放有帶凹槽的不銹鋼絲制成的籠蓋,籠蓋上面可以放置飲用水和飼料,大鼠可自行飲水和攝食。失眠造模期間均不間斷抑郁造模。
1.4 分組與給藥采用CUMS聯(lián)合慢性睡眠剝奪的方法制備抑郁癥失眠大鼠模型,按體質(zhì)量采用隨機(jī)數(shù)字分組法分為6組,每組12只,分別為空白組,模型組,陽性藥組(鹽酸文拉法辛13.5 mg·kg-1+地西泮0.9 mg·kg-1),復(fù)方柴金解郁片高(10.8 g·kg-1)、中(5.4 g·kg-1)、低(2.7 g·kg-1)劑量組,均為灌胃給藥。空白組和模型組給予等體積蒸餾水,其他組給予相應(yīng)供試品,1次/d,連續(xù)35 d,給藥體積10 mL·kg-1體質(zhì)量。
1.5 行為學(xué)實(shí)驗(yàn)
1.5.1曠場實(shí)驗(yàn) 采用80 cm×80 cm×40 cm的黑色敞箱,箱底用白線等分為25個正方形格子。將大鼠從中央一格放入,待適應(yīng)30 s后觀察記錄4 min內(nèi)大鼠水平活動次數(shù)、垂直站立次數(shù)和糞便粒數(shù)。每只鼠實(shí)驗(yàn)結(jié)束后,用紙擦拭干凈并噴灑75%酒精,以免影響下一只鼠行為。
1.5.2糖水偏好實(shí)驗(yàn) 在正式實(shí)驗(yàn)前進(jìn)行糖水嗜好訓(xùn)練,每只鼠籠放置2個相同規(guī)格飲水瓶。D 1兩瓶均為1%糖水,d 2換成1%糖水和雙蒸水各1瓶,隔1 h交換二者位置。D 3禁食禁水,24 h后進(jìn)行糖水偏好測試。測試總時間為2 h,前1 h為左邊蔗糖水右邊蒸餾水,后1 h為左邊蒸餾水右邊蔗糖水。統(tǒng)計(jì)2 h內(nèi)大鼠蔗糖水消耗量,糖水偏嗜度/%=2 h內(nèi)蔗糖水總消耗量/(2 h內(nèi)蔗糖水總消耗量+2 h內(nèi)蒸餾水總消耗量)×100%。
1.5.3戊巴比妥鈉誘導(dǎo)大鼠睡眠實(shí)驗(yàn)(1)戊巴比妥鈉閾上劑量觀察:每組取6只大鼠用于此實(shí)驗(yàn),閾上劑量為35 mg·kg-1。觀察各組大鼠翻正反射消失和恢復(fù)情況,記錄以下數(shù)據(jù):① 注射戊巴比妥鈉時間;② 入睡時間:以1 min內(nèi)翻正反射消失為標(biāo)準(zhǔn);③ 覺醒時間:以30 s內(nèi)翻正反射恢復(fù)為標(biāo)準(zhǔn)。計(jì)算入睡潛伏期和睡眠時長,入睡潛伏期=入睡時間-注射戊巴比妥鈉時間;睡眠時長=覺醒時間-入睡時間。(2)戊巴比妥鈉閾下劑量觀察:每組取6只大鼠用于此實(shí)驗(yàn),閾下劑量為18 mg·kg-1。記錄每組大鼠入睡只數(shù)。
1.6 氨基酸類神經(jīng)遞質(zhì)含量的測定行為學(xué)實(shí)驗(yàn)后將各組大鼠迅速斷頭并于冰上取腦,分離海馬和下丘腦組織,液氮速凍,勻漿,離心后取上清液檢測Glu和GABA含量,采用酶聯(lián)免疫吸附法(ELISA),本實(shí)驗(yàn)使用的是雙抗體夾心法測定抗原。實(shí)驗(yàn)過程按照ELISA試劑盒說明書進(jìn)行。
1.7 Western blot檢測取各樣本海馬和下丘腦,稱重,按RIPA裂解液+PMSF(蛋白酶抑制劑) ∶組織=5 ∶1勻漿,離心測定儀測定上清中蛋白濃度。取上清液,將上清液用PBS稀釋10倍后再進(jìn)行測定。隨后,于SDS-PAGE凝膠加樣孔內(nèi)加入等量變性蛋白樣本,進(jìn)行蛋白電泳。轉(zhuǎn)膜,封閉1 h。并加入GABAAR、GABABR和GAD67,4 ℃過夜孵育一抗。稀釋比例為1 ∶800。次日,回收一抗,洗膜結(jié)束,加入二抗稀釋液(1 ∶2 000),水平搖床室溫孵育1 h。最后,使用TBST溶液中,洗膜10 min×3次。并用ECL進(jìn)行顯色。所得蛋白條帶的圖像分析采用ImageJ軟件。
1.8 qRT-PCR檢測取下丘腦、海馬樣本按50 mg加入1 mL TRIzol的比例進(jìn)行冰上勻漿。按氯仿 ∶TRIzol=1 ∶5加入200 μL氯仿,離心15 min,勻漿液分為3層,上層水樣為RNA溶液,中間白色固體狀為DNA、蛋白質(zhì),下層是有機(jī)層。吸取上層液體,加入同等體積異丙醇,離心15 min,EP管底部的片狀白色物質(zhì)即為RNA。加入50 μL 75 %乙醇吹打3次,加10 μL無酶水溶解,使用核酸蛋白濃度測定儀測定RNA濃度和純度。按Thermo試劑盒說明將將RNA逆轉(zhuǎn)錄成cDNA。按擴(kuò)增試劑盒的說明對目的基因進(jìn)行擴(kuò)增。測定目的基因和內(nèi)參β-actin的PCR產(chǎn)物Cq值,待測基因的mRNA相對表達(dá)量采用2-△△Cq法計(jì)算。引物具體信息見Tab 1。

Tab 1 Primer sequence of target genes
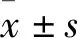
2 結(jié)果
2.1 行為學(xué)檢測
2.1.1曠場實(shí)驗(yàn) Tab 2結(jié)果顯示,d 14,與空白組相對比,模型組大鼠即表現(xiàn)出水平活動次數(shù)和站立次數(shù)減少,糞便粒數(shù)增加,有抑郁趨勢;d 35,與空白組相對比,模型組大鼠即表現(xiàn)出水平活動次數(shù)和站立次數(shù)減少(P<0.05或P<0.01),糞便粒數(shù)明顯增加(P<0.05);與模型組比較,陽性藥組大鼠自主活動次數(shù)增加(P<0.01),糞便粒數(shù)明顯減少(P<0.05),復(fù)方柴金解郁片高、中劑量組大鼠表現(xiàn)出自主活動增加(P<0.05或P<0.01),糞便粒數(shù)減少趨勢。
2.1.2糖水偏好實(shí)驗(yàn) Tab 3結(jié)果顯示,d 14,與空白組相比,模型組大鼠糖水偏嗜度明顯減少(P<0.01),有抑郁趨勢;d 35,與空白組相比,模型組大鼠糖水偏嗜度明顯減少(P<0.01);與模型組相比,陽性藥組大鼠糖水偏嗜度明顯增加(P<0.05),復(fù)方柴金解郁片高、中劑量組大鼠糖水偏嗜度有所增加。
2.1.3戊巴比妥鈉閾上劑量作用實(shí)驗(yàn) Tab 4結(jié)果顯示,造模給藥期結(jié)束后,與空白組相比,模型組大鼠睡眠潛伏期明顯增長(P<0.01),睡眠時長縮短(P<0.01);與模型組比較,陽性藥組和復(fù)方柴金解郁片高、中劑量組大鼠睡眠潛伏期顯著縮短,睡眠時長明顯增加(P<0.05或P<0.01),低劑量組大鼠睡眠變化的趨勢不具有統(tǒng)計(jì)學(xué)意義。
2.1.4戊巴比妥鈉閾下劑量作用實(shí)驗(yàn) Tab 4結(jié)果顯示,與空白組相比,模型組大鼠在戊巴比妥鈉閾下劑量誘導(dǎo)下沒有動物入睡;與模型組比較,陽性藥組入睡率達(dá)66.67%,具有明顯提升(P<0.01),復(fù)方柴金解郁片高、中劑量組與戊巴比妥鈉閾下劑量共同作用誘導(dǎo)大鼠入睡率分別為33.33%、50%,均有明顯提高(P<0.05或P<0.01)。
2.2 氨基酸類神經(jīng)遞質(zhì)含量
2.2.1下丘腦中氨基酸類神經(jīng)遞質(zhì)含量 Tab 5結(jié)果顯示,與空白組比較,模型組大鼠下丘腦中Glu含量明顯升高,GABA含量明顯降低(P<0.01);與模型組相比,除復(fù)方柴金解郁片低劑量組外,其余各給藥組均能明顯逆轉(zhuǎn)Glu、GABA含量變化(P<0.05或P<0.01)。
2.2.2海馬中氨基酸類神經(jīng)遞質(zhì)含量 Tab 6結(jié)果顯示,與空白組比較,模型組大鼠海馬中Glu含量明顯升高,GABA含量明顯降低(P<0.01);與模型組相比,陽性藥和復(fù)方柴金解郁片高、中劑量均能明顯逆轉(zhuǎn)Glu、GABA含量變化(P<0.05或P<0.01),與上述下丘腦中結(jié)果一致。
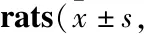
Tab 2 Comparison of autonomous activity ability in n=8)
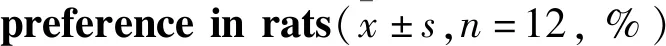
Tab 3 Comparison of sucrose water
2.3 GABA相關(guān)蛋白表達(dá)
2.3.1下丘腦中GABA信號相關(guān)分子蛋白表達(dá) Fig 1、2結(jié)果顯示,與空白組相比,模型組大鼠下丘腦GAD67、GABAAR、GABABR蛋白表達(dá)下降(P<0.05或P<0.01);與模型組比較,陽性藥組大鼠下丘腦中各指標(biāo)表達(dá)明顯升高(P<0.01),復(fù)方柴金解郁片各劑量組對于各指標(biāo)表達(dá)有提高作用。
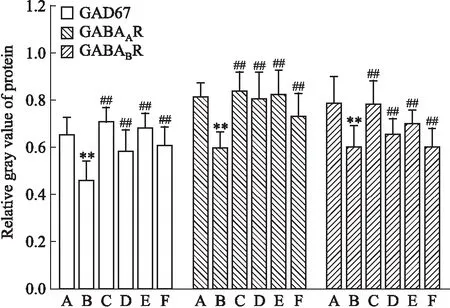
Fig 1 Expression of GAD67,GABAAR,GABABR relative gray value of protein in hypothalamus of n=3)
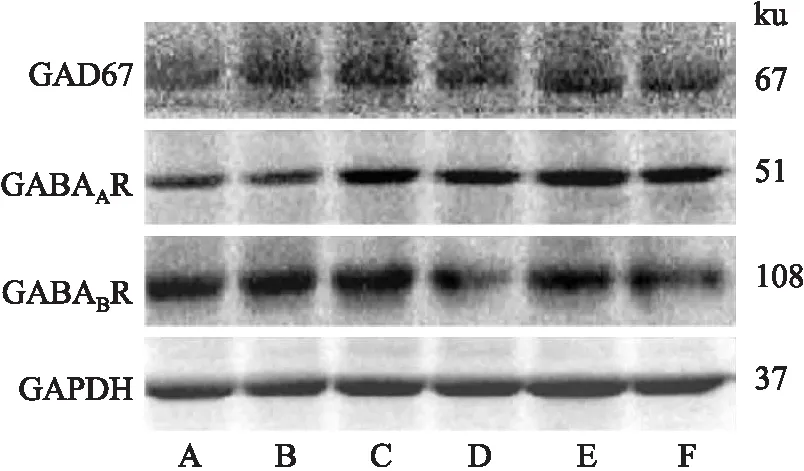
Fig 2 GAD67,GABAAR,GABABR proteinexpression in hypothalamus of ratsA:Control;B:Model;C:Positive drug;D:High;E:Medium;F:Low
2.3.2海馬中GABA信號相關(guān)分子蛋白表達(dá) Fig 3、4結(jié)果顯示,與空白組相比,模型組大鼠海馬中GAD67、GABAAR、GABABR蛋白表達(dá)下降(P<0.05或P<0.01);與模型組比較,陽性藥組大鼠海馬中各指標(biāo)表達(dá)明顯升高(P<0.01),復(fù)方柴金解郁片各劑量組對于各指標(biāo)表達(dá)有提高作用。
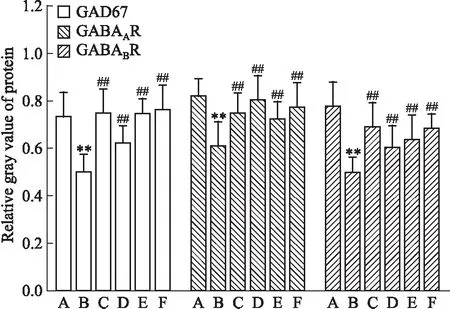
Fig 3 Expression of GAD67,GABAAR,GABABR relative gray value of protein in hippocampus of
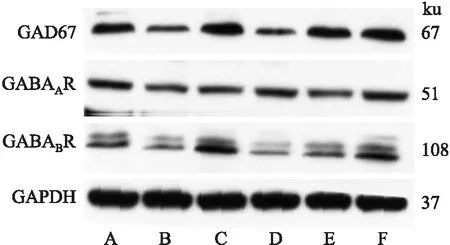
Fig 4 GAD67,GABAAR,GABABR protein expression in hippocampus of ratsA:Control;B:Model;C:Positive drug;D:High;E:Medium;F:Low
2.4 GABA相關(guān)分子基因表達(dá)
2.4.1下丘腦中GABA相關(guān)分子基因表達(dá) Tab 7結(jié)果顯示,與空白組相比,模型組大鼠下丘腦GAD67、GABAAR、GABABR mRNA表達(dá)下降(P<0.01);與模型組比較,陽性藥組大鼠下丘腦中各指標(biāo)基因表達(dá)明顯升高(P<0.05或P<0.01),復(fù)方柴金解郁片各劑量組均能提高各指標(biāo)基因表達(dá),中劑量效果最為顯著。
2.4.2海馬中GABA相關(guān)分子基因表達(dá) Tab 8結(jié)果顯示,與空白組相比,模型組大鼠海馬GAD67、GABAAR、GABABR基因表達(dá)下降(P<0.01);與模型組比較,除復(fù)方柴金解郁片低劑量組外,各給藥組大鼠海馬中各指標(biāo)基因表達(dá)明顯升高(P<0.05或P<0.01)。
Tab 4 Comparison of hypnotic synergism of suprathreshold and subthreshold dose of pentobarbital min)

Tab 5 Comparison of Glu and GABA contents in rat
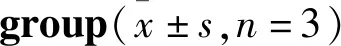
Tab 6 Comparison of Glu and GABA contents in rat hippocampus in each
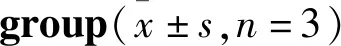
Tab 7 Results of GAD67,GABAAR,GABABR mRNA in hypothalamus of rats in each
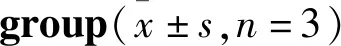
Tab 8 Results of GAD67,GABAAR,GABABR mRNA in hippocampus of rats in each
3 討論
睡眠障礙是抑郁癥標(biāo)志性癥狀。異常的睡眠征兆包括慢波睡眠(slow wave sleep,SWS)減少或沒有,快速眼動(rapid eye movement sleep,REM)睡眠潛伏期縮短,睡眠覺醒時間增加,呈現(xiàn)更多的碎片化睡眠。目前,臨床上針對抑郁癥失眠的治療最為常見的是在使用抗抑郁藥基礎(chǔ)上合用鎮(zhèn)靜催眠藥,而針對GABA為治療靶點(diǎn)的抗抑郁癥失眠中藥藥物的研究十分有限。本課題組擬在前期復(fù)方柴金解郁片治療抑郁癥機(jī)制研究[8]的基礎(chǔ)上以期尋找能對抗抑郁癥失眠的創(chuàng)新治療藥物。因此,我們設(shè)計(jì)實(shí)驗(yàn)研究復(fù)方柴金解郁片在神經(jīng)系統(tǒng)是否對CUMS聯(lián)合睡眠剝奪誘導(dǎo)的抑郁癥失眠有改善作用及其保護(hù)海馬和下丘腦的機(jī)制。
本實(shí)驗(yàn)分別于抑郁造模14 d后和復(fù)合造模結(jié)束后對各組大鼠進(jìn)行行為學(xué)評價,目的是確定復(fù)合模型大鼠在抑郁狀態(tài)前提下進(jìn)行失眠造模,從而觀察復(fù)方柴金解郁片對大鼠抑郁樣和失眠行為的改善作用。曠場實(shí)驗(yàn)結(jié)果顯示,復(fù)方柴金解郁片高、中劑量組相比于模型組大鼠活動度、對新鮮事物的好奇程度增加,警覺性降低,表明復(fù)方柴金解郁片能夠明顯增加抑郁癥失眠大鼠的興奮性和探究趨勢,緩解其緊張恐懼心理。糖水偏好實(shí)驗(yàn)結(jié)果顯示復(fù)方柴金解郁片中劑量顯著提高了模型大鼠的快感程度。戊巴比妥鈉閾上和閾下劑量實(shí)驗(yàn)是通過觀察受試藥物是否能延長戊巴比妥鈉的睡眠時間,判斷其是否有協(xié)同抑制失眠作用。本研究結(jié)果表明,復(fù)方柴金解郁片中劑量能夠縮短模型大鼠的睡眠潛伏期,延長大鼠的睡眠時間,提高大鼠的入睡率。綜上行為學(xué)實(shí)驗(yàn)結(jié)果,提示復(fù)方柴金解郁片高、中劑量能緩解大鼠的抑郁失眠癥狀。
海馬是下丘腦-垂體-腎上腺(hypothalamic pituitary adrenal,HPA)軸負(fù)反饋的調(diào)節(jié)中樞,參與應(yīng)激的神經(jīng)內(nèi)分泌和情緒調(diào)節(jié)。下丘腦是HPA軸的一個重要神經(jīng)內(nèi)分泌中樞,其通過垂體控制內(nèi)分泌激素的釋放,從前到后分為3個部分:視上區(qū)、結(jié)節(jié)區(qū)、乳頭區(qū),其中視交叉上核中的神經(jīng)元幾乎全部為GABA神經(jīng)元主要調(diào)控晝夜節(jié)律,參與抑郁癥失眠癥狀[9]。這兩個腦區(qū)被認(rèn)為是抑郁癥失眠發(fā)病的關(guān)鍵靶區(qū)。

綜上,復(fù)方柴金解郁片能對抗Glu/GABA比例失衡引起的神經(jīng)元損傷,保護(hù)海馬和下丘腦,改善抑郁樣行為和失眠狀態(tài)。其神經(jīng)保護(hù)機(jī)制主要是下調(diào)興奮性氨基酸類神經(jīng)遞質(zhì)Glu、上調(diào)GABA通路相關(guān)分子GAD67、GABAAR和GABABR,從而加快神經(jīng)元成熟,促進(jìn)神經(jīng)元修復(fù),并最終改善抑郁失眠。

