長鏈烷基咪唑離子液體的合成及分子模擬
豐志航,唐好慶,鄭 超,田 甜,母靜波,郭增彩
(河北工程大學 材料科學與工程學院,河北 邯鄲 056038)
離子液體(Ionic Liquid)是一種基本上由有機陽離子和陰離子組成且在室溫或接近室溫的條件下呈現為液態的物質,也被稱為常溫熔融鹽[1-5]。離子液體與普通的化學溶劑相比,電化學窗口更加寬廣[6]、可保持性更加優秀、電子密度更加高、穩定性更加高以及揮發性更加低[7-9],因此在合成、催化、電化學等領域有著十分廣泛的應[10-12]。現在,對離子液體的研究已經進入了一個更加深入和多元化的新層次,人們開始對其結構進行改造優化,通過添加相應的官能團來制備具有特殊功能的離子液體,這就是功能性離子液體,如季銨鹽類[13]、季磷鹽類[14]以及膽堿類[15]等。在國內研究中,天津大學梁曉通[16]團隊就成功開發了以乙酰苯胺和二氧化硫為原料一步法合成4-乙酰胺基苯亞磺酸的新工藝。而且離子液體作為一種新材料,相比于其他普通溶劑具有蒸汽壓極低,熱穩定性和化學穩定性更好等優點。在界面效應研究領域離子液體也被廣泛應用,比如利用離子液體來改性某些材料的表面,進而制造超級電容器、電池[17]、高分子納米材料以及某些儲能容器以及傳感器等,例如中南民族大學的徐夢文團隊[18]以離子液體和貴金屬復合材料或碳材料作為載體制備了新型的生物免疫傳感器、生物小分子電化學傳感器等。這些研究大多基于離子液體上不同的烷基鏈種類或者烷基鏈鏈長,因為這樣比較容易設計實驗和合成路徑以達到實驗目的。
由于離子液體的某些性質主要由陰陽離子及其整體結構決定,所以通過改變離子液體上相應陰離子和陽離子,可以改變離子液體相應性質,從而實現在離子液體與相關材料相互作用后對材料表面進行改性。表面改性之后的材料由于離子液體上陰陽離子的多樣性也呈現出相對應的各不相同的性質,為了滿足不同場景使用的需要,挑選出最適合的離子液體也就是最適合的陰陽離子來對材料進行改性是十分有必要的。因此,本文合成了1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br),采用DFT/B3LYP/6-31方法優化[REhIM]Br離子液體的分子結構,通過理論計算得到了分子中的部分鍵長、鍵角、電荷分布、離子間作用能以及電子結構參數EHOMO和ELUMO能以及能隙ΔELUMO-HOMO。
1 實驗
1.1 主要原料
合成1-烷基-3-乙羥基咪唑溴離子液體的主要原料如表1所示。

表1 實驗需要的主要原料
1.2 合成方法
1.2.1 長鏈烷基咪唑的合成
先取一定量咪唑與四氫呋喃配制成待使用的溶液。再取一定量的氫化鈉溶于四氫呋喃中,并且一邊攪拌,一邊將之前配制好的待使用溶液慢慢滴入,制成溶液體系A。另一邊,將溴代烷烴加入四氫呋喃中制成溶液B,滴加至溶液A中并將環境抽成真空,充入N2作為保護氣,不斷攪拌一段時間(不同鏈長的溴代烷烴所需反應與攪拌時間不同),攪拌結束后進行減壓過濾,對得到的濾液旋蒸即可得到所需的相應長鏈烷基咪唑。本文合成的是十烷基、十二烷基以及十四烷基咪唑,即RIM,其中R=C10H21、C12H25和C14H29[19],其合成路線如圖1所示:
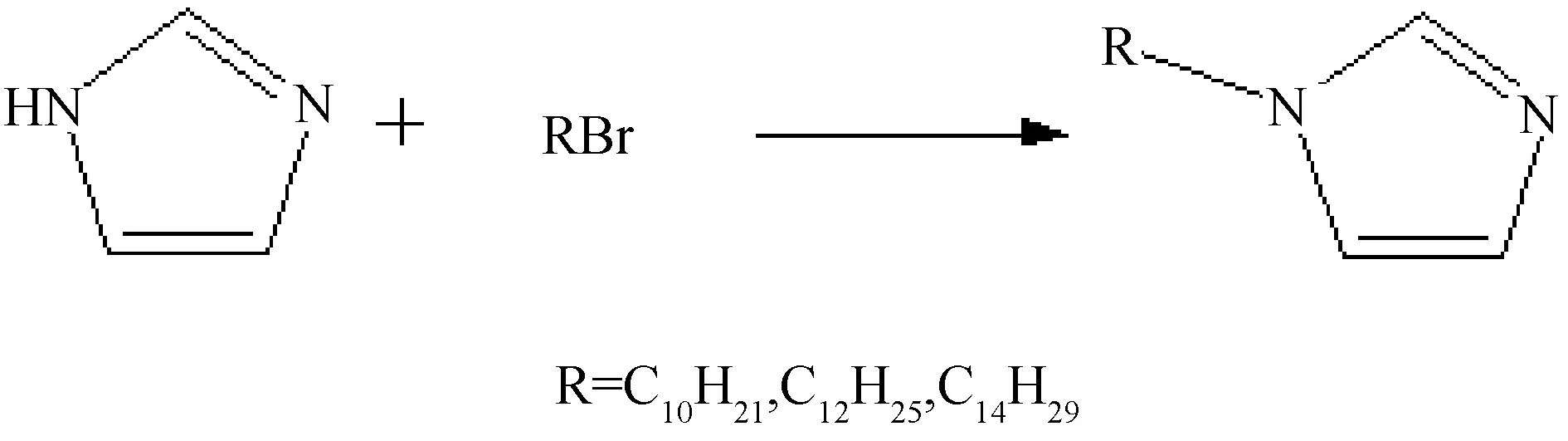
圖1 十烷基、十二烷基以及十四烷基咪唑的合成路線圖Fig.1 Roadmap for the synthesis of cetyl, dodecyl and tetradecyl imidazoles
1.2.2 [REhIM]Br離子液體的合成
合成了十烷基、十二烷基以及十四烷基咪唑之后,將其作為反應物繼續合成1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)。取適量十烷基咪唑DIM,并將一定質量的2-溴乙醇加入相應烷基咪唑中,再加入乙醇作為此反應的反應介質。然后將整個體系放入油浴中78 ℃反應回流5 h,最終得到相應的[DEhIM]Br離子液體,[REhIM]Br離子液體的相關反應路線如圖2所示。
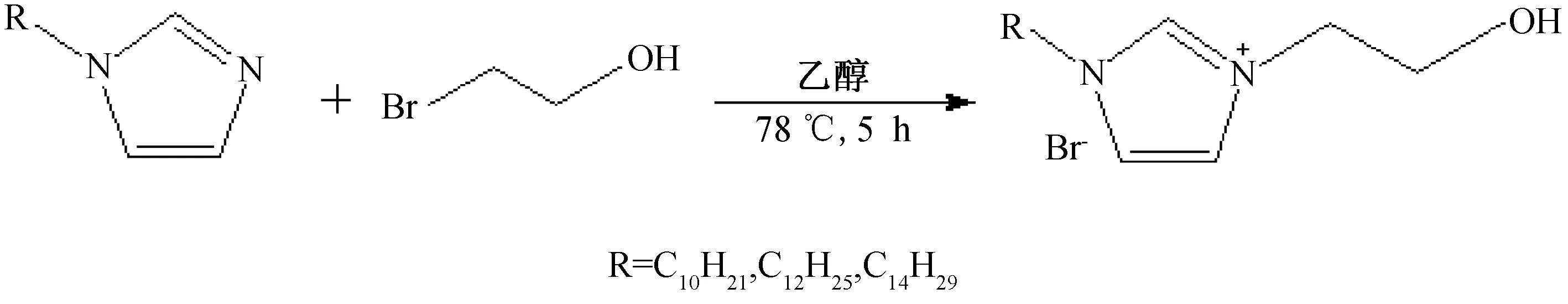
圖2 [CnEhIM]Br離子液體的合成路線圖Fig.2 Roadmap for the synthesis of [CnEhIM]Br ionic liquids
2 理論計算
2.1 [REhIM]Br離子液體的分子結構優化
(1) 使用ChemDraw軟件畫出1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的平面分子結構如圖3,并在高斯軟件GuassianView 5.0中得到相對應的立體分子結構如圖4所示。
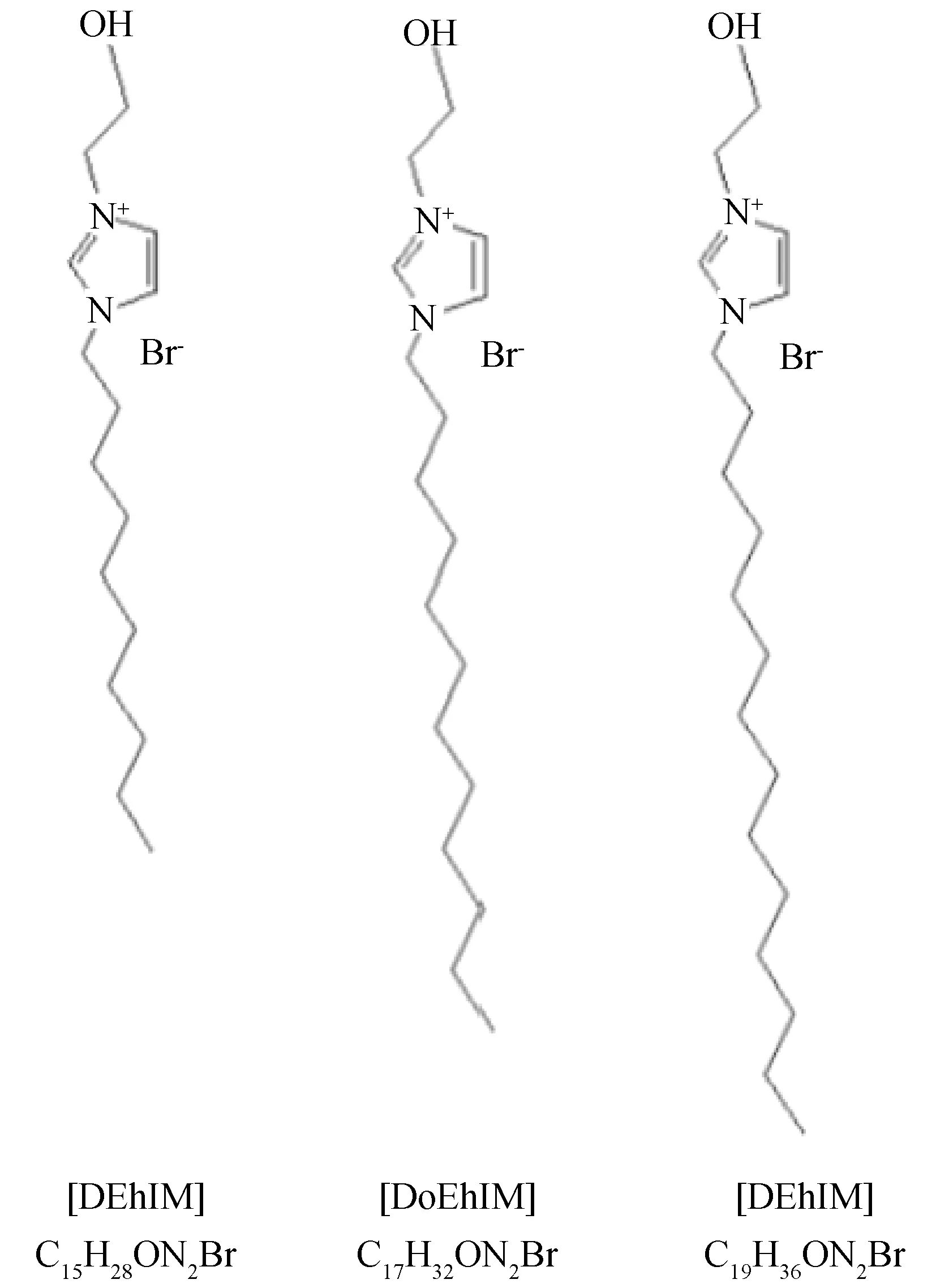
圖3 [REhIM]Br離子液體的平面結構Fig.3 Planar structure of [REhIM]Br ionic liquids
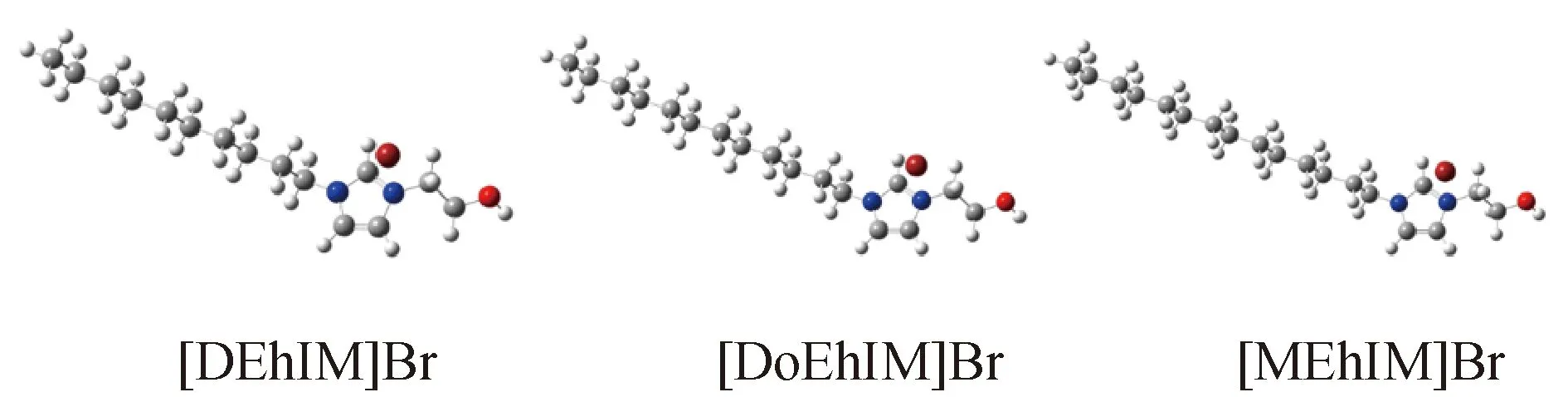
圖4 [REhIM]Br離子液體的立體分子結構Fig.4 Stereomolecular structure of [REhIM]Br ionic liquids
(2) 得到1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的立體結構后,采用DFT密度泛函理論方法,結合B3LYP/6-31G對上述三種離子液體進行幾何構型優化計算,優化后得到的最穩定構型如圖5所示。
圖5 [REhIM]Br離子液體的最穩定構型Fig.5 The most stable configuration of [REhIM]Br ionic liquids
2.2 1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的鍵長、鍵角
1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)在結構上的不同主要是烷基側鏈長度的不同,烷基鏈長度以及陰離子種類的不同都可能會引起離子液體微結構的改變[20],為了得到具體的對比數據,采用DFT/B3LYP/6-31G理論方法對上述三種離子液體進行結構優化的同時也得到了其分子內所有化學鍵的鍵長、鍵角數據,并在表2中列出部分鍵長數據,表3中列出部分鍵角數據。
通過對表2和表3所給出的數據進行分析,可以發現在固定陰離子不變的情況下,烷基咪唑型離子液體的各類化學鍵鍵長鍵角隨著烷基鏈增長而發生的變化微乎其微,幾乎與烷基鏈長無關。比對計算得出的鍵長數據后,可以發現,不論有多長的烷基側鏈,咪唑環上兩個成雙鍵的C原子上的C—H鍵鍵長要比烷基鏈上的C—H鍵鍵長稍微短一些,也說明了咪唑環上兩個成雙鍵的C原子比起其他C原子要更加穩定。
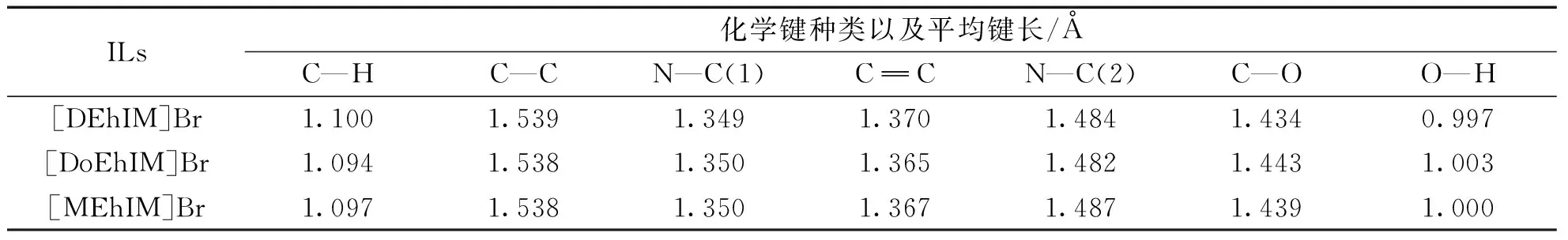
表2 [REhIM]Br離子液體的部分化學鍵平均鍵長

表3 [REhIM]Br離子液體的部分化學鍵平均鍵角
2.3 1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的電荷分布
離子液體的一個非常明顯的特點就是電荷分布較分散,而電荷分布在一定程度上也有可能對離子液體的結構以及各種理化性質有著一定的影響,為了得到相關數據來對這種影響進行研究,采用了DFT/B3LYP/6-31G理論方法對1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)穩定幾何結構的Mulliken電荷分布進行了計算,為了計算結果的展示方便,先對陽離子咪唑環上部分原子標號,如圖6所示,并在表4中列出了陽離子咪唑環上部分原子以及陰離子Br-的Mulliken電荷分布數據。
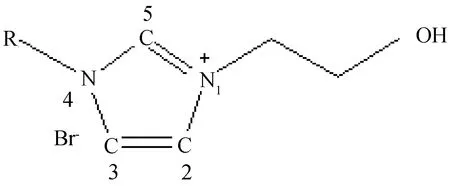
圖6 陽離子咪唑環上部分原子的標號Fig.6 The labeling of some atoms on the cationic imidazole ring.
從表4的數據可以分析得出,1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的陽離子咪唑環上的電荷分布并沒有隨著N(4)原子上相連的烷基鏈鏈長的增加而發生改變,由于烷基的給電子性較弱,隨著烷基鏈的增長,遠離咪唑環上N(4)原子的-CH2以及端基-CH3對咪唑環上N(4)原子的電荷分布的影響越來越小甚至于接近無影響。以上結論是在保持離子液體陰離子不變且為Br-而得出的,如果改變陰離子的種類,例如使用NO3-或者ClO4-這類吸電子能力比較強的基團,陽離子咪唑環上原子的電荷分布以及電荷轉移將受到較大的影響。
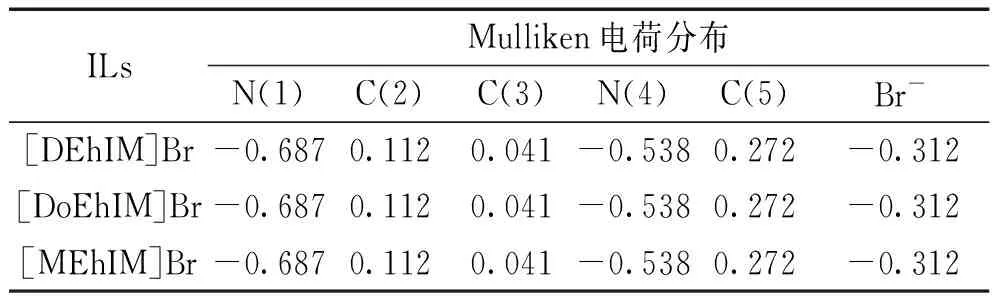
表4 [REhIM]Br離子液體陽離子咪唑環上部分原子以及陰離子的Mulliken電荷分布
2.4 1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的單點能以及離子間作用能
除了鍵長鍵角和電荷分布,離子液體的單點能即分子的總電子能量也是能反映其物化性質的一類重要的數據。通過保持陰離子種類不變而增加烷基鏈鏈長來研究烷基鏈鏈長對烷基咪唑離子液體總電子能的影響,采用DFT/B3LYP/6-31G理論方法對1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的穩定幾何構型的總電子能進行了計算,得到了如表5所示的數據。
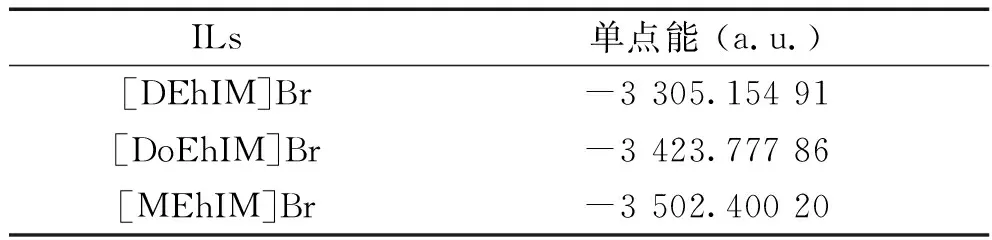
表5 [REhIM]Br離子液體穩定構型的單點能
通過[REhIM]Br離子液體的單點能以及陰、陽離子的單點能還可以進一步計算得到離子液體的離子間作用能。離子間作用能可以反映出陰陽離子間的庫侖靜電吸引力與烷基側鏈范德華排斥力之間的平衡,因此,[REhIM]Br離子液體的離子間作用能ΔE(kJ·mol-1)可以通過公式 (1) 進行計算:
ΔE(kJ·mol-1)=2 625.5[EAX(a.u.)-
EX-(a.u.)-EA+(a.u.)]
(1)
式中:EAX為[REhIM]Br離子液體的單點能(a.u.),EX-為Br-陰離子的單點能(a.u.),EA+為[REhIM]+陽離子的單點能(a.u.)。
為了得到1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的陽離子和陰離子的單點能,得到離子液體的離子間作用能,研究離子之間的相互作用對離子液體的理化性質所產生的影響,采用DFT/B3LYP/6-31G的理論方法分別對上述離子液體穩定構型的陰、陽離子進行計算,得到的單點能數據列于表6中。
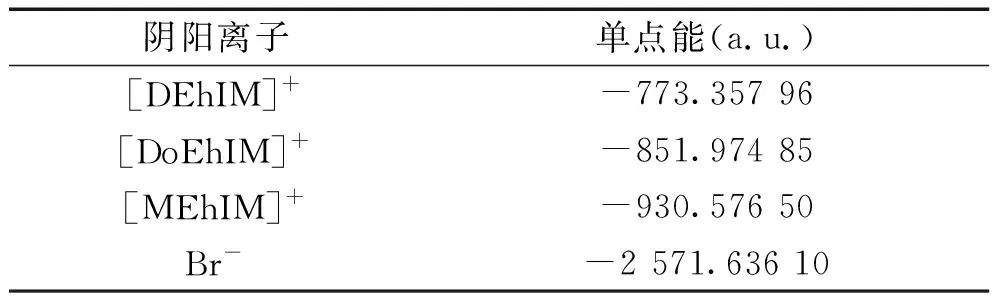
表6 [REhIM]Br離子液體的陰陽離子單點能
將表5和表6中的數據帶入公式(1)進行計算,得出[DEhIM]Br離子液體的離子間作用能為-422.3 kJ·mol-1,[DoEhIM]Br離子液體的離子間作用能為-421.7 kJ·mol-1以及[MEhIM]Br離子液體的離子間作用能為-420.7 kJ·mol-1。通過對表5和表6的數據以及計算得到離子間作用能的數據進行分析,可以知道當陰離子相同且為Br-時,1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的單點能以及相互作用能隨著烷基側鏈長度增長減小,[DEhIM]Br離子液體的結構最穩定。
2.5 1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的電子結構
離子液體分子電子結構內的最高占據軌道叫做HOMO能級,最低未占據軌道叫做LUMO能級,其所含的能量之差叫做能隙ΔELUMO-HOMO。能隙所代表的是電子從已占據軌道向空軌道躍遷的能力,它的數值越大,代表著分子越穩定。表7為1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的EHOMO和ELUMO能以及能隙ΔELUMO-HOMO。

表7 [REhIM]Br離子液體的HOMO能、LUMO能以及能隙
從表7中的數據可以看出,隨著烷基鏈的增長,1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的EHOMO和ELUMO能以及能隙ΔELUMO-HOMO的變化呈現出規律性的變化,按照能隙ΔELUMO-HOMO越大,發生化學反應所需能量越多,分子越穩定的規律進行判斷,[DEhIM]Br離子液體分子的結構最穩定,[DoEhIM]Br離子液體次之,[MEhIM]Br離子液體的結構最不穩定,這與1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的離子間作用能得到的分子結構穩定性相一致。
3 結論
1) 在固定陰離子不變的情況下,烷基咪唑型離子液體的各類化學鍵鍵長鍵角隨著烷基鏈增長而發生的變化微乎其微,幾乎與烷基鏈長無關。不論有多長的烷基側鏈,咪唑環上兩個成雙鍵的C原子上的C-H鍵鍵長要比烷基鏈上的C-H鍵鍵長稍微短一些,也說明了咪唑環上兩個成雙鍵的C原子比起其他C原子要更加穩定。
2) 1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的陽離子咪唑環上的電荷分布并沒有隨著N(4)原子上相連的烷基鏈鏈長的增加而發生改變,由于烷基的給電子性較弱,隨著烷基鏈的增長,遠離咪唑環上N(4)原子的-CH2以及端基-CH3對咪唑環上N(4)原子的電荷分布的影響越來越小,甚至于接近無影響。
3)[DEhIM]Br、[DoEhIM]Br和[MEhIM]Br離子液體的離子間作用能分別為-422.3、-421.7、-420.7 kJ·mol-1。當陰離子相同且為Br-時,1-烷基-3-乙羥基咪唑溴離子液體([REhIM]Br)的單點能以及相互作用能隨著烷基側鏈長度增長減小,[DEhIM]Br離子液體的結構最穩定。
4)隨著烷基鏈的增長,[REhIM]Br的EHOMO和ELUMO能以及能隙ΔELUMO-HOMO的變化呈現出規律性的變化,按照能隙ΔELUMO-HOMO越大,發生化學反應所需能量越多,分子越穩定,[DEhIM]Br離子液體分子的結構最穩定。

