腸道氣泡堆積對銀鯧組織抗氧化能力與溶菌酶活力的影響
鄭 迪,王 倩,王 磊,施兆鴻,彭士明
(1.中國水產科學研究院東海水產研究所,農業農村部東海漁業資源開發利用重點實驗室,上海 200090;2.上海海洋大學水產與生命學院,上海 201306)
銀鯧(Pampus argenteus)屬鱸形目(Perciformes),鯧科(Stromateidae),鯧屬,因其肉質細嫩、肌間刺較少,營養豐富,具有較高的市場價值與需求,是我國主要的海產經濟魚類之一[1]。20世紀80年代,國內已陸續開展銀鯧繁殖生物學方面的研究工作[2],截至目前,已取得銀鯧的人工繁育[3]、人工育苗[4]等方面研究成果,并于2016年在寧波地區實現人工養殖銀鯧親魚近萬尾[5],但目前關于疾病方面的研究較少。由于馴化時間較短、銀鯧環境適應能力較差等原因導致的病害問題,是制約銀鯧規模養殖和推廣的主要因素之一。
早在20世紀初,科威特就報道了某銀鯧養殖基地由于無乳鏈球菌(Streptococcusagalactiae)感染引起的大規模死亡現象[6],2015—2018年寧波象山地區銀鯧養殖基地先后爆發了由美人魚發光桿菌(Photobacterium damselae)感染導致的集體出血[7]和彩虹病毒感染導致的集中死亡現象[8]。此前研究所發現的均為細菌性或病毒性疾病,尚未見銀鯧腸道氣泡堆積相關的報道。腸道氣泡堆積是銀鯧養殖過程中一種常見的病理現象,從仔稚幼魚到高齡成魚都有可能發生,且該病發生在腸道內部,難以發現和控制[9],在養殖過程中致死率較高。本文通過對患有腸道氣泡堆積的銀鯧及健康銀鯧體內的4種組織(肝臟、腎臟、肌肉、鰓)超氧化物歧化酶(superoxide dismutase,SOD)活力、過氧化氫酶(catalase,CAT)活力、丙二醛(malondiadehyde,MDA)含量與總抗氧化能力(total antioxidant capacity,TAOC),以及兩種組織(鰓、腎臟)溶菌酶(lysozyme,LZM)活力的測定和比較,分析腸道氣泡堆積對銀鯧組織抗氧化能力和溶菌酶活力的影響,以期為該病理現象的防治提供數據支持,促進銀鯧養殖業的健康發展。
1 材料與方法
1.1 樣品采集
本實驗用銀鯧采自東海水產研究所福鼎研究中心工廠化養殖車間,該車間擁有4個銀鯧養殖池,養殖水體20 m3,每個養殖池均采用相同的日常管理措施:每天飽食投喂2次(7∶00和16∶00),日換水量50%,水溫20~22℃,鹽度25~27,pH為8.1~8.2,溶解氧保持在7 mg·L-1。在管理過程中注意觀察魚的游動行為,對行為異常如游動速度加快[10]、垂直或水平停在水面[11]、躁動不安、對驚嚇敏感甚至跳出水面[9]等疑似腸道氣泡堆積的銀鯧進行采集,撈起后于25 mg·L-1丁香酚中麻醉,冰盤解剖,肉眼觀察其腸道內是否有明顯的氣泡堆積,如有則可確認其為所需要的病魚樣品(圖1)。取其肝臟、腎臟、肌肉和鰓在預冷的生理鹽水中漂洗后,濾紙拭干,液氮速凍后于-80℃保存,待樣品全部采集完成后帶回實驗室統一測定。病魚取15尾為有氣泡組,平均叉長為(11.7±0.8)cm,平均體質量為(42.8±4.1)g。另選攝食、游動等行為正常,有活力、游動有規律且解剖觀察腸道無氣泡堆積的健康魚15尾為對照組,平均叉長為(12.5±0.7)cm,平均體質量為(48.6±5.6)g。兩組樣品取樣方法一致。

圖1 病魚的腸道氣泡堆積Fig.1 Intestinal bubble accumulation in diseased Pampus argenteus
1.2 酶活力測定
銀鯧的肝臟、腎臟、肌肉和鰓組織中蛋白含量的測定采用考馬斯亮藍法,T-AOC、CAT、SOD和LZM活力、MDA含量的測定均嚴格按照南京建成生物公司檢測試劑盒說明書進行操作。隨機取3尾魚的樣品組織混為一個樣品進行檢測,對照組與病魚組每個組織分別檢測5次,每次檢測3個重復,取平均值。
1.3 數據處理
所得數據以平均值±標準差(means±SD)表示,實驗結果采用SPSS19.0進行統計分析,并進行獨立樣本t檢驗,分析各組間相關參數差異顯著性,并使用Excel 2010作圖。
2 結果與分析
2.1 腸道氣泡堆積對銀鯧4種組織中T-AOC活力的影響
腸道氣泡堆積對銀鯧4種組織T-AOC活力的影響見圖2,相比對照組,病魚組肝臟、鰓和腎臟中T-AOC活力都有下降,其中肝臟和腎臟下降顯著(P<0.05);但病魚組肌肉中T-AOC活力顯著高于對照組(P<0.05)。

圖2 腸道氣泡堆積對銀鯧4種組織中T-AOC活力的影響Fig.2 Effect of intestinal bubble accumulation on T-AOC activity in 4 tissues of Pampus argenteus
2.2 腸道氣泡堆積對銀鯧4種組織中SOD活力的影響
腸道氣泡堆積對銀鯧4種組織SOD活力的影響見圖3,肝臟中SOD活力高于其他各組織;對照組肝臟和肌肉中SOD活力顯著高于病魚組(P<0.05),而在鰓和腎臟SOD活力在病魚組與對照組間沒有顯著差異(P>0.05)。

圖3 腸道氣泡堆積對銀鯧4種組織中SOD活力的影響Fig.3 Effect of intestinal bubble accumulation on SOD activity in 4 tissues of Pampus argenteus
2.3 腸道氣泡堆積對銀鯧4種組織中CAT活力的影響
腸道氣泡堆積對銀鯧4種組織CAT活力的影響見圖4,肝臟中CAT活力高于其他組織;對照組肝臟和肌肉中CAT活力顯著高于病魚組(P<0.05),而在鰓和腎臟中沒有顯著差異(P>0.05)。
2.4 腸道氣泡堆積對銀鯧4種組織中MDA含量的影響
腸道氣泡堆積對銀鯧4種組織MDA含量的影響見圖5,病魚組肝臟和肌肉中MDA含量顯著高于對照組(P<0.05),但鰓和腎臟中MDA含量顯著低于對照組(P<0.05)。

圖4 腸道氣泡堆積對銀鯧4種組織中CAT活力的影響Fig.4 Effect of intestinal bubble accumulation on CAT activity in 4 tissues of Pampus argenteus

圖5 腸道氣泡堆積對銀鯧四種組織中MDA含量的影響Fig.5 Effect of intestinal air bubble accumulation on MDA content in various tissues of Pampus argenteus
2.5 腸道氣泡堆積對銀鯧兩種組織中LZM活力的影響
腸道氣泡堆積對銀鯧兩種組織LZM活力的影響見圖6,病魚組鰓上LZM活力顯著高于對照組(P<0.05),而在腎臟中沒有顯著差異(P>0.05)。
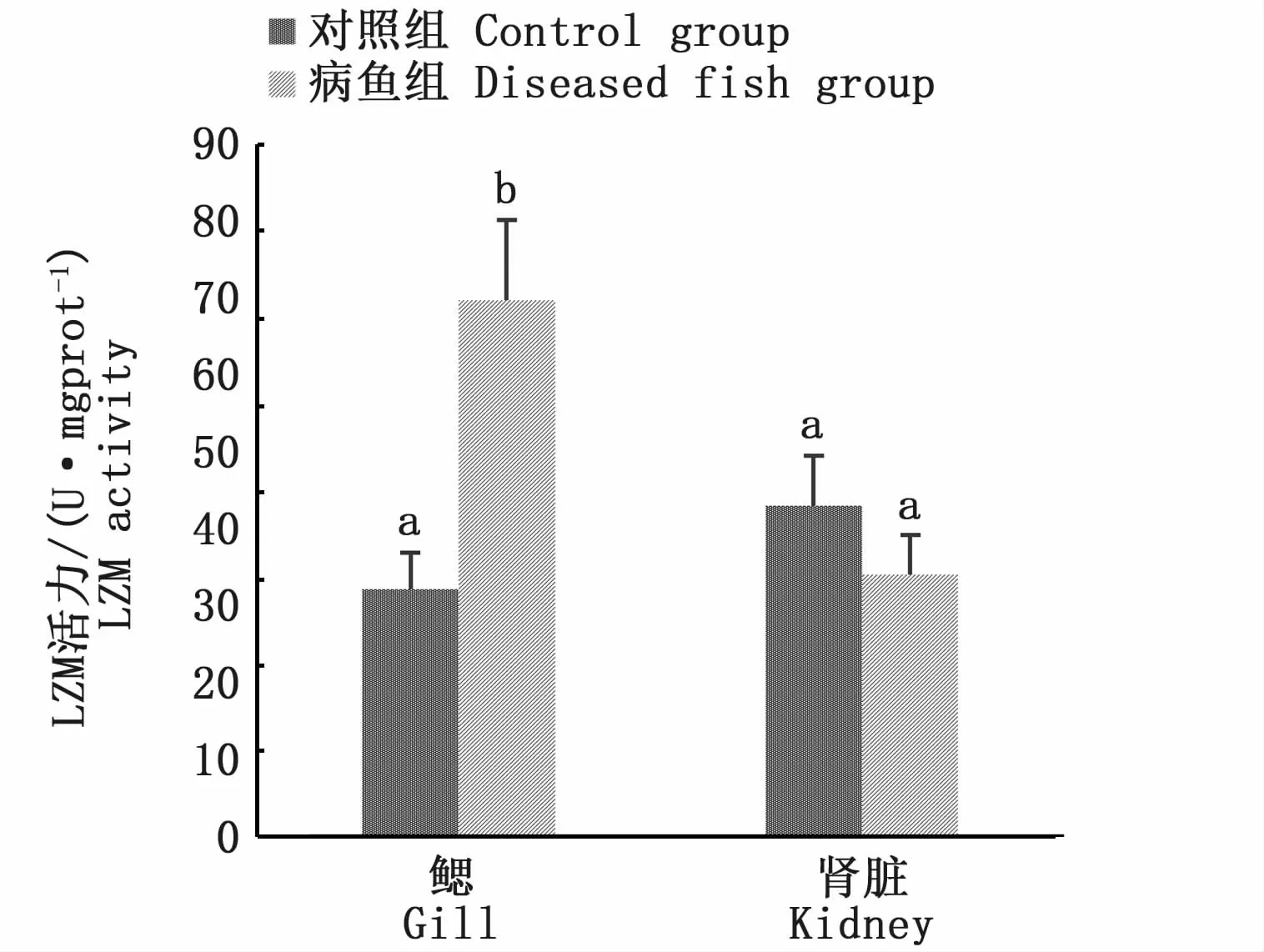
圖6 腸道氣泡堆積對銀鯧兩種組織中LZM活力的影響Fig.6 Effect of intestinal bubble accumulation on LZM activity in 2 tissues of Pampus argenteus
3 討論
目前對于魚類腸道氣泡堆積的研究還不深入,腸道內大氣泡的形成是來自各組織以及血管的微氣泡匯集,通常在顯微鏡下便可觀察到微氣泡的移動和匯集[12]。微氣泡最初如何形成尚待研究,但這些微氣泡的移動和匯集會引起組織損傷并隨之導致自由基的增多,而過量的自由基則會破壞宿主細胞[13]。在長期進化過程中,魚類機體形成了一套抗氧化酶防御系統,主要包括CAT、SOD等,可以有效地將機體多余的自由基清除,保護機體免受氧化損傷[14]。
3.1 腸道氣泡堆積對銀鯧4種組織抗氧化酶活力的影響
總抗氧化能力是評價機體抗氧化酶系統和非酶促系統功能的綜合性指標[15],可以反映機體抗氧化防御系統的狀態。已有研究表明,病害的發生會顯著降低水產動物抗氧化酶活力,如患水霉病鯉(Cyprinuscarpio)與健康鯉相比,血漿總抗氧化能力極顯著降低[16];陳萍等[17]用溶藻弧菌感染三疣梭子蟹(Portunustrituberculatus)后發現其抗氧化能力顯著降低。本研究中,病魚組肝臟和腎臟T-AOC活力下降顯著,說明腸道氣泡堆積會導致銀鯧部分組織T-AOC活力降低,造成魚體抗氧化系統紊亂。
SOD和CAT是清除活性氧自由基的重要酶蛋白,對機體細胞損傷后的氧化過程和吞噬作用具有很強的防御功能,通常認為:SOD在清除活性氧的過程中最早發揮作用,它首先促使O2-歧化為H2O2和H2O,隨后CAT再將H2O2催化為H2O和O2,從而達到為機體解毒的目的[18]。在本實驗中,患有腸道氣泡堆積的銀鯧鰓和腎臟中的SOD、CAT活力和健康銀鯧沒有顯著差異,但肝臟和肌肉中的SOD、CAT活力顯著低于健康銀鯧,說明就抗氧化酶系統而言,腸道氣泡堆積對銀鯧肝臟和肌肉的影響較大,對鰓和腎臟影響相對較小,這在陳寅兒等[19]對三疣梭子蟹乳化病的研究中也有類似結論。對于肌肉中T-AOC活力的顯著上升,而SOD、CAT活力顯著下降現象,其原因可能是魚體在腸道氣泡堆積發生情況下的一種機體自我保護機制,具體原因需要進一步的研究確定。
MDA是一種高活力的脂質過氧化產物,既可用作脂質過氧化程度的衡量指標,也可間接反映機體內活性氧的累計[20],該指標常與SOD和CAT活力指標相互配合使用[21]。在本實驗中,患病銀鯧的肝臟和肌肉中的MDA含量顯著高于健康銀鯧,說明這兩處組織已出現自由基的代謝紊亂,而過多自由基的產生以及自由基清除酶的活力降低或合成障礙,使得自由基進一步堆積,加劇損害,這與前文CAT和SOD活力研究相符合。另外,本實驗選取病魚樣品為腸道內已有大氣泡聚集,即發病后期,氣泡在魚體內移動,匯集期間產生的組織損傷或許是導致這兩處組織MDA含量異常的原因之一。對于在鰓和腎臟中,患病銀鯧MDA含量顯著低于健康銀鯧,其原因可能在腸道氣泡堆積發生期間,這兩處組織應對其病理發生的機制與肝臟和肌肉組織有所差異[22],具體原因仍需進一步研究分析。
3.2 腸道氣泡堆積對銀鯧兩種組織溶菌酶活力的影響
LZM是白細胞中一類先天免疫防御成分,它通過水解細胞壁中的肽聚糖來殺滅細菌[23],其活性一定程度上可以反映機體抵御細菌侵襲的能力[24]。在本實驗中,患病銀鯧腎臟LZM活力與健康銀鯧沒有顯著差異,但鰓上LZM活力顯著高于健康銀鯧。腸道氣泡堆積的發生極易造成組織損傷,從而導致各種致病微生物繼發感染,其中尤以細菌和真菌最多見[12],所以患病魚鰓上很有可能出現細菌感染,從而激發了鰓上溶菌酶免疫應答體系,使得LZM的活力顯著升高,但具體原因仍有待進一步分析確定。另外,在理化和生物因子異常引起的脅迫情況下,LZM活力也可以作為魚類應激程度的指示信號[25]。有研究顯示,當水體中懸浮物過多時,半滑舌鰨(Cynoglossus semilaevisGünther)肝臟中LZM活力在5d內顯著升高[26]。華 育 平 等[27]發 現 嗜 水 氣 單 胞 菌(Aeromonashydrophila)感染后的施氏鱘(Acipenser schrenckii)血清及各組織中LZM出現不同程度升高。在本實驗中,當腸道氣泡堆積發生時,微氣泡從組織和血管移動到腸道匯集成大氣泡,而鰓作為魚類呼吸器官,同時也是微血管最密集的體組織之一,有可能處于應激狀態,但仍需其他指標進行佐證。
4 小結
本實驗通過對患有腸道氣泡堆積的銀鯧及健康銀鯧體內4種組織(肝臟,腎臟、肌肉和鰓)SOD、CAT、T-AOC活力、MDA含量以及兩種組織(鰓和腎臟)LZM的測定和比較,發現該病對魚類肝臟、肌肉抗氧化酶活力影響較大,這兩種組織的抗氧化酶活力指標或可以成為該病檢測和病理分析的重要依據之一,而腸道氣泡堆積導致的鰓溶菌酶活力升高,可能是腸道氣泡堆積發生期間伴隨著鰓組織炎癥的發生,具體原因仍待進一步深入研究分析。

