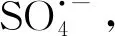過(guò)硫酸鹽氧化Fe(Ⅱ)生成Fe(Ⅳ)降解二甲基異莰醇和土臭素的效能和機(jī)理
韋 潔,段杰斌,張 茜,王永廣,楊兢欣,董紫君,*
(1.揚(yáng)州大學(xué)環(huán)境科學(xué)與工程學(xué)院,江蘇揚(yáng)州 225127;2.深圳職業(yè)技術(shù)學(xué)院城市水良性循環(huán)工程研發(fā)中心,廣東深圳 518055;3.廣州大學(xué)大灣區(qū)環(huán)境研究院,廣東廣州 510006)
飲用水嗅味問(wèn)題頻繁發(fā)生給人們的生活造成了巨大的影響, 2-MIB和GSM是目前飲用水源中檢測(cè)出的嗅味物質(zhì)[1-2]。研究發(fā)現(xiàn),當(dāng)水體發(fā)生水華時(shí),水體中的2-MIB和GSM濃度高達(dá)1 000 ng/L[3]。《生活飲用水衛(wèi)生標(biāo)準(zhǔn)》(GB 5749—2006)中規(guī)定了2-MIB和GSM的閾值均不能高于10 ng/L[4],目前的常規(guī)水處理工藝對(duì)這2種物質(zhì)的去除效果有限[5]。因此,選擇合適的工藝來(lái)盡可能地去除水中的2-MIB和GSM,對(duì)提高飲用水品質(zhì)至關(guān)重要。近年來(lái),F(xiàn)e2+/PDS體系作為一種新興的高級(jí)氧化方法,在水體中污染物去除方面表現(xiàn)優(yōu)異。用Fe2+/PDS體系去除水中的砷,去除效果良好,去除率可達(dá)到90%[6];用Fe2+/PDS體系降解三氯苯甲醚,降解率較高,可達(dá)到82%[7]。基于Fe2+/PDS體系對(duì)污染物的降解效果,預(yù)測(cè)該體系能有效降解水中的2-MIB和GSM,因此,本試驗(yàn)采用Fe2+/PDS體系降解2-MIB和GSM。
本試驗(yàn)研究了2-MIB和GSM在Fe2+/PDS體系中的降解效果,以及Fe2+/PDS體系降解2-MIB和GSM的活性物質(zhì);考察了Fe2+濃度、PDS濃度、pH對(duì)反應(yīng)體系的影響,以及Fe2+/PDS體系對(duì)實(shí)際水體中2-MIB和GSM的降解效果。
1 試驗(yàn)部分
1.1 試驗(yàn)試劑和儀器設(shè)備
試劑:過(guò)硫酸鈉(Na2S2O8、PDS)、七水合硫酸亞鐵(FeSO4·7H2O)、硫代硫酸鈉(Na2S2O3)、氯化鈉(NaCl)、四亞甲基亞砜(TMSO)、四亞甲基砜(TMSO2)、濃硫酸(H2SO4)、氫氧化鈉(NaOH)、2-MIB和GSM的混標(biāo)液、2-甲氧基-3-異丁基吡嗪(2-isobutyl-3-methoxy pyrazine,IBMP)的標(biāo)準(zhǔn)溶液等均為分析純?cè)噭?gòu)置于上海國(guó)藥集團(tuán);甲醇、乙腈為高效液相色譜純,購(gòu)置于阿拉丁網(wǎng)站;試驗(yàn)用水均為Mill-Q超純水。
儀器:氣質(zhì)聯(lián)用儀(7890BGC-5977BMS);Waters7980高效液相色譜(美國(guó)Waters公司);SHZ-B型水浴恒溫振蕩器(上海躍進(jìn)醫(yī)療器械有限公司);ME204E電子天平[梅特勒-托利多儀器(上海)有限公司]; pH7310型pH計(jì)(廈門隴力德環(huán)境技術(shù)開(kāi)發(fā)有限公司)。
1.2 試驗(yàn)方法
取已知濃度的2-MIB和GSM的混標(biāo)液于1 L的錐形瓶中稀釋至500 mL,確保反應(yīng)體系中的2-MIB和GSM的濃度為1 000 ng/L,用5 mmol/L H2SO4和5 mmol/L NaOH調(diào)節(jié)至需要的pH,依次加入計(jì)算濃度的過(guò)硫酸鈉(PDS)和硫酸亞鐵(FeSO4)開(kāi)始反應(yīng),反應(yīng)在水浴恒溫振蕩器中進(jìn)行。反應(yīng)時(shí)間為2 h,于0、5、15、30、60、90、120 min時(shí)取樣,加入到含有6 g NaCl和200 ng/L的內(nèi)標(biāo)液IBMP的棕色樣品萃取瓶中,再加入適量濃度的Na2S2O3作為終止劑,終止反應(yīng)。
1.3 檢測(cè)方法
1.3.1 固相微萃取(solid phase microextration,SPME)操作方法
2-MIB和GSM采用固相微萃取的方法進(jìn)行測(cè)定。在萃取前先將固相微萃取膜在GC/MS進(jìn)樣口250 ℃進(jìn)行老化,第一次使用老化30 min,非第一次使用老化5 min。向40 mL棕色頂空瓶中加入25 mL水樣,內(nèi)標(biāo)IBMP濃度為200 ng/L,然后加入6 g在200 ℃烘干2 h的NaCl,將頂空瓶放置在磁力攪拌器上進(jìn)行攪拌和加熱,溫度維持在(60±1) ℃,轉(zhuǎn)速為200 r/min。萃取30 min后,使用GC/MS進(jìn)行檢測(cè)分析。
1.3.2 GC/MS檢測(cè)條件
GC條件:載氣為高純氦氣(99.999%),柱中流速為1 mL/min,不分流進(jìn)樣;初始柱溫為60 ℃,保持3 min,以6 ℃/min升溫至150 ℃,再以15 ℃/min升溫至250 ℃,保持3 min;進(jìn)樣口溫度為250 ℃。
MS條件:離子源溫度為200 ℃;接口溫度為250 ℃。
1.3.3 TMSO和TMSO2的HPLC檢測(cè)方法
C18色譜柱(4.6 mm×250 mm;5 μm),流動(dòng)相為V(乙腈)∶V(水)=60∶40,紫外檢測(cè)波長(zhǎng)為212 nm,流速為1 mL/min,進(jìn)樣量為100 μL。
1.3.4 甲醛的檢測(cè)方法
甲醛濃度的測(cè)定采用乙酰丙酮法[8]。
2 結(jié)果與討論
2.1 Fe2+/PDS體系降解2-MIB與GSM的效果
為了考察Fe2+/PDS體系對(duì)2-MIB和GSM的降解效果,開(kāi)展了單獨(dú)的Fe2+、單獨(dú)的PDS及Fe2+/PDS降解2-MIB和GSM的試驗(yàn)。由于2-MIB和GSM為易揮發(fā)的嗅味物質(zhì),設(shè)置了空白試驗(yàn),2-MIB和GSM的轉(zhuǎn)化率分別為7.41%和5.52%,結(jié)果如圖1和圖2所示。在pH值為3、Fe2+和PDS的濃度均為1.0 mmol/L、溫度為25 ℃的條件下,反應(yīng)體系中單獨(dú)投加PDS及單獨(dú)投加Fe2+對(duì)2-MIB和GSM的降解效果不佳,2-MIB的降解率為7.41%、7.93%和6.88%,GSM的降解率為5.52%、5.97%和5.06%。利用Fe2+活化PDS的高級(jí)氧化體系中2-MIB的降解率可以達(dá)到99.10%,GSM的降解率達(dá)到83.08%。相比于空白及單獨(dú)投加Fe2+或者PDS,降解率明顯大幅度提高,因此,F(xiàn)e2+/PDS體系具有應(yīng)用于實(shí)際水體處理的潛力。
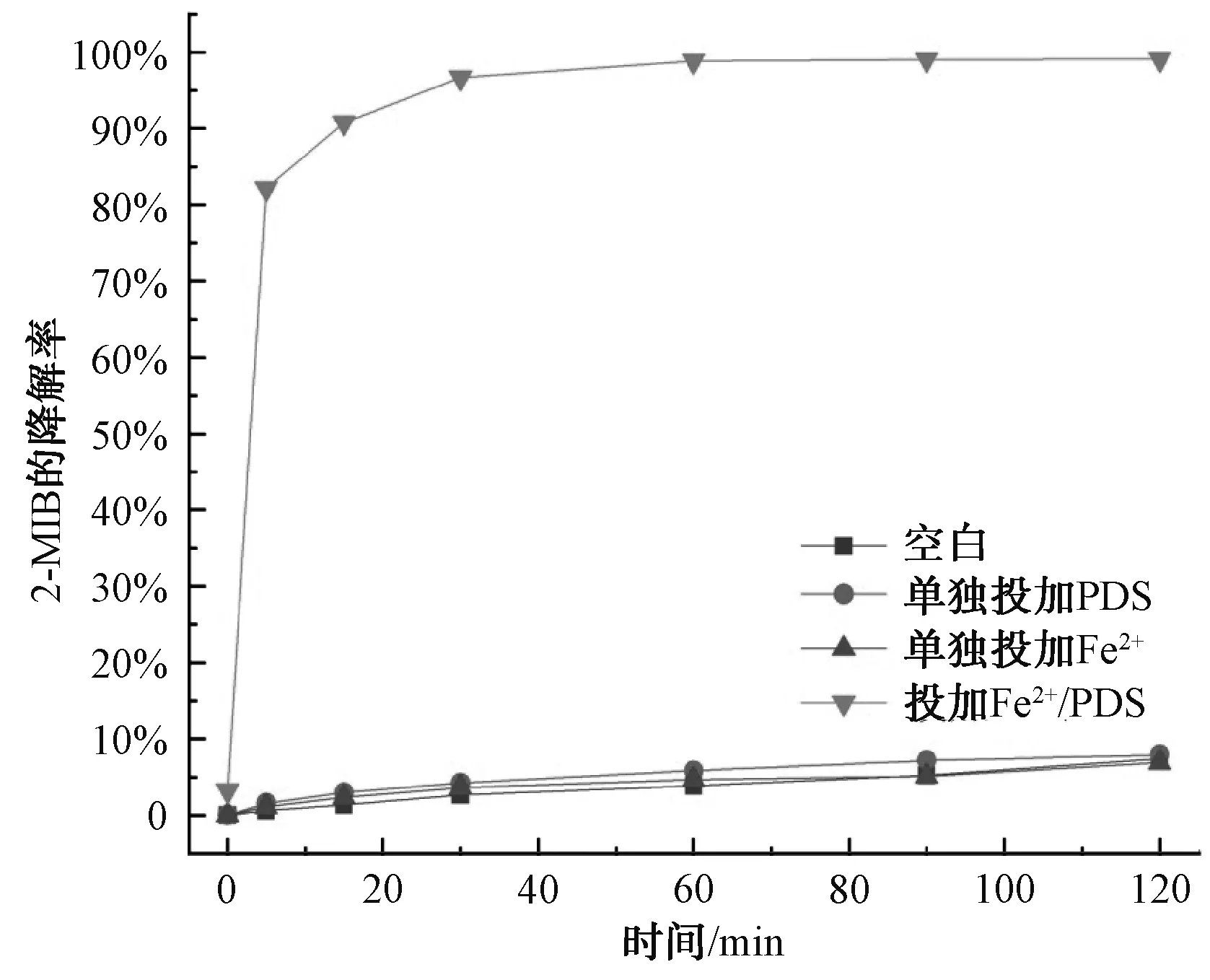
圖1 2-MIB的降解效果對(duì)比Fig.1 Comparison of Effects of 2-MIB Degradation
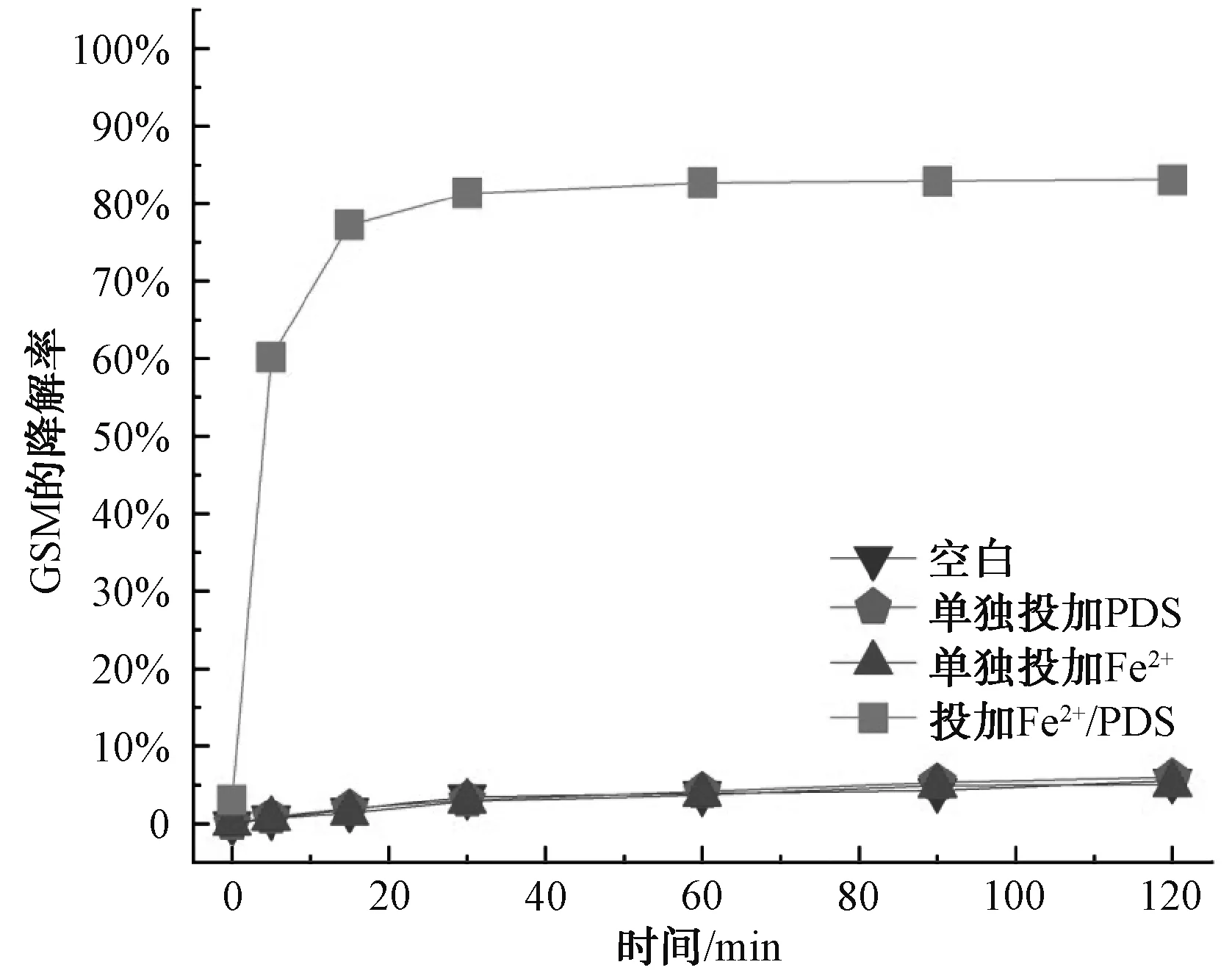
圖2 GSM的降解效果對(duì)比Fig.2 Comparison of Effects of GSM Degradation
2.2 Fe2+/PDS體系反應(yīng)機(jī)理
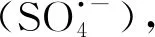
(1)
(2)
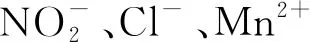
(3)
(4)
(5)
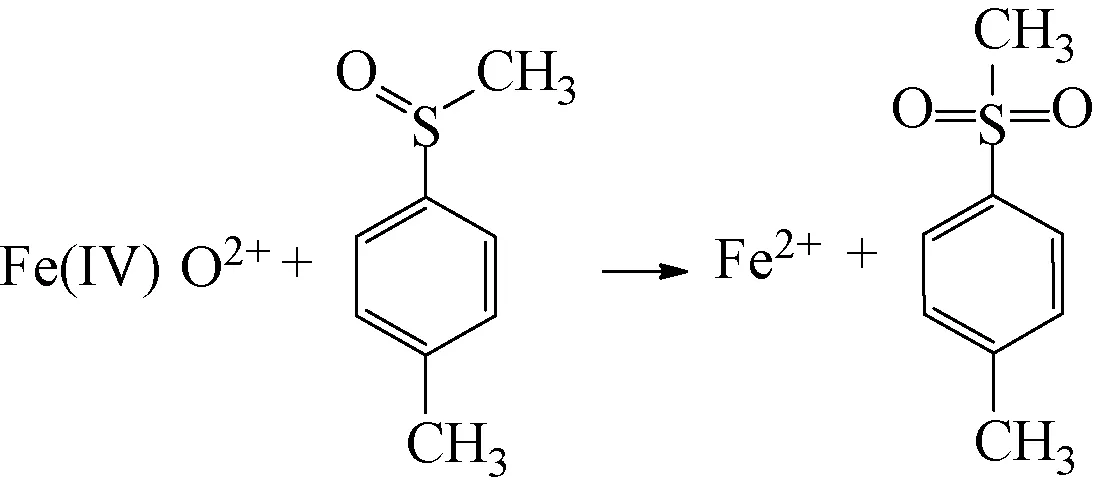
為了確定Fe2+/PDS體系降解2-MIB和GSM中產(chǎn)生的活性物質(zhì),采用如下試驗(yàn)方法:在pH值為3.0、Fe2+和PDS的濃度均為1.0 mmol/L、溫度為25 ℃的條件下,向體系中加入TMSO作為目標(biāo)物,利用超高效液相色譜檢測(cè)其體系中的TMSO和TMSO2的含量,結(jié)果如圖3所示。由圖3可知,反應(yīng)過(guò)程中減少的TMSO的數(shù)量與產(chǎn)生的TMSO2的數(shù)量幾乎完全相等,且在整個(gè)反應(yīng)過(guò)程中甲醛的濃度始終為零,檢測(cè)結(jié)果與Wang等[9]觀點(diǎn)一致。因此,在Fe2+/PDS體系降解2-MIB和GSM中產(chǎn)生的活性物質(zhì)是Fe(Ⅳ)。
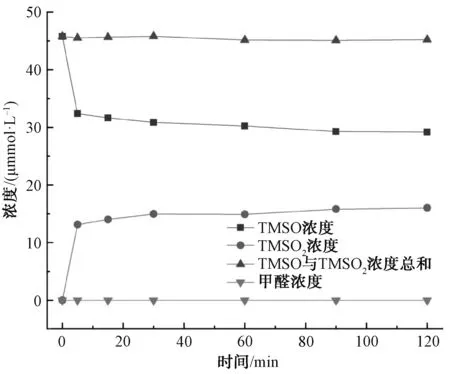
圖3 Fe2+/PDS反應(yīng)過(guò)程中TMSO與TMSO2濃度的變化Fig.3 Effects of Concentrations Change on TMSO and TMSO2 in Fe2+/PDS System
2.3 Fe2+濃度對(duì)試驗(yàn)的影響
在2-MIB和GSM濃度為1 000 ng/L、PDS為1.0 mmol/L、pH值為3.0、溫度為25 ℃的條件下,考察投入體系中的不同濃度Fe2+(0.0、0.125、0.25、0.50、1.0、1.5、2.0 mmol/L)時(shí),對(duì)2-MIB和GSM降解率的影響。由圖4可知,單獨(dú)的PDS在本研究的時(shí)間范圍內(nèi)無(wú)法降解2-MIB和GSM。隨著Fe2+濃度從0.125 mmol/L增加到1.0 mmol/L,2-MIB的降解率從75.23%增加至99.10%,GSM的降解率從52.31%增加至83.08%,此時(shí)2-MIB和GSM的降解效果最好。而隨著Fe2+濃度的繼續(xù)增加,2-MIB和GSM的降解率呈現(xiàn)逐步下降的趨勢(shì),2-MIB和GSM的降解率分別下降至75.7%和67.9%,其原因是過(guò)量的Fe2+與2-MIB和GSM競(jìng)爭(zhēng)體系中的活性物質(zhì)四價(jià)鐵[Fe(Ⅳ)],過(guò)量的的Fe2+與Fe(Ⅳ)發(fā)生反應(yīng)產(chǎn)生Fe3+,如式(6)[9]。
Fe(Ⅳ)O2++Fe2+(+2H+)→2Fe3++2H2O
(6)
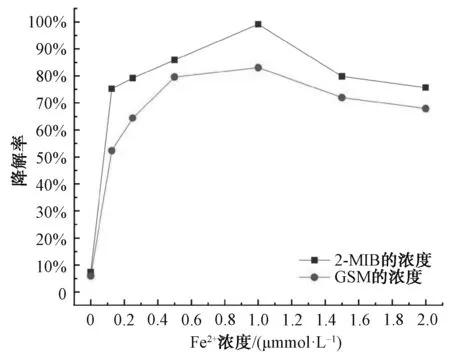
圖4 Fe2+濃度對(duì)2-MIB和GSM降解率的影響Fig.4 Effect of Fe2+ Concentration on Degradation Rate of 2-MIB and GSM
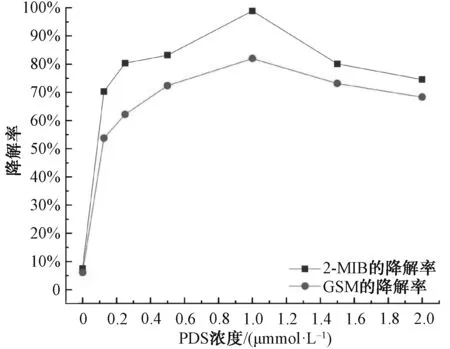
圖5 PDS濃度對(duì)2-MIB和GSM降解率的影響Fig.5 Effects of PDS Concentration on Degradation Rates of 2-MIB and GSM
2.4 PDS濃度對(duì)試驗(yàn)的影響
在2-MIB和GSM初始濃度為1 000 ng/L、Fe2+濃度為1.0 mmol/L、不同濃度PDS (0.0、0.125、0.25、0.50、1.0、1.5、2.0 mmol/L),pH值為3、溫度為25 ℃的條件下,考察投入體系的PDS濃度對(duì)2-MIB和GSM的降解率的影響情況。由圖5可知,單獨(dú)的Fe2+在本研究的時(shí)間范圍內(nèi)無(wú)法降解2-MIB和GSM。隨著PDS濃度從0.125 mmol/L增加到1.0 mmol/L,2-MIB的降解率從70.29%增加至99.10%,GSM的降解率從70.29%增加至83.08%,此時(shí)2-MIB和GSM的降解效果最好。隨著PDS濃度的增加,2-MIB和GSM的降解率呈現(xiàn)出先增加后降低的趨勢(shì),其原因是過(guò)量的PDS也會(huì)與2-MIB和GSM競(jìng)爭(zhēng)體系中的活性物質(zhì)高價(jià)鐵Fe(Ⅳ)[9]。因此,2-MIB和GSM的降解率隨著PDS濃度的增加而降低。
2.5 pH對(duì)試驗(yàn)的影響
Fe2+/PDS體系的初始pH對(duì)降解2-MIB和GSM有重要影響。在2-MIB和GSM的初始濃度為1 000 ng/L、PDS和Fe2+的濃度均為1.0 mmol/L、溫度為25 ℃的條件下,研究pH值為2.0、3.0、5.0、7.0、10.0條件下2-MIB和GSM的降解率變化情況。由圖6可知,隨著pH的增大,降解率呈現(xiàn)出先上升后下降的趨勢(shì),在pH值=3.0時(shí),2-MIB和GSM的降解率最高,2-MIB和GSM降解率分別為99.10%和83.08%。因此,2-MIB和GSM的降解效果在pH值=3.0的條件下,試驗(yàn)效果最優(yōu),中性條件次之,堿性條件效果最差。這是因?yàn)樵谥行院蛪A性的條件下,F(xiàn)e2+易發(fā)生水解沉淀,參與Fe2+/PDS的有效Fe2+濃度降低,2-MIB和GSM的降解率受影響而降低。
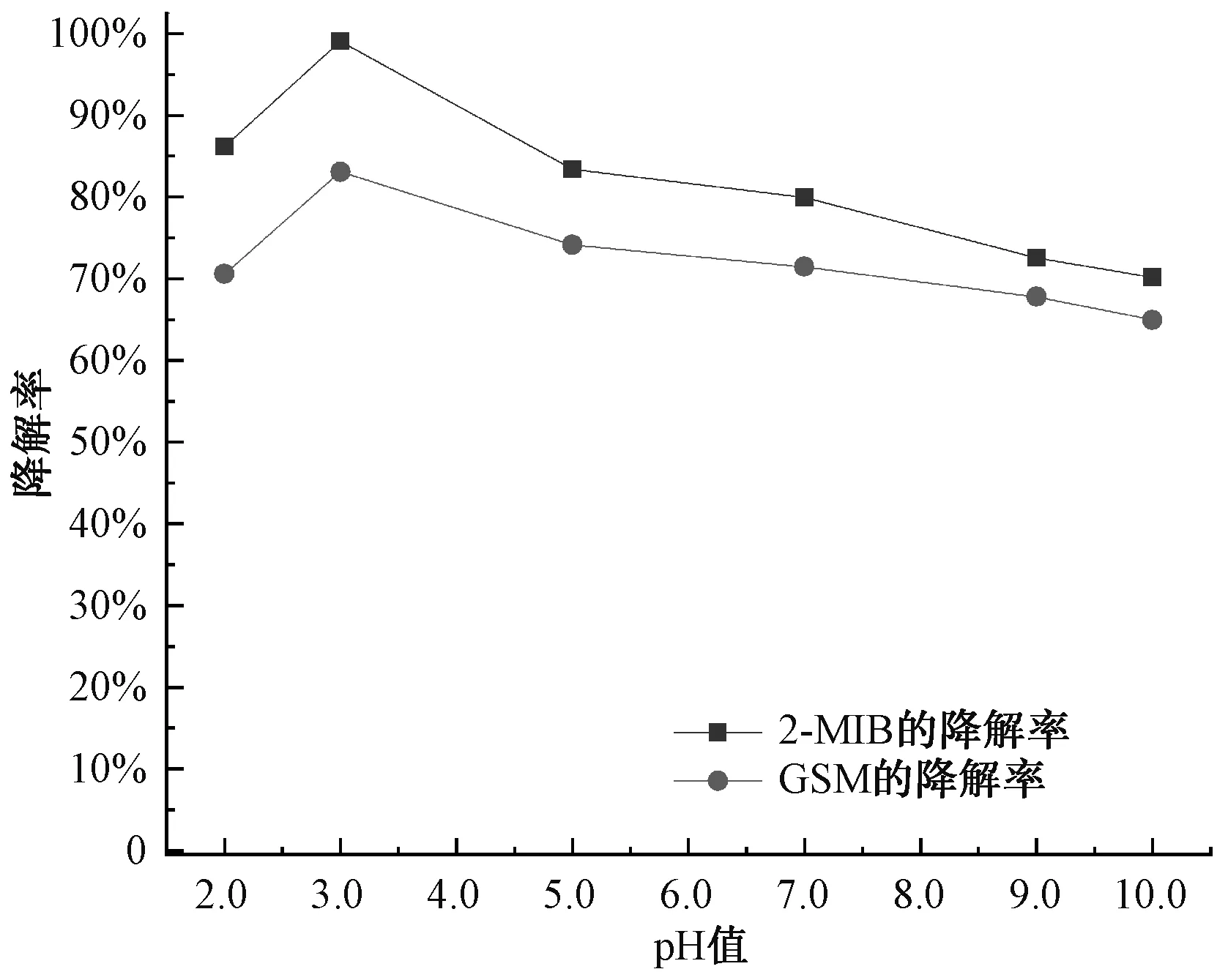
圖6 pH對(duì)2-MIB和GSM降解率的影響Fig.6 Effect of pH Values on Degradation Rates of 2-MIB and GSM
綜上,在pH值=3、Fe2+和PDS濃度均為1.0 mmol/L、溫度為25 ℃的條件下,2-MIB和GSM的降解效果最佳。如圖7所示,前15 min反應(yīng)速率較快,2-MIB和GSM在15 min時(shí)降解率分別為90.75%和77.22%,15 min后反應(yīng)趨于平緩,速率較慢。同時(shí),在反應(yīng)過(guò)程中監(jiān)測(cè)Fe2+的濃度變化情況,結(jié)果如圖8所示。Fe2+在前10 min反應(yīng)速率較快且濃度變化較大,10 min后體系中Fe2+濃度較低且逐漸趨于0。體系中的95%的Fe2+在前10 min被轉(zhuǎn)化為Fe(Ⅳ)。因此,2-MIB和GSM在前15 min降解速率較快。
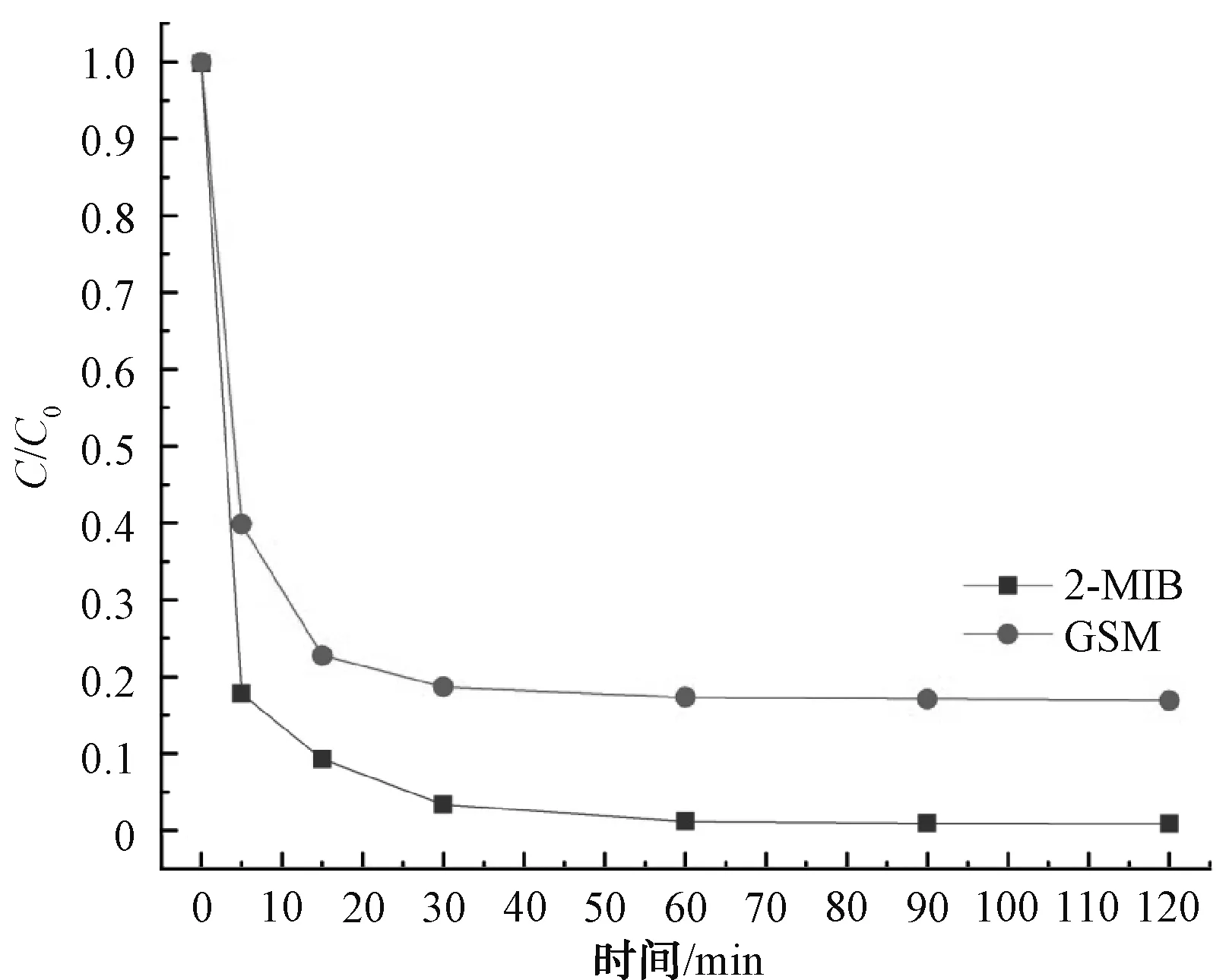
圖7 最佳條件下2-MIB和GSM的降解率隨時(shí)間變化趨勢(shì)Fig.7 Trends of Degradation Rates of 2-MIB and GSM over Time under Optimal Conditions
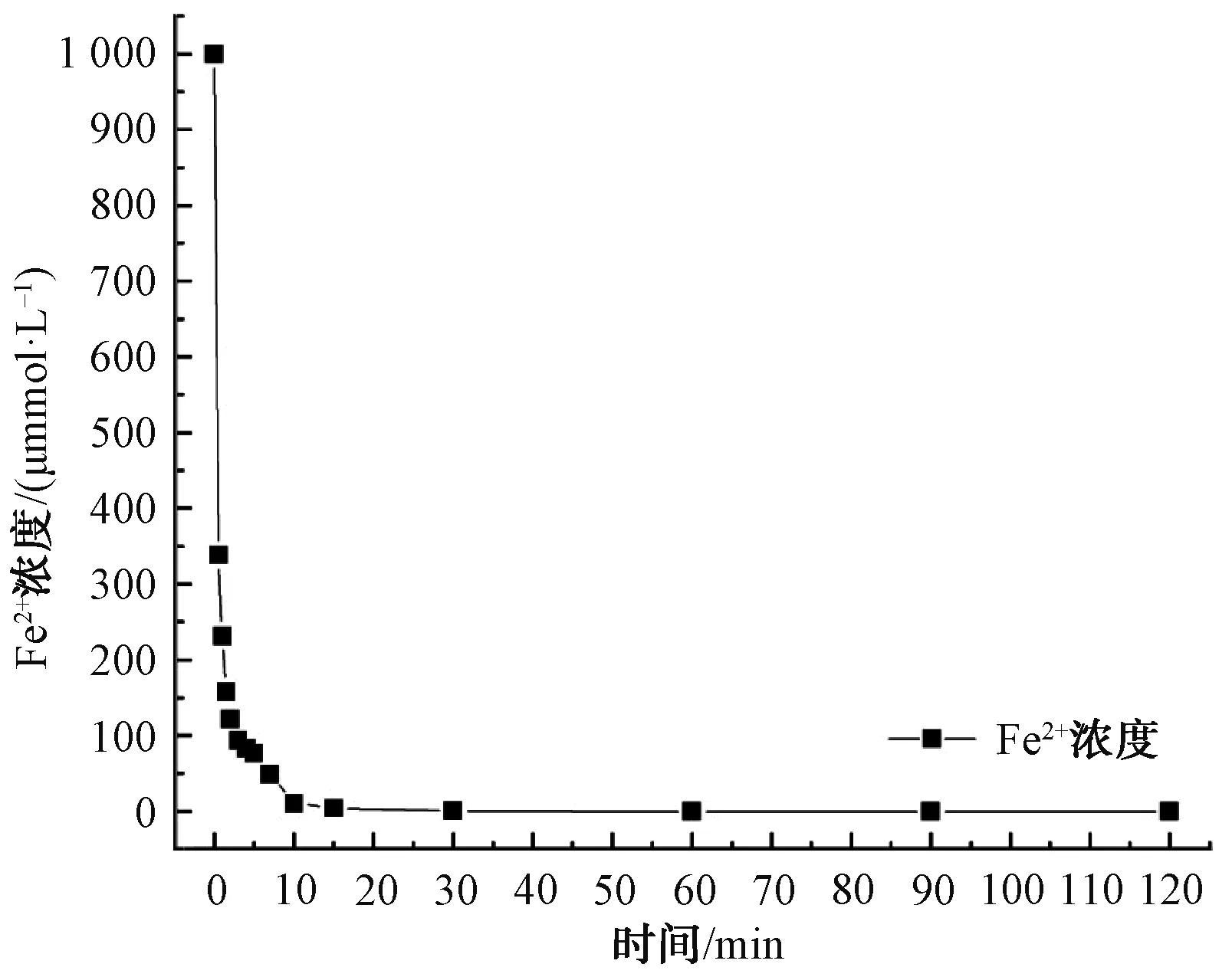
圖8 Fe2+的濃度隨時(shí)間的變化曲線Fig.8 Curve of Fe2+ Concentration Versus Time
2.6 Fe2+/PDS體系對(duì)實(shí)際水體中2-MIB和GSM的去除
經(jīng)過(guò)上述研究,F(xiàn)e2+/PDS體系去除水中的2-MIB和GSM的效果良好,因此,采用該體系降解實(shí)際水體中的2-MIB和GSM。水樣取自深圳某水庫(kù),其中2-MIB和GSM濃度分別為13.68 ng/L和3.61 ng/L,pH值為7.8。Fe2+/PDS體系在原pH的條件下處理水庫(kù)水,2-MIB和GSM的降解率分別為75.64%和69.47%,濃度分別為3.33 ng/L和0.80 ng/L。而在pH值為3.0,PDS和Fe2+的濃度均為1.0 mmol/L、溫度為25 ℃的條件下,研究Fe2+/PDS體系對(duì)該水庫(kù)水中2-MIB和GSM的降解效果。如圖9所示,15 min前降解速率較快,2-MIB和GSM的降解率分別為95.4%和70.51%,反應(yīng)結(jié)束時(shí)2-MIB的濃度為0.135 ng/L,降解率為99.01%,GSM的濃度為0.721 ng/L,降解率為80.03%。因此,pH值=3.0時(shí)Fe2+/PDS體系對(duì)該水庫(kù)水中2-MIB和GSM的降解效果更好。
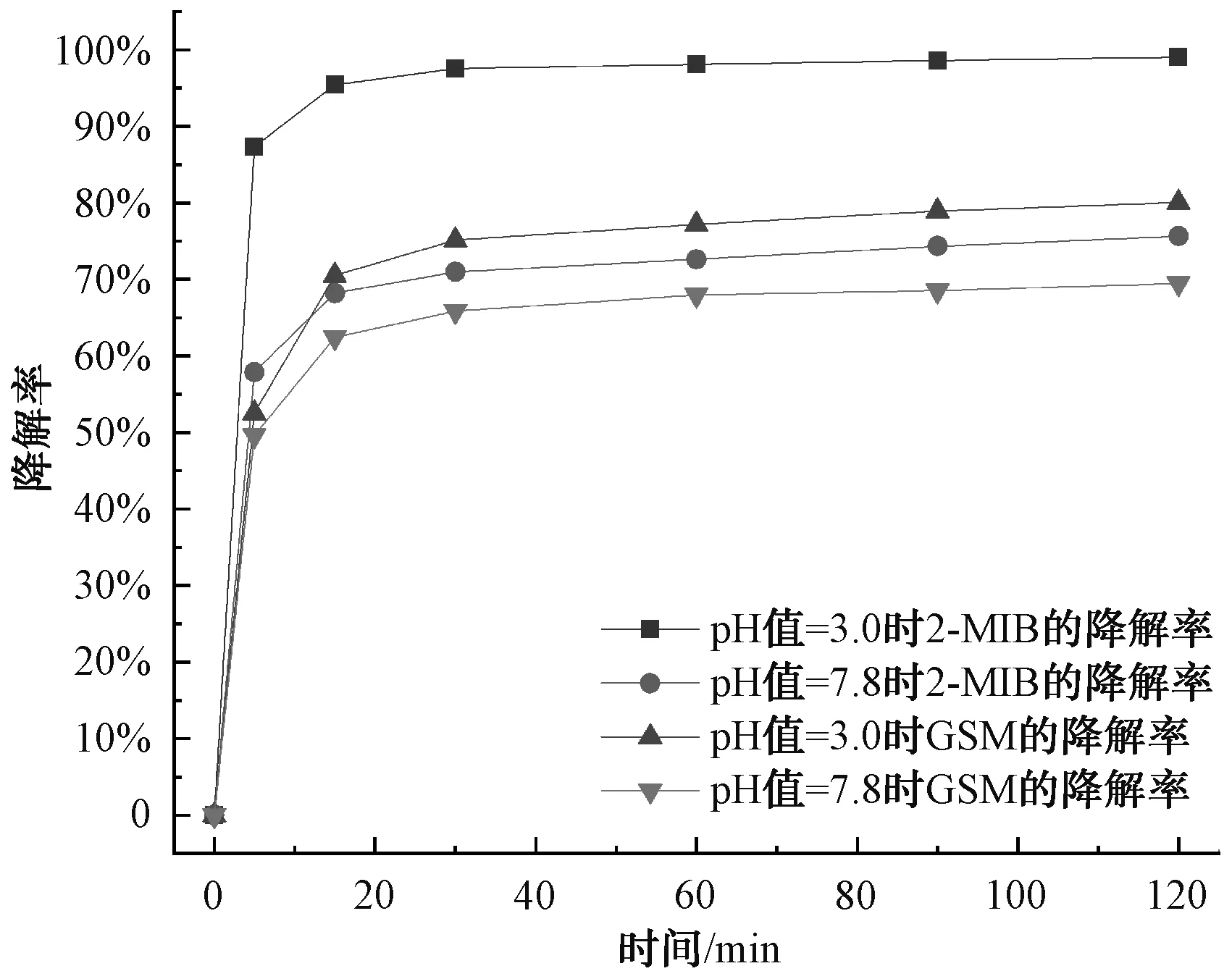
圖9 Fe2+/PDS對(duì)水庫(kù)水中2-MIB和GSM的降解效果Fig.9 Degradation of 2-MIB and GSM in Reservoir Water by Fe2+/PDS
3 結(jié)論
(1)Fe2+/PDS體系在pH值=3.0、Fe2+和PDS濃度均為1.0 mmol/L、溫度為25 ℃的最優(yōu)條件下, 2-MIB和GSM的降解率可達(dá)到99.10%和83.08%。且該體系能應(yīng)用于實(shí)際水體,pH值=3.0條件下降解效果良好,2-MIB和GSM的降解率分別為99.01%和80.03%,因此,該體系具有較好的應(yīng)用前景。
(2)Fe2+/PDS體系在pH值=3.0條件下,2-MIB和GSM的處理效果最佳。因此,pH值=3.0的條件下,2-MIB和GSM的降解率最高。
(3)隨著Fe2+和PDS濃度的增加,2-MIB和GSM的降解率呈現(xiàn)出先增加后降低的趨勢(shì),兩者最佳濃度比為Fe2+∶PDS=1∶1,最佳濃度均為1.0 mmol/L。