HPSEC-UV-TOC聯用技術操作條件對有機物分子量分布測定的影響
夏慶艷,王 琳,陳天宇,李志浩,武道吉
(山東建筑大學市政與環境工程學院,山東濟南 250101)
作為評價膜污染的指標[1],分子量分布常由2種方法測得:一種是超濾膜法,但溶質易被截留,且精度不高;另一種方法是凝膠色譜法,但只能測定有紫外響應的有機物,不能測定多糖等含碳單鍵的有機物。國外發展了一種新型凝膠色譜法(high performance size exclusion chromatography,HPSEC)[2],此方法需在凝膠色譜的基礎上串聯紫外(UV)檢測器,最后串聯總有機碳(TOC)檢測儀,被稱作HPSEC-UV-TOC聯用技術。紫外檢測器能夠檢測含苯環及碳碳雙鍵等不飽和有機物,TOC檢測儀可以檢測含碳單鍵和無苯環物質[2-3]。這種方法能夠較易測定天然有機物(natural organic matter,NOM)相對分子量的大小,所得到的分子量分布圖連續,能夠更加真實客觀地反映NOM的物化性質。近年來,國內已經新引進這種聯用技術,并在水處理理論與技術研究中得到初步應用[4-8,14]。
本研究主要考察pH、離子強度、樣品配置溶液等運行條件對HPSEC-UV-TOC聯用技術測定葡聚糖T1分子量分布的影響,同時,將優化條件用于測定黃河原水及其親疏水組分中有機物的分子量分布,從而完善該聯用技術在飲用水地表水源不同有機物組分研究中的應用。
1 材料與方法
1.1 試驗材料
本試驗采用的試劑為國藥集團化學試劑有限公司生產的分子量為1 000的葡聚糖(dextran,T1),如圖1所示。葡聚糖T1屬于小分子親水性有機物,無芳香度,較為符合國內地表原水中主要分子量分布的特征[9-10]。試驗原水采用黃河水庫原水,該原水濃縮后經XAD-8(北京康林科技有限責任公司)、XAD-4(美國Sigma公司)和IRA958樹脂(美國Sigma公司)分離得到強疏、弱疏、極親、中親4種組分。鹽酸溶液和NaOH(5 mol/L)用于調節pH,采用NaCl(國藥集團化學試劑有限公司)調節離子強度(IS)。如果沒有特別注明,試驗中使用的試劑純度均為分析純,溶液采用超純水(Milli-Q plus超純水機)配制。
圖1 葡聚糖T1分子結構圖Fig.1 Molecular Structure of Dextran T1
1.2 試驗儀器
沃特世(Waters)Alliance系列e 2695型凝膠色譜儀;Waters 2489型UV-VIS檢測器;Sievers M9總有機碳(TOC)檢測器;Empower 3色譜軟件。
1.3 色譜條件
試驗采用的凝膠色譜柱型號是TSK gel G3000 PWXL(7.8 mm×30 cm,填料為聚甲基丙烯酸酯),色譜柱之前串聯保護柱型號是TSK-GEL TSK guard column PWXL(6.0 mm×4.0 cm)。 流動相采用Na2SO4(0.02 mol/L),KH2PO4(0.05 mol/L)和NaOH(0.03 mol/L)的混合溶液。
如無特殊說明,凝膠色譜柱的流速為0.5 mL/min,柱溫采用40 ℃,UV檢測器在254 nm處測定樣品, 進樣體積為100 μL,測樣時間為35 min,試驗所用水樣均用Milli-Q超純水配制完成。
1.4 方法原理
高效凝膠色譜主要工作原理是根據溶解性有機物的尺寸進行分離,分子量較大的有機物不能進入凝膠孔隙,會首先流出,分子量小的有機物后流出,因此,能夠繪制出不同分子量隨時間t的變化曲線。樣品隨后依次經過UV-VIS檢測器和TOC檢測器,在Empower 3軟件上每秒自動記錄2個數據,以體積V(或時間t)為橫軸,繪制出UV和TOC信號隨體積V(或時間t)的變化曲線。圖2為該聯用技術示意圖。
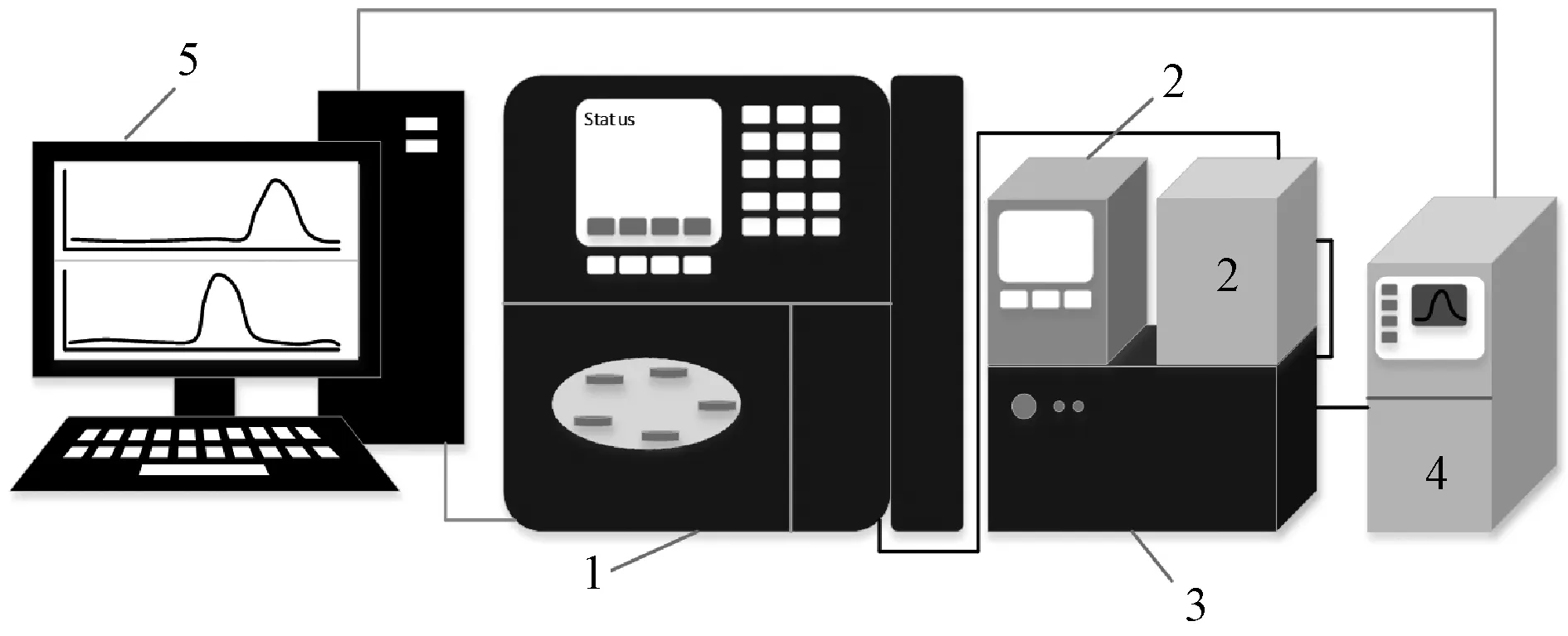
注:1-Waters e 2695型凝膠色譜儀;2-色譜柱柱溫箱(右)和溫控箱(左);3-Waters 2489 UV-VIS檢測器;4-Sievers M9 Portable TOC檢測器;5-臺式電腦圖2 HPSEC-UV-TOC聯用技術示意圖Fig.2 Schematic Diagram of HPSEC-UV-TOC System
2 結果與討論
2.1 校正曲線
凝膠色譜測定的是有機物的相對分子質量,因此,需使用已知分子量、物化性質與所測樣品相近的標準品來對試驗結果進行校正,得到標準曲線,本試驗采用寬分布標樣校正法。
前期試驗結果顯示,NOM與聚苯乙烯磺酸鈉(sodium polystyrene sulfonate,PSS)的性質相似。本試驗選取的是相對分子質量為210、4 300、6 800、17 000、32 000的PSS標準品,作lgMw-t半對數曲線(圖3),采用三階擬合,如式(1)~式(2)。
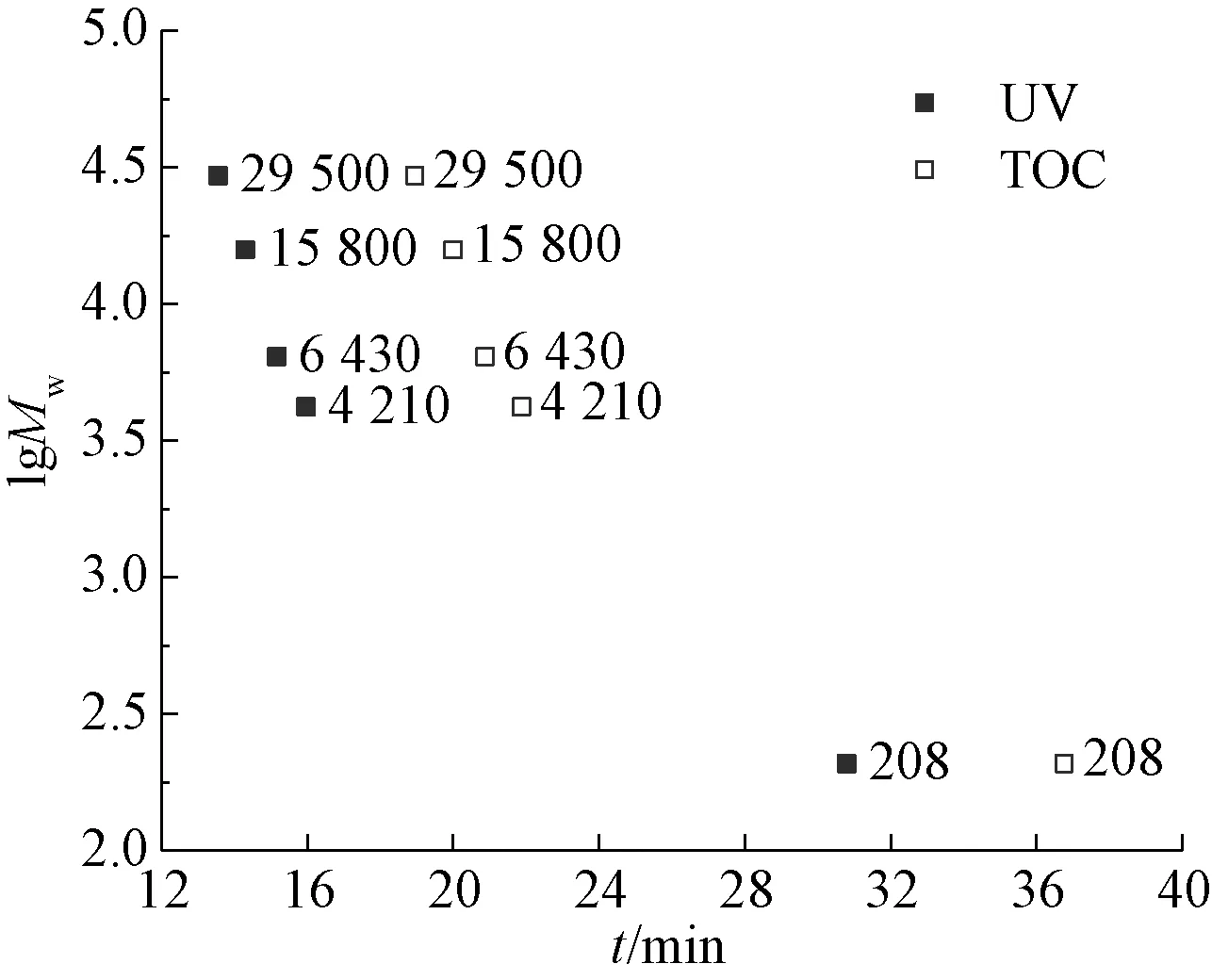
圖3 lgMw與峰值保留時間t的關系Fig.3 UV and TOC Curves of lgMw and Peak Time t
AMWUV=10(S-2.665 89t+0.114 13t2-0 .001 63t3 )
(1)
R2=0 .995 05
AMWTOC= 10(S-1 .309 56t+0.033 31t2-0.000 277 4t3)
(2)
R2=0.987 57
其中:AMWUV——UV254響應峰所對應的相對分子量;
AMWTOC——TOC響應峰所對應的相對分子量;
t——峰值保留時間,min;S——常數。
2.2 TOC響應值與濃度的關系
Empower 3軟件上采集到的TOC數據不是所測樣品的準確濃度,而是電信號(mV),因此,需使用標準濃度的樣品進行線性擬合,得到mV對應mg/L的對應關系曲線。如圖4所示,R2=0.999 34,表明電信號(mV)與TOC(mg/L)相關性很強。
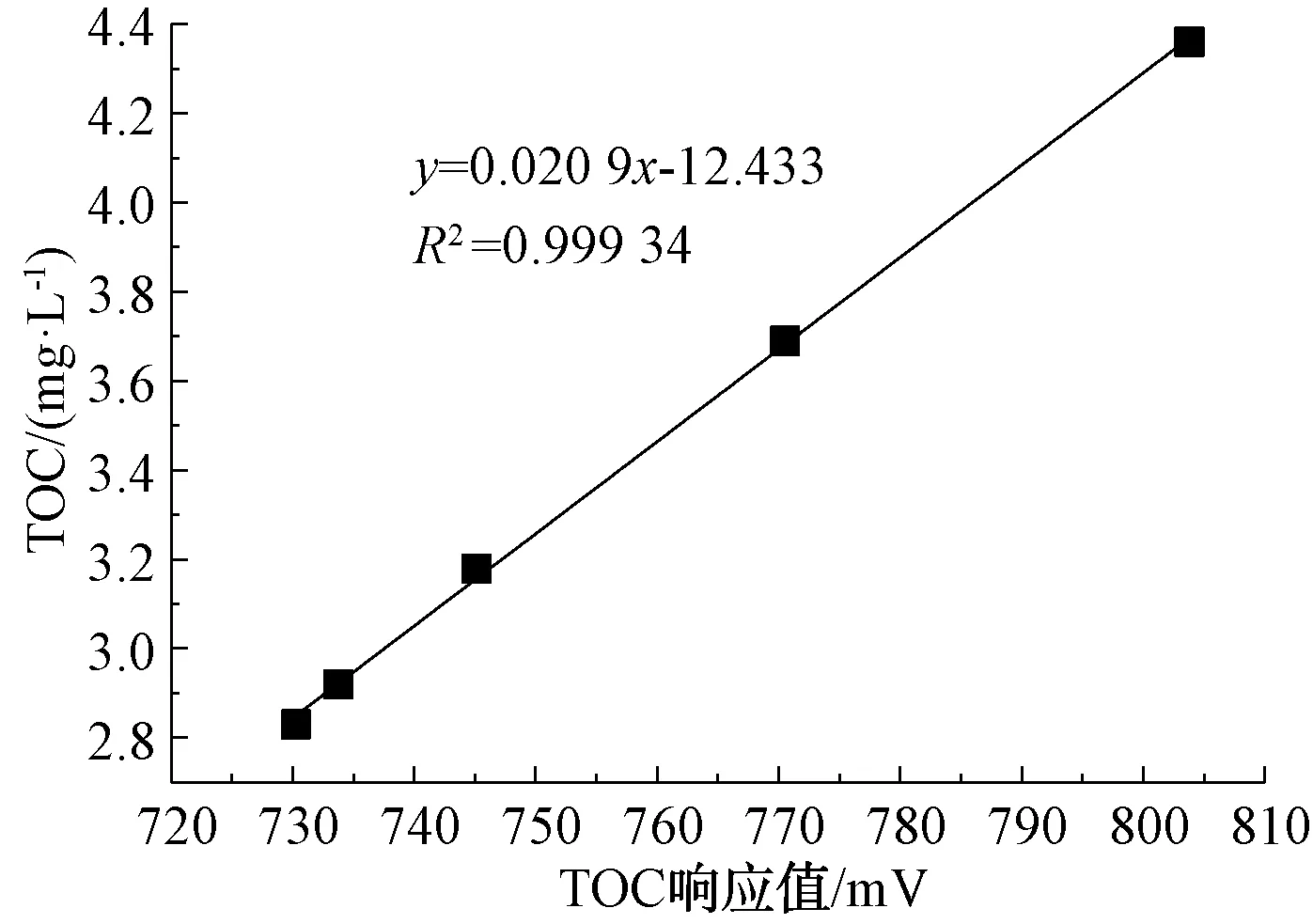
圖4 TOC濃度與響應值關系曲線Fig.4 Correlation Curves between TOC Concentration and TOC Response Value
2.3 pH的影響
根據色譜柱的耐受pH值范圍(2~12),將20 mg/L的葡聚糖T1溶液的pH值分別調節為3、5、7、9、11,以考察pH對樣品測定的影響,結果如圖5和表1所示。葡聚糖屬于親水性有機物,無法被傳統的HPSEC-UV檢測到,因而UV沒有明顯響應。由TOC測定結果可知,TOC響應峰寬一致,峰面積相近(表1),說明pH對葡聚糖T1的分子量測定影響較小。這與張晗等[11]的研究結果不同,可能是因為本試驗TOC檢測儀中H3PO4的投加量采用最大投加量2.0 μL/min,能夠充分酸化樣品中的無機碳,因此,在堿性條件下也能使樣品分子量分布的TOC測定結果正常。
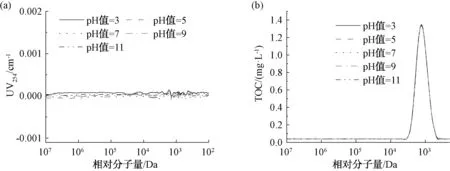
圖5 不同pH值條件下的UV和TOC響應Fig.5 Effect of pH Values on UV and TOC Responses
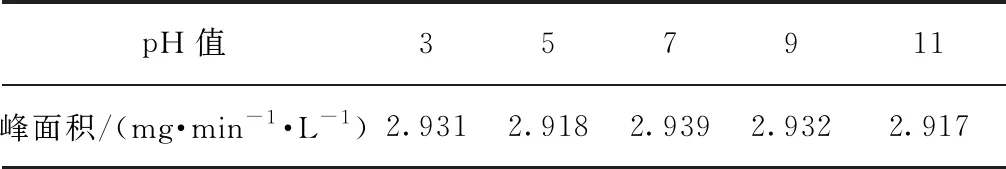
表1 不同pH值條件下的TOC峰面積Tab.1 Peak Areas of TOC under Different pH Values
2.4 離子強度的影響
以0~0.4 mol/L NaCl溶液考察離子強度(IS)對樣品測定結果的影響,樣品采用20 mg/L葡聚糖T1進行測定。結果如圖6、表2、表3所示。由圖6(a)可知,離子強度越高,紫外響應越高,表明離子強度對測定有機物相對分子質量分布有一定的影響。這可能是由于有機物在固定相中的吸附作用[12],或者是由于有機物隨洗脫液離子強度的變化而發生了構象變化[13]。
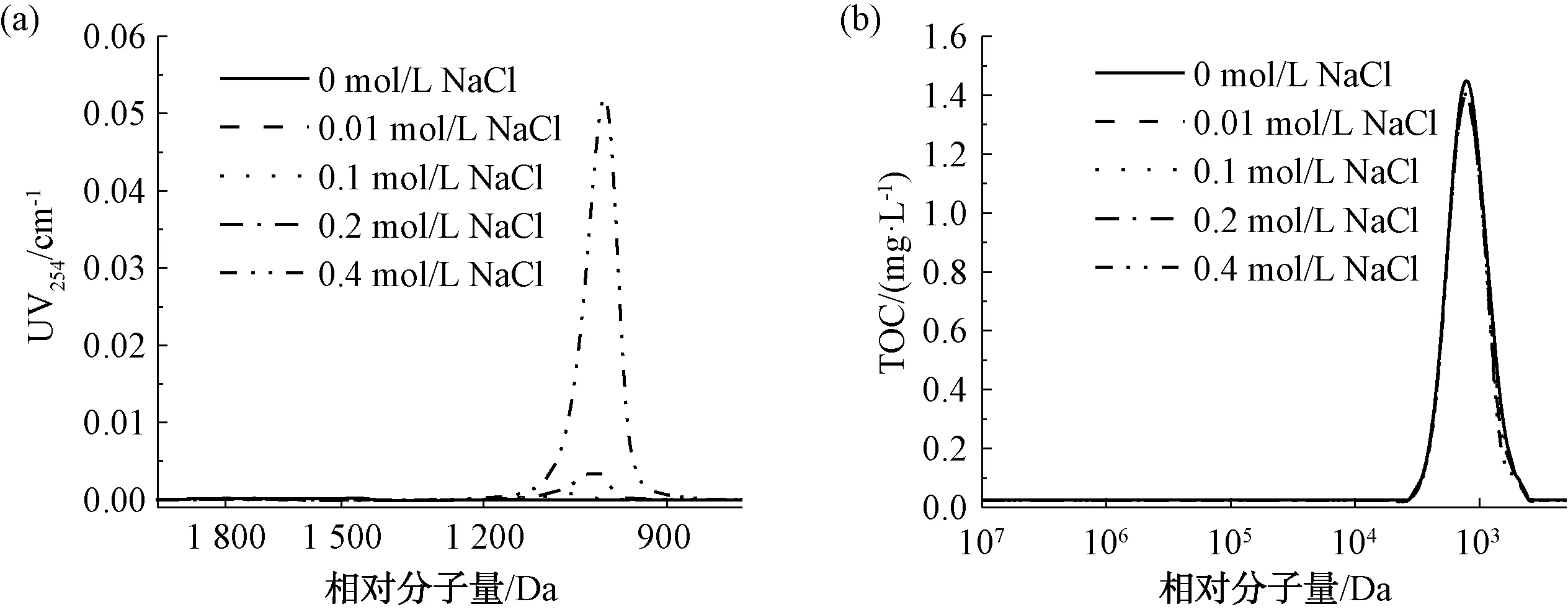
圖6 不同離子強度條件下的UV和TOC響應Fig.6 Effects of Different Ionic Strengths on UV and TOC Responses

表2 不同離子強度條件下的UV出峰時間Tab.2 Elution Time of UV under Different Ionic Strengths
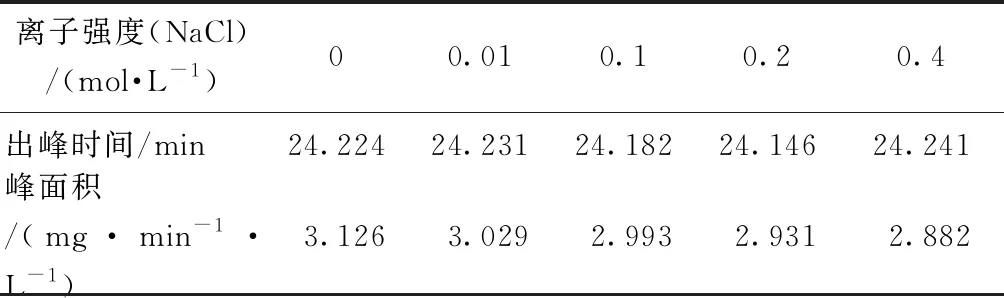
表3 不同離子強度條件下的TOC出峰時間和峰面積Tab.3 Elution Time and Peak Areas of TOC under Different Ionic Strengths
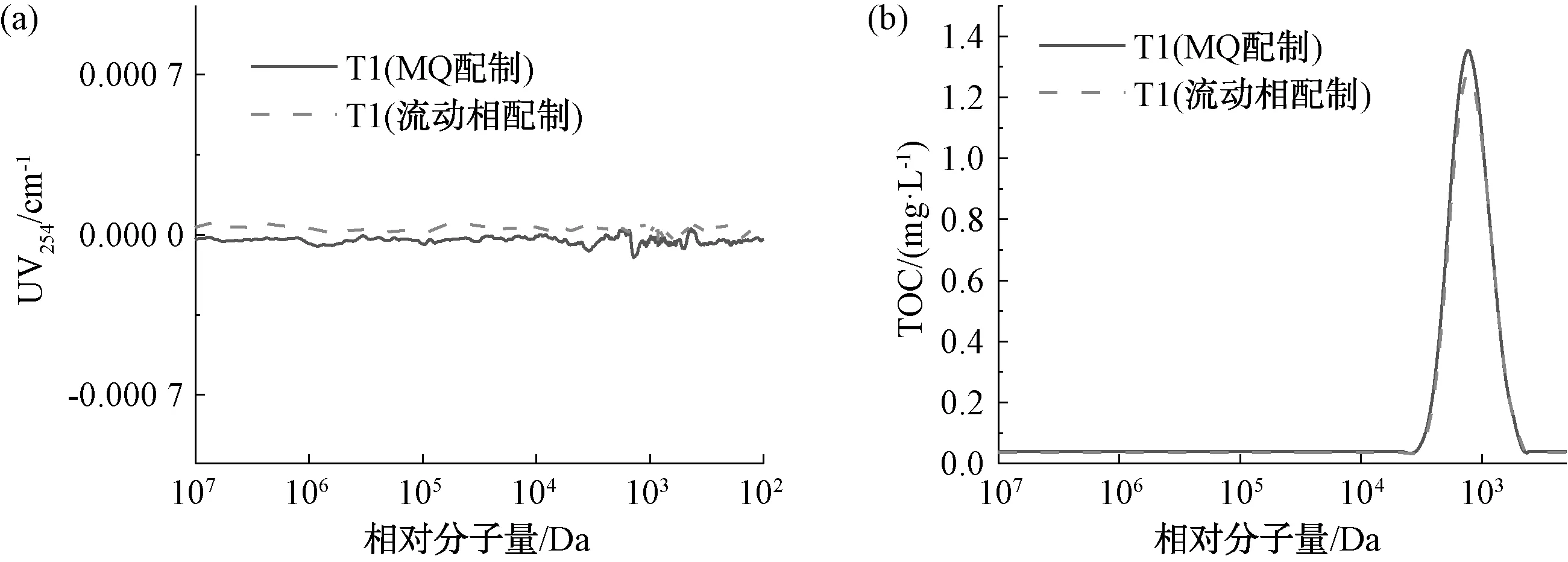
圖7 不同樣品配制溶液條件下的UV和TOC響應Fig.7 UV and TOC Peaks under Different Sample Solvents
由表2可知,離子強度從0.01 mol/L增加到0.4 mol/L NaCl,出峰時間依次增加,說明向測樣中加入鹽會導致樣品被色譜柱延遲,分子量分布圖偏移,測定結果偏小。這與Hine等[12]的研究結果相似,原因可能是離子強度會增強吸附作用,影響污染物在凝膠色譜柱中的遷移,從而導致不準確的分子量分布。
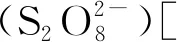
(3)
TOC + HClO → TOX + H2O
(4)
2.5 測試樣配制溶液的影響
圖7和表4為20 mg/L 的葡聚糖T1溶于超純水和流動相后的測定結果。如圖7(b)所示,用流動相配制的葡聚糖T1的TOC峰高略小于用超純水配制的樣品。兩者峰寬基本一致,出峰時間相同,說明配樣溶液與色譜柱的甲基丙烯酸酯填料之間相互作用小,因此,配樣溶液對測定結果的影響較小。
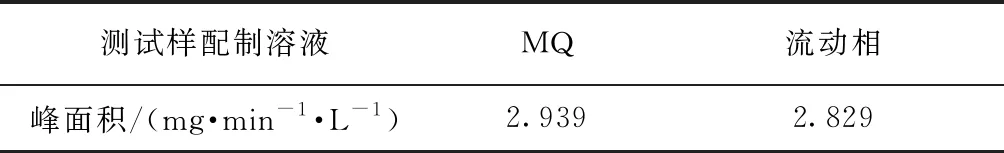
表4 不同測試樣配制溶液條件下的TOC峰面積Tab.4 Peak Areas of TOC under Different Sample Solvents
2.6 天然原水的測定
黃河水樣濃縮至20 mg/L后經樹脂分離得到強疏、弱疏、極親、中親4種組分,回收率為101.76%,各組分濃度如表5所示。由表5可知,4種組分的TOC濃度從大到小依次為:中親>弱疏>極親>強疏。各組分分別經0.45 μm濾膜過濾后調節pH至中性,測定其分子量分布如圖8和表6所示。

表5 原水各組分濃度Tab.5 TOC Concentration of Each Component in Raw Water
由圖8可知,試驗原水及其各組分中有機物分子量分布分為3部分。第一部分分子量較高(106~1.34×104Da),峰值對應的表觀分子量為1.2×105Da。由圖8(a)可知,這部分有機物的UV響應均較低。由圖8(b)可知,只有原水及中親組分在這一分子量分布區間出現TOC響應,說明原水含有的大分子有機物多為中性親水組分,該類有機物多為一些高分子蛋白質、多糖等親水性組分,此類物質對紫外光的吸收極低[15]。
第二部分為中等分子有機物(2 500~1 500 Da),峰值對應的表觀分子量為1 545 Da,與后面的小分子峰分離較差。由圖8(a)可知,該區間有機物對紫外有較高響應,可以推測其多為腐殖質類中分子有機物,此類有機物對紫外吸收極強,且結構復雜。由圖8(b)可知,該區間原水中的有機物TOC響應最高,出峰面積最大,說明中等分子(2 500~1 500 Da)有機物在原水中含量最高。各組分在該區間的峰面積占原水的比例順序從大到小依次為:中親(35%)> 弱疏(26%)> 極親(21%)> 強疏(18%),說明中親組分構成原水中等分子(2 500~1 500 Da)有機物的主要部分。
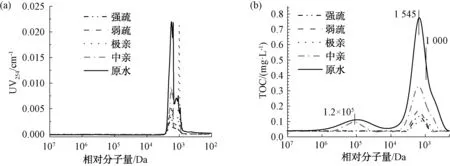
圖8 各組分及原水UV和TOC變化圖Fig.8 UV and TOC Responses of Each Component in Raw Water

表6 各組分及原水對應的TOC峰面積Tab.6 Peak Areas of TOC with Each Component in Raw Water
第三部分為小分子有機物(1 500~700 Da),峰值對應的表觀分子量為1 000 Da,UV響應相比中等分子有機物較小,與中等分子區間的峰分離較差,說明這部分有機物大多數是小分子類有機物,所含碳碳雙鍵和芳香族結構較少[16],也可能包含中等分子有機物的分解產物。
綜上,由圖8(a) 和圖8(b) 可知,大分子(106~1.34×104Da)有機物、中等分子(2 500~1 500 Da)有機物和小分子(1 500~700 Da)有機物均主要由親水性物質組成。由表6可知,各組分峰面積順序依次為:中親>弱疏>極親>強疏,與固相萃取結果相同。值得注意的是,圖8(a) 中極親組分的UV響應值明顯偏高,可能是由于極親組分的洗脫液中含有較高濃度NaCl,使極親樣品的離子強度高于其他樣品,樣品與固定相之間發生了吸附或靜電排斥反應,導致UV響應極高。圖8(b)中極親組分的響應峰滯后可能也與離子強度較高有關。
3 結論
本試驗主要考察了pH、離子強度、配樣溶液等操作條件對HPSEC-UV-TOC聯用技術測定葡聚糖T1及天然地表水中有機物分子量分布的影響,所得結論如下。有助于完善HPSEC-UV-TOC聯用技術,從而使得該技術在飲用水地表水源有機物組分研究中發揮更大作用。
(1)在色譜柱允許的pH范圍內,pH對葡聚糖T1分子量分布的測定結果影響較小。
(2)離子強度對相對分子質量分布的測定影響較大,離子強度從0增加到0.4 mol/L NaCl時,UV響應有明顯增加,而TOC出峰時間延后,峰面積減小。
(3)葡聚糖T1樣品溶液采用超純水為溶劑與采用流動相為溶劑相比,對其相對分子質量分布的測定影響較小。
(4)HPSEC-UV-TOC聯用技術可有效表征黃河原水及其組分的分子量分布。原水中的中性親水組分含量最高,且該組分在大分子(106~1.34×104Da)、中等分子(2 500~1 500 Da)和小分子(1 500~700 Da)有機物中均占較高比例。