抗阻運動結合模塊化營養指導對糖尿病周圍神經病變患者神經傳導功能的影響
何健儀
鶴山市中醫院內三科,廣東江門 529700
糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)為糖尿病常見的一種并發癥,臨床主要表現為對稱性疼痛及感覺異常, 有研究顯示, 約13.25%~67.89%糖尿病患者可出現DPN[1]。DPN 可嚴重影響患者生活質量及身體健康,還會增加糖尿病足發生風險,成為糖尿病患者致殘及致死的重要原因, 故加強對其的護理干預十分重要[2]。 營養干預及運動鍛煉為防治糖尿病重要的非藥物手段,運動、營養干預結合的方式對控制糖尿病患者血糖有重要意義[3]。 該研究將抗阻運動結合模塊化營養指導用于2018 年9 月—2020 年7 月收治的43 例糖尿病周圍神經病變患者中,旨在觀察其對患者神經傳導功能的影響,現報道如下。
1 資料與方法
1.1 一般資料
該次研究選擇該院86 例DPN 患者,以隨機數表法分為對照組與觀察組,各43 例。 對照組男性24 例,女性19 例;年齡47~79 歲,平均(63.05±1.89)歲;糖尿病病程2~12 年,平均(5.63±1.74)年;受教育程度:小學9例,初中11 例,高中12 例,大專7 例,本科及以上4例。 觀察組男性25 例,女性18 例;年齡49~82 歲,平均(63.12±1.93)歲;糖尿病病程3~13 年,平均(5.67±1.76)年;受教育程度:小學8 例,初中10 例,高中13 例,大專8 例,本科及以上4 例。 兩組性別、年齡、病程、受教育程度相比,差異無統計學意義(P>0.05),具有可比性。
1.2 納入與排除標準
納入標準:均符合WHO 制定的2 型糖尿病診斷標準,并明確診斷為DPN;患者有獨立完成答卷的能力,溝通能力、配合性良好;均對該研究知情,且簽訂同意書;研究經醫院倫理委員會批準。
排除標準:合并嚴重心腦血管疾病者;合并腦卒中或其他中樞神經系統病變者; 有間歇性跛行等運動禁忌證者;精神疾病者;臨床資料不完善者;合并急慢性心、腎、肝等功能障礙者;配合性較差者。
1.3 方法
對照組行常規護理,干預時間從入院至出院前,加強患者的健康宣教,使其掌握DPN 相關疾病知識,做好患者飲食指導、心理護理、血糖監測等護理工作,囑其適量進行散步、慢跑等有氧運動。 觀察組在此基礎上行抗阻運動+模塊化營養指導,具體措施見下:
抗阻運動: 在醫務人員指導下進行單次最大抗阻負荷(IRM)測試,根據60%~80%的IRM 選擇相應磅數的漸進式彈力訓練帶(美國賽樂Thera-Band),完成12周中等強度的抗阻訓練,3 次/周,1 h/次, 于餐后1~2 h開始訓練。訓練內容包括10 min 的關節活動熱身練習、40 min 下肢彈性抗阻力訓練(壓腿、踝外翻、膝外伸、站立下蹲、雙臂上舉、髖關節彎曲等),1 組每個動作重復12 次,共做3 組,最后進行10 min 的深呼吸鍛煉。
模塊化營養指導:①模塊1:由經過培養的護士應用《糖尿病飲食營養知識手冊》對患者進行信息咨詢,包括日常飲食情況、家庭膳食情況、營養方案等知識掌握情況。 開展營養咨詢會議,并在會議開始時發放手冊給每位患者。②模塊2:向患者發放《日常膳食問卷調查表》了解其飲食結構及習慣,應用營養風險篩查量表對其營養狀況進行評估, 根據評估結果調整患者膳食結構,囑患者切勿暴飲暴食或隨意進食。③模塊3:優化患者飲食方案, 根據患者具體情況確定總熱能、3 大營養素的比例,合理分配餐次,在不影響營養原則的情況下盡可能照顧患者長時間形成的飲食習慣。 教會其食品交換法,鼓勵其進行多元化飲食,達到食物多樣化及營養全面的要求。
1.4 觀察指標
于干預結束后記錄兩組血糖控制達標率, 達標標準:空腹血糖≤6.2 mmol/L,餐后2 h 血糖≤8.0 mmol/L,HbAlc<6.5%。對兩組干預前后神經傳導速度進行比較,應用表面電極分別測量腓總神經 (NPC) 和正中神經(MN)的運動神經傳導速度(MNCV)、感覺神經傳導速度(SNCV)。 應用生活質量評價量表(SF-36)對兩組進行測評,包括生理職能、精神健康、社會功能、精力等8個維度,總分100 分,分數越高提示生活質量越佳。
1.5 統計方法
采用SPSS 19.0 統計學軟件予以數據處理,計量資料以(±s)表示,行t 檢驗;計數資料以頻數和百分比(%)表示,行χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者血糖控制情況對比
觀察組干預前血糖達標率為67.44%(29/43),與對照組65.12%(28/43) 相比, 差異無統計學意義 (χ2=0.052,P=0.820); 觀察組干預后血糖達標率為95.35%(41/43),與對照組79.07%(34/43)相比,相對更高,差異有統計學意義(χ2=5.108,P=0.024)。
2.2 兩組患者神經傳導功能對比
兩組干預前的腓總神經和正中神經MNCV、SNCV差異無統計學意義(P>0.05),觀察組干預后的MNCV、SNCV 明顯優于對照組,差異有統計學意義(P<0.05),見表1。
表1 兩組患者干預前后神經傳導速度對比[(±s),m/s]
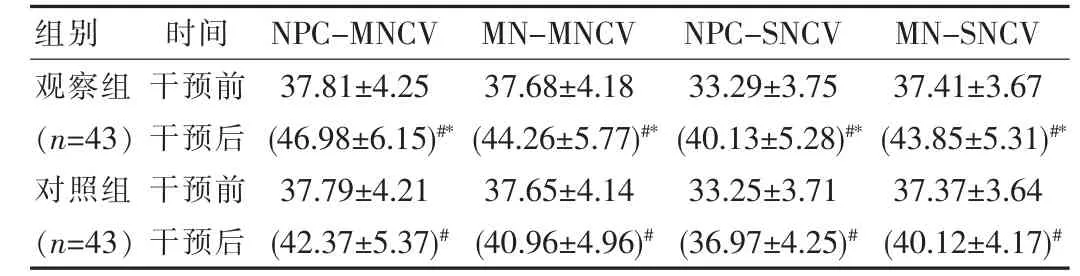
表1 兩組患者干預前后神經傳導速度對比[(±s),m/s]
注:#表示與干預前相比,P<0.05,*表示與對照組相比,P<0.05
組別時間NPC-MNCV MN-MNCV NPC-SNCV MN-SNCV觀察組(n=43)對照組(n=43)干預前干預后干預前干預后37.81±4.25(46.98±6.15)#*37.79±4.21(42.37±5.37)#37.68±4.18(44.26±5.77)#*37.65±4.14(40.96±4.96)#33.29±3.75(40.13±5.28)#*33.25±3.71(36.97±4.25)#37.41±3.67(43.85±5.31)#*37.37±3.64(40.12±4.17)#
2.3 兩組患者生活質量評分對比
兩組干預前的生活質量評分差異無統計學意義(P>0.05), 觀察組干預后生活質量評分明顯較對照組高,差異有統計學意義(P<0.05),見表2。
表2 兩組患者干預前后生活質量評分對比[(±s),分]
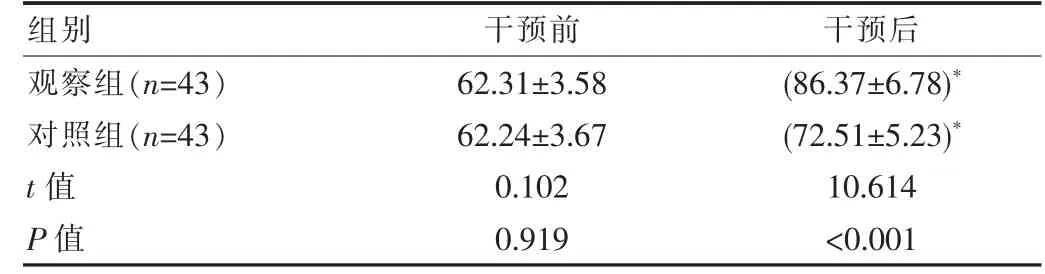
表2 兩組患者干預前后生活質量評分對比[(±s),分]
注:與組內干預前比較,*P<0.05
組別干預前 干預后觀察組(n=43)對照組(n=43)t 值P 值62.31±3.58 62.24±3.67 0.102 0.919(86.37±6.78)*(72.51±5.23)*10.614<0.001
3 討論
DPN 為糖尿病常見的一種嚴重并發癥, 早期癥狀較為隱匿,難以及時診斷,待確診后患者往往承受多種不適及痛苦,嚴重影響其生活質量。 隨神經、血管并發癥進一步發展,患者下肢血管可能出現彎曲、堵塞等,引發缺氧缺血, 嚴重者甚至需截肢。 除常規降糖治療外,實施合理的飲食及運動干預對控制血糖水平、延緩神經病變有重要意義。
大量研究證實運動療法及營養干預對改善糖尿病患者血糖、控制病情發展有重要意義,故該研究對患者實施抗阻運動與模塊化營養干預相結合的干預方案,并取得較好效果[4-5]。 抗阻運動可引起機體成分改變,增加肌肉橫截面積,促使肌肉力量增強,促進血糖吸收及代謝,進而改善胰島素抵抗、增強胰島素敏感性,調節機體血糖水平。 此外抗阻運動還可使無氧及有氧代謝能源系統內酶活性提高, 進而促進糖原及葡萄糖代謝分解[6]。
在運動鍛煉基礎上增加營養干預可進一步提高血糖控制效果,改善周圍神經病變所致相關癥狀,該次研究將對患者的營養管理分為三個模塊, 模塊1 主要目的為了解患者營養知識掌握程度, 模塊2 了解患者日常飲食結構及習慣,并對患者營養風險進行評估,便于適時調整患者飲食結構, 模塊3 目通過合理配比營養素、教會患者食物交換法等優化飲食方案,使患者飲食能夠多元化、營養全面平衡[7]。 通過運動鍛煉及營養干預相結合的護理方案, 可有效改善患者營養狀況及血糖水平,利于提升臨床血糖控制效果,進而延緩或控制周圍神經病變病情,改善患者生活質量[8]。
該次研究結果顯示,觀察組血糖控制達標率、生活質量評分明顯高于對照組,提示抗阻運動+模塊化營養干預可有效提升血糖控制效果,改善患者生活質量。 觀察組干預后腓總神經和正中神經的MNCV、SNCV 均明顯優于對照組。 提示上述干預方案可有效提高患者神經傳導功能, 分析原因可能為運動及營養干預可改善機體代謝障礙,糾正低氧對神經傳導速度的負性影響,緩解神經組織缺氧缺血現象,進而改善神經傳導[9]。
綜上所述, 抗阻運動結合模塊化營養指導可提高糖尿病周圍神經病變患者血糖控制達標率, 提高神經傳導功能及生活質量,值得推廣。

