同位素稀釋技術(shù)在土壤微量元素地球化學(xué)活性分析中的應(yīng)用①
毛凌晨,劉力菠,孔 惠,嚴(yán)南峽,葉 華
(1 上海理工大學(xué)環(huán)境與建筑學(xué)院,上海 200093;2 上海紡織建筑設(shè)計研究院有限公司,上海 200082)
土壤中的微量元素指那些含量通常低于100 mg/kg的元素,其來源分為自然來源 (如成土母質(zhì)) 和人為來源 (如肥料施用)[1],它們主要吸附于顆粒表面,或與鐵錳氧化物等結(jié)合,封存于其晶格結(jié)構(gòu)中以礦物形式存在。在1970—1998年間,對土壤微量元素的研究工作主要集中在對生物所必需的微量營養(yǎng)元素,如Cu、Zn、Fe、Cr等(FAO/WHO,1995)的生物可利用性和遷移性的分析[2-3]。由于生物體對這些元素所需量極少,但當(dāng)攝取含量過高,則會對生命活動過程產(chǎn)生負(fù)面作用[4]。例如,營養(yǎng)學(xué)家建議成人Se的攝入量應(yīng)為50 μg/d,但當(dāng)劑量超過400 μg/d便會對人體產(chǎn)生危害[5]。此外,Hg、Cd、Pb、As等元素毒性極高,在低劑量時,也對動植物和人體有害。近年來,由于環(huán)境中有毒微量元素(如重金屬)污染嚴(yán)重,加上土壤對于大部分微量元素具有累積作用,越來越多的研究開始通過衡量微量元素在土壤中的地球化學(xué)活性來判斷其生物可利用性與生物累積性[6-7]。
土壤中微量元素的地球化學(xué)活性分析方法通常有化學(xué)提取法(包括單級和多級提取)、透膜法和同位素稀釋技術(shù)等。其中同位素稀釋技術(shù)自21世紀(jì)以來應(yīng)用越來越廣泛。根據(jù)可查到的文獻(xiàn)資料,該技術(shù)最早由1970年Wasik和Tsang[8]將同位素稀釋與氣相色譜結(jié)合用于測定水中痕量污染物,隨后3年同位素稀釋技術(shù)開始應(yīng)用于土壤/巖土中微量金屬元素的測定[9]。圖1為應(yīng)用同位素稀釋技術(shù)分析土壤微量元素的文獻(xiàn)數(shù)量逐年統(tǒng)計圖(搜索引擎Wed of Science,搜索關(guān)鍵詞trace element,soil,isotope dilution)。
同位素稀釋技術(shù)是在土壤樣品固液平衡體系中加入待測元素的某一富集同位素,其濃度已知。加入的外源同位素與樣品中原有的元素均勻混合,使同位素離子在固液兩相進(jìn)行再分配。通過測定添加前后樣品的同位素比值,即可確定待測元素中活性組分的濃度[10]。因為該技術(shù)對固/液交換過程造成的擾動極小,被眾多研究人員認(rèn)為是分析土壤微量元素地球化學(xué)活性最有效、最合理的方法[10-11]。同位素稀釋技術(shù)通過引入E值(E-value, mg/kg)來量化再分配過程樣品中微量元素的同位素可交換量,即樣品微量元素總量中的活性含量[10]。本質(zhì)上,同位素稀釋技術(shù)可以在微量元素與土壤固相交換動力學(xué)的基礎(chǔ)上,區(qū)分可交換態(tài)和不可交換態(tài)的微量元素。同位素稀釋技術(shù)所得結(jié)果不但能預(yù)測微量元素的生物可利用性,還可以為了解影響生物可利用性的各種土壤過程提供更豐富的信息。
1 同位素稀釋法的基本原理
微量元素的地球化學(xué)活性(geochemical lability,簡稱“活性”)是土壤固/液相中元素離子交換、遷移或被生物利用的決定性因素,通常取決于元素的化學(xué)性質(zhì)、來源和土壤本身的理化性質(zhì)[12]。按照微量元素的地球化學(xué)活性,可將土壤中的元素含量分為兩類,如圖2所示:①非活性組分(non-labile):指被原生礦物裹挾、與次生礦物共沉淀或者被有機(jī)質(zhì)嚴(yán)密包裹的微量元素,該組分不會被植物吸收,與外界環(huán)境幾乎不發(fā)生交換;以及以極緩慢的速度(以年或月計)與溶解態(tài)同類元素發(fā)生動態(tài)交換的組分,這部分通常以很強(qiáng)化學(xué)結(jié)合態(tài)存在于土壤固相或膠體顆粒上;②活性組分(labile):指以溶解態(tài)、部分絡(luò)合態(tài)或吸附態(tài)存在的微量金屬元素,這部分元素可以在短時間內(nèi)(數(shù)秒至幾天)通過吸附/解吸、沉淀/溶解等化學(xué)反應(yīng)與溶液中金屬陽離子交換,因此極有可能被生物吸收[12-13]。
利用同位素稀釋技術(shù)分析微量元素的地球化學(xué)活性的基本原理與對應(yīng)的操作流程如圖3所示。在樣品固液平衡體系中加入已知量的待測元素的某一富集同位素試劑,由于同種元素的同位素離子間具有相同的化學(xué)性質(zhì),進(jìn)入土壤溶液中的同位素離子隨即和重金屬的活性部分發(fā)生交換,在經(jīng)過一定時間的離子交換反應(yīng)后,可在土壤固-液相間達(dá)到反應(yīng)平衡,從而改變樣品中待測元素在兩相的同位素豐度[10]。通過測定混合前后樣品上清液(液相)的同位素豐度變化,可確定樣品中元素的有效濃度值即同位素可交換量(E值)。
2 同位素稀釋法的方法建立
建立有效的同位素稀釋法,需在整個過程中達(dá)到以下幾個要求:①在加入外源同位素前,以及在固液分離前,整個體系應(yīng)達(dá)到化學(xué)平衡;②體系中對平衡有影響的物質(zhì)均對外源同位素有相同的反應(yīng)活性;③外源同位素與溶液中的穩(wěn)定同位素性質(zhì)一致。因此,在操作前,應(yīng)對實(shí)驗?zāi)康摹⒛繕?biāo)元素、樣品理化性質(zhì)、檢測手段與分析儀器等有全面的認(rèn)識,從而建立最恰當(dāng)?shù)膶?shí)驗方法。
2.1 外源同位素的選擇
早期受限于分析儀器檢測性能,研究者通常只能選擇放射性的外源同位素進(jìn)行實(shí)驗[10,14-15]。由于部分放射性同位素半衰期很短,且存在安全隱患,大大限制了同位素稀釋法的使用,如64Cu同位素的半衰期僅為12.4 h[16];而63Ni雖然半衰期為100.1 a,但實(shí)驗完成后,涉及實(shí)驗廢料難處理的問題[10]。
隨著高精密分析技術(shù)的發(fā)展,電感耦合等離子體質(zhì)譜儀(Inductively Coupled Plasma Mass Spectrometer,ICP-MS) 被越來越多地投入到科學(xué)研究中。該儀器具有靈敏度高、分析速度快、支持多元素同時測定等優(yōu)點(diǎn),能夠較準(zhǔn)確地測定元素穩(wěn)定同位素的比值(isotope ratio, IR)[17]。從而使穩(wěn)定同位素稀釋技術(shù)(stable isotope dilution)得以成為目前復(fù)雜體系中微/痕量成分檢測常用的方法之一,被廣泛應(yīng)用于土壤微/痕量元素的地球化學(xué)性質(zhì)的研究中[18-19]。
外源穩(wěn)定同位素選擇通常遵循以下原則:①盡可能選擇天然豐度低的同位素作為外源富集同位素,豐度高的作為參比同位素。對于富集同位素來說,較少的外加量即可明顯引起含量變化,因此能減少試劑損耗;而參比元素含量較高,在儀器檢測時,有利于信號保持穩(wěn)定。②避免同量異位素重疊。如 Pd、In 和Sn 會對 Cd 的測量造成干擾。表1為能通過四級桿ICP-MS測定同位素比值的穩(wěn)定同位素[19]。許多推薦外源同位素和參考同位素受到潛在干擾多原子(分子)物種(40Ar16OH:amu=57)的影響,越來越多的問題通過使用新型的ICP-MS儀器和碰撞/反應(yīng)堆單元技術(shù)(最典型的是氦氣碰撞模式)來解決。
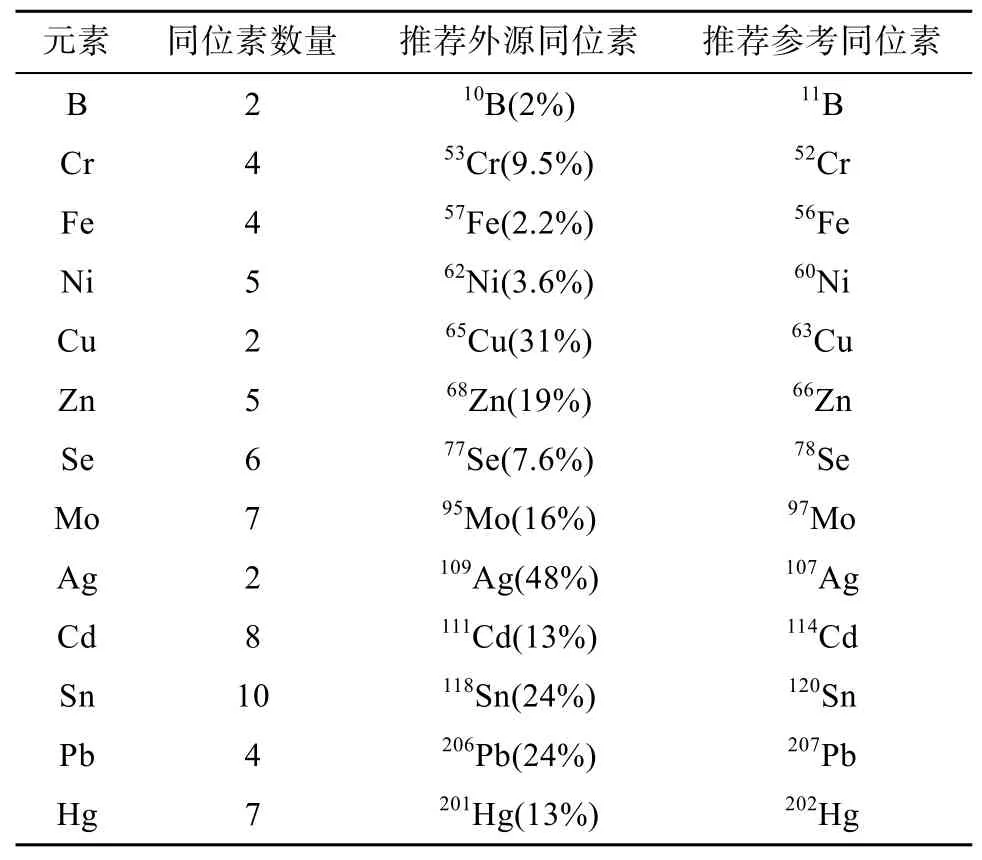
表1 四級桿ICP-MS可測定同位素比值的穩(wěn)定同位素Table 1 Stable isotopes for determining isotope ratios by quadrupole ICP-MS
2.2 外源同位素的添加量
使用穩(wěn)定同位素稀釋技術(shù)時,外源富集同位素試劑的添加量必須滿足:①足以引起液相中目標(biāo)元素的同位素比值產(chǎn)生明顯改變,從而使ICP-MS能準(zhǔn)確檢測[20];②添加量也不宜過大,以免破壞體系中微量元素離子在固液兩相中的平衡。同位素的天然豐度是決定使用何種同位素和添加外源同位素添加量的一個參考因素。與其他同位素的天然豐度相比,若某元素的天然豐度較低,外源同位素添加量也必須控制在相對較低的范圍內(nèi)[18-24]。Nolan等[22]采用了63Cu/65Cu測量值的標(biāo)準(zhǔn)偏差以及IRsp(isotopic ratio of spike,富集同位素試劑中的同位素比值)與IRmeas(isotopic ratio of nature, 天然同位素比值)之間的差值進(jìn)行重復(fù)測量,以評估外源同位素中65Cu 添加量的范圍誤差。實(shí)驗結(jié)果表明,當(dāng)外源同位素添加量等于E值的5% 時,所得E值的誤差值最小(<5%)。Degryse等[24]和Atkinson 等[25]在測定土壤中 Pb 活性的實(shí)驗中發(fā)現(xiàn),當(dāng)加入204Pb(IAnature=1.4%)和208Pb(IAnature=52.4%)(isotopic abundance of nature,天然同位素豐度)分別是其含量的 2.7 倍和 4 倍時,會高估土壤中Pb的化學(xué)活性。Ahnstrom和Parker[23]、Nolan等[22]以111Cd和65Cu為例,提出添加量應(yīng)參考土壤樣品中該元素總量,約1% 左右為宜。然而,Gray等人[20]僅加入了總量的0.1% 便得到了可靠的結(jié)果。
在通常情況下,檢測前E值是未知的,因此可以從元素總量或單級化學(xué)提取法中目標(biāo)元素的含量來估算外源穩(wěn)定同位素的添加量。Young 等人[10]用1 mol/L CaCl2提取液中Cd的濃度來計算添加量;又如Gabler 等人[26]在實(shí)驗中添加了相當(dāng)于EDTA (乙二胺四乙酸)可提取的金屬(Cd、Cu、Ni、Pb和Zn)總量1/3的外源同位素。
2.3 固液兩相平衡介質(zhì)的選擇
平衡介質(zhì)的選擇會影響重金屬離子在溶液中的溶解度,常用的去離子水[10]、EDTA[25]、CaCl2[18]和Ca(NO3)2[27]作為同位素平衡介質(zhì)。
H2O是最常用的溶劑。水作為平衡介質(zhì)能溶解水溶離子態(tài)重金屬、可溶態(tài)有機(jī)質(zhì)及少量其他組分結(jié)合的離子[28],其優(yōu)勢在于不會引入多余的離子導(dǎo)致目標(biāo)元素(特別是重金屬元素)沉淀,繼而低估了E值。然而,使用水會增加膠體的分散性,可能導(dǎo)致E值被高估[16]。
由于水的提取能力較弱,通常只能提取最活潑的游離態(tài)金屬離子。當(dāng)液相目標(biāo)元素含量過低時,為避免儀器檢測時信號過弱,可以采用一些稀釋鹽溶液,如0.1 mol/L或0.01 mol/L CaCl2[19]和0.01 mol/L Ca(NO3)2[27],這些稀釋的二價陽離子鹽溶液可降低溶液中膠體含量,促進(jìn)樣品的過濾并減少膠體干擾的可能性。同時,可以大大提高目標(biāo)同位素在液相的濃度(溶解度)。在對污染土壤As的研究中,Tye等[15]使用5×10–3mol/L (NH4)H2PO4及De Brouwere等[29]使用5×10–3mol/L Ca(NO3)2作為平衡介質(zhì)。Young等[10]推薦采用0.01 mol/L 的CaCl2,一方面可以用于模擬土壤溶液中的Ca濃度;另一方面通過與Cl–1的絡(luò)合作用,待測元素Cd在液相的濃度有顯著提高。但同時該研究也指出,Cl–1會與H2O、Ar、N等結(jié)合,形成多原子離子干擾,影響ICP-MS對As的測定。此外,由于Ag可能會與CaCl2反應(yīng)生成AgCl或不溶鈣鹽的沉淀,因此,在分析As、Ag等元素時,0.01 mol/L Ca(NO3)2是更佳的選擇[27]。
EDTA等螯合劑作為平衡介質(zhì)的優(yōu)勢在于與金屬陽離子的結(jié)合能力更強(qiáng),適用于目標(biāo)元素溶解度較低的土壤樣品。Atkinson等人[25]在實(shí)驗中使用5×10–4mol/L EDTA與0.01 mol/L Ca(NO3)2作為平衡介質(zhì)分別研究了4種污染土壤中的金屬Pb活性,5×10–4mol/L EDTA能提取幾乎所有的不穩(wěn)定態(tài)Pb,但不可避免地釋放一些非活性的Pb;0.01 mol/L Ca(NO3)2在低污染土壤中能提取與EDTA相似濃度的不穩(wěn)定態(tài)Pb,但在重度污染的土壤(如污灌土)中,0.01 mol/L Ca(NO3)2提取的溶解性Pb含量不準(zhǔn)確,甚至與5× 10–4mol/L EDTA提取的濃度范圍相差兩個數(shù)量級,可能是懸浮的亞微米膠體造成的誤差。若將EDTA濃度降低至1×10–5mol/L,則可基本避免對不穩(wěn)定態(tài)元素的影響,且保證上清液中的離子濃度達(dá)到ICP-MS的檢測下限[30]。
土壤溶液膠體中的金屬雖不容易被生物利用,但遷移性極強(qiáng)[16]。樹脂純化技術(shù)不但可以解決去離子水或稀釋鹽溶液提取Cd和Zn等元素時產(chǎn)生的膠體干擾[25],還可以被用于量化膠體中不具有同位素可交換性的元素含量[16,27]。樹脂純化是在固液分離以后,在上清液中加入螯合樹脂,平衡2 h后,用純水沖洗以去除膠體顆粒。然后用稀HNO3從樹脂中洗脫金屬陽離子,測量的同位素比值用于計算不穩(wěn)定態(tài)金屬的含量[16]。樹脂純化的另一個優(yōu)點(diǎn)是它能將金屬和同位素富集,當(dāng)濾液中的金屬濃度和同位素活動接近檢測極限時,可以更可靠地測定E值。
綜上所述,在添加外源同位素之前,應(yīng)確保平衡介質(zhì)不會引起待測元素的沉淀,液相中待測元素的濃度需能被儀器準(zhǔn)確檢測,排除平衡介質(zhì)中陰離子對儀器的干擾。若土壤溶液中出現(xiàn)大量土壤膠體,應(yīng)考慮采用樹脂純化來避免E值被高估。
2.4 平衡時間
在同位素稀釋法實(shí)際應(yīng)用過程中,需要考慮樣品的振蕩時間。首先,在富集同位素加入之前,需要保證微量元素在固液兩相間的分配已經(jīng)達(dá)到動態(tài)平衡。Young 等[10]發(fā)現(xiàn)同位素平衡48 h后Cd 的E值幾乎不再發(fā)生變化,建議將2 d作為平衡時間的最低值。Hamon等[21]認(rèn)為,振蕩 24 ~ 72 h 后,外源Cd111能夠在土壤–溶液體系中達(dá)到平衡。實(shí)驗證明,2 ~ 3 d的振蕩平衡時長也適用于其他微量元素[3,30]。
3 E值的意義及應(yīng)用
3.1 E值的定義及計算
同位素稀釋法通過引入E值來量化再分配過程樣品中微量元素有效濃度值,即樣品元素總量中的活性部分[10]。
計算穩(wěn)定同位素測量E值需要確定3個數(shù)值:①同位素的天然比值(IRnature);②外源同位素富集液相中同位素的比值(IRsp);③在添加外源富集同位素后液相的同位素比值(IRmeas)。利用以下公式來計算E值[11,32]:
式中:Am:天然豐度(Mnat)和富集同位素試劑(Msp)中元素的平均相對原子量;W:土壤樣品干重(kg);Csp,Vsp:富集同位素試劑元素濃度(mg/L)和體積(L);spIRsp,bgIRsp:富集同位素(如204Pb)和參比同位素(如208Pb)在富集同位素試劑中的豐度;spIRnat,bgIRnat:富集同位素和參比同位素在土壤樣品中的豐度;Rss:富集同位素、參比同位素測定值,如204Pb/208Pb。此處要注意的是,雖然長久以來,大部分元素的天然同位素比值都被認(rèn)為是恒定的(除Pb、B等),但近年來越來越多的研究證實(shí),微量元素在地球化學(xué)過程中有同位素分餾現(xiàn)象。因此建議在實(shí)驗中測量樣品中每一種元素天然同位素比值(即bgIRnat),并使用測量值來計算E值。
3.2 E值的應(yīng)用
E值結(jié)果主要被用于以下4個方面:①評估金屬元素生物可利用性;②結(jié)合其他檢測方法,如連續(xù)提取法,評估微量元素的環(huán)境風(fēng)險;③作為土壤特性的函數(shù),預(yù)測土壤中污染元素的溶解度和離子活性,以及環(huán)境變化對其的影響;④結(jié)合同位素交換動力學(xué)(IEK)研究微量元素在土壤中的老化過程。
3.2.1 評估生物可利用性 基于元素的地球化學(xué)活性與生物可利用性之間的共性,E值通常被用來評估預(yù)測生物可利用性[33]。Shetaya等[34]比較了159個埃及土壤樣品中Pb的E值與水果/植物中的Pb含量認(rèn)為,植物更傾向于吸收土壤中活性的Pb。Hammer等[7]利用同位素稀釋技術(shù)研究超累積植物天藍(lán)遏藍(lán)菜對Cd和Zn累積特征發(fā)現(xiàn),這些植物也只能吸收土壤中的活性組分。
同位素稀釋技術(shù)還可以研究動態(tài)環(huán)境下元素的生物可利用性。Izquierdo等[2]分析了淹水/落干條件下稻田土中Zn的E值,發(fā)現(xiàn)在淹水的第5天,生物可利用態(tài)的Zn迅速降低。可能是因為在厭氧條件下,活性的Zn被沉淀成為礦物質(zhì)。次年,Izquierdo等[3]將E值與Tessier五步提取法結(jié)合,探究了淹水土壤中多元素(Cd、Zn、Pb、Fe)在淹水土壤中的化學(xué)行為,研究認(rèn)為淹水所引起的土壤pH變化是這些元素生物可利用性改變的重要原因。
3.2.2 E值與化學(xué)提取法的比較及方法評估 1)E值與單級提取法的對比。單級化學(xué)提取是分析微量元素地球化學(xué)活性最經(jīng)典常用的方法。最常采用的提取劑有中性鹽(CaCl2、MgCl2等)、稀酸(HNO3、乙酸等)以及絡(luò)合劑(EDTA與DTPA)。化學(xué)提取法具有操作簡單的優(yōu)勢,但在分析過程中破壞了固液兩相的平衡,導(dǎo)致結(jié)果不準(zhǔn)確。同位素稀釋技術(shù)可以被用于衡量提取劑在分析各元素在不同土壤中的適用性。Garforth 等[35]評價了4種常用提取劑對地球化學(xué)活性的預(yù)測結(jié)果認(rèn)為:1 mol/L CaCl2一般情況下會低估Ni、Cu、Zn和Pb的活性;而0.43 mol/L HNO3則會高估元素的活性。相較而言0.43 mol/L乙酸與0.05 mol/L EDTA的結(jié)果最理想。G?bler等[26]將E值(Cd、Cu、Ni、Pb 和Zn)與EDTA提取量進(jìn)行了對比分析,結(jié)果證明兩者得出的活性含量基本接近。但是,對于個別元素,如Cr,由于EDTA與其絡(luò)合能力較差,所以用EDTA提取結(jié)果并不準(zhǔn)確。土壤本身的理化性質(zhì)也能影響化學(xué)提取法結(jié)果的準(zhǔn)確性。在堿性土壤中,ISO認(rèn)證的0.43 mol/L稀硝酸提取法[31]所提取的Ni、Cu、Zn、Cd和Pb濃度要遠(yuǎn)高于E值。這是因為土壤中與碳酸鹽結(jié)合的非活性的重金屬被酸溶解,因而高估了目標(biāo)元素的活性。而在酸性土壤中,稀酸提取與E值的結(jié)果非常接近[27,30]。
此外,在預(yù)測土壤中金屬元素的溶解度時,通常會使用元素的地球化學(xué)活性作為模型輸入值,多方研究結(jié)果證明E值作為模型輸入值比單級提取法作為輸入值所預(yù)測的溶解度更符合實(shí)測值[26-27,32]。Ren等[36]通過同位素稀釋技術(shù)與0.43 mol/L HNO3單級提取的結(jié)果對比證明,E值更適用于模擬研究土壤中Pb和Zn同位素交換組分中可溶的部分,單級提取的結(jié)果不能代替同位素稀釋法作為輸入值來評估土壤中不穩(wěn)定態(tài)的Pb和Zn的含量。因此,可以從側(cè)面證實(shí)使用同位素稀釋法所測得的地球化學(xué)活性更為準(zhǔn)確。
2)E值結(jié)合連續(xù)提取法的地球化學(xué)分析研究。連續(xù)化學(xué)提取,是指根據(jù)化學(xué)結(jié)合能力,采用組合的化學(xué)提取劑連續(xù)地將土壤、沉積物、污泥等樣品中不同組分結(jié)合的無機(jī)物質(zhì)分離出來的過程,Tessier五步法[37]及BCR四步法[38]是使用最廣泛的兩種連續(xù)提取法。將E值與元素形態(tài)結(jié)果進(jìn)行比較可以推測某一形態(tài)的地球化學(xué)活性,并探討元素形態(tài)在復(fù)雜環(huán)境中的轉(zhuǎn)化機(jī)制,做出更準(zhǔn)確的生態(tài)風(fēng)險評估。
研究發(fā)現(xiàn)土壤中離子交換態(tài)、酸可提取態(tài)(碳酸鹽結(jié)合態(tài))以及可氧化態(tài)(有機(jī)結(jié)合態(tài))中元素含量的總和通常與E值極為接近,均為活性元素[23,39]。而可還原態(tài)(鐵錳氧化物結(jié)合態(tài))與殘渣態(tài)中的元素與土壤礦物結(jié)合較強(qiáng),主要以非活性的形式存在。但在有機(jī)質(zhì)含量極低、氧化性較強(qiáng)的土壤中,碳酸鹽結(jié)合態(tài)的Pb也可能是非活性的[25]。通過比較氧化還原電位變化的土壤中E值與連續(xù)提取法形態(tài)結(jié)果,Izquierdo等[3]與Marzouk[40]的研究發(fā)現(xiàn),在還原狀態(tài)下,隨著鐵錳氧化物被還原溶解,土壤中Cd、Pb和Zn的E值增加,也證實(shí)了鐵錳氧化物結(jié)合態(tài)的金屬在氧化條件下主要以非活性的形式存在。
3.2.3 模擬預(yù)測土壤溶液中微量元素的含量 利用地球化學(xué)模型,如WHAM、Visual-Minteq等,預(yù)測金屬元素的溶解度時,需將土壤中的活性元素含量以及理化條件(如pH、鐵氧化物、腐殖酸、碳酸鹽等)作為參考值輸入模型。獲得結(jié)果可以用于解釋控制土壤中微量元素反應(yīng)活性的潛在機(jī)制,為土壤中微量元素的化學(xué)活動提供合理預(yù)測。
Marzouk等人[27]利用同位素稀釋法測定了英國礦區(qū)246個土壤樣品中Pb、Cd和Zn的E值,結(jié)合WHAM地球化學(xué)形成模型預(yù)測了金屬溶解度,發(fā)現(xiàn)用E值模擬所得的結(jié)果與實(shí)測值非常接近。Pb在土壤溶液中的含量范圍很大,從10–3mol/L到10–10mol/L,受土壤固相以及pH影響很大;相較而言,Cd在土壤中的總量雖然很低(平均值僅為Pb的千分之一),但溶解度不低且范圍較小(10–6~ 10–8mol/L)。其在土壤溶液中的含量主要受腐殖質(zhì)影響。在另一個研究中,Mao等[41]證實(shí),腐殖質(zhì)還能影響土壤中Cu的活性及溶解度。
3.2.4 利用E值研究土壤重金屬老化過程及影響因素 污染元素進(jìn)入到土壤中后,通過吸附、沉淀等一系列化學(xué)反應(yīng)由活性轉(zhuǎn)為非活性的過程稱為元素在土壤中的穩(wěn)定化/老化過程。研究者們采用實(shí)驗室污染培養(yǎng)法,結(jié)合E值,可以分析討論污染物在土壤中老化-累積的過程。這些研究發(fā)現(xiàn)土壤中的礦物質(zhì)(如沸石)和有機(jī)質(zhì)(如胡敏酸)通過吸附、沉淀等化學(xué)反應(yīng)對微量元素的老化過程有著重要影響[42-43]。Tye等[15]在一項為期818 d的實(shí)驗中發(fā)現(xiàn),Cd和Pb所形成的碳酸鹽以及磷酸鹽沉淀是其活性(E值)隨時間推移降低的主要原因。堿性土壤中Cd和Pb的老化尤為明顯。
4 總結(jié)與展望
同位素稀釋技術(shù)是通過在固液平衡的土壤體系中加入外源富集同位素,用ICP-MS測定混合前后樣品液相中的同位素豐度變化,來確定元素在土壤中的地球化學(xué)活性。同位素稀釋法結(jié)果可以反映元素在一定時間內(nèi)的潛在反應(yīng)形態(tài),也可以用于評估有毒微量元素的生物可利用性,結(jié)合地球化學(xué)模型或多級化學(xué)提取法分析其在土壤各相的濃度分布。該方法可以被用于土壤重金屬污染的環(huán)境風(fēng)險評估與預(yù)測,也可以用于研究微量營養(yǎng)元素的生物可利用性。
建立有效的同位素稀釋方法前,應(yīng)對目標(biāo)元素、樣品的理化性質(zhì)有較全面的認(rèn)識。在建立方法時,需要特別注意外源同位素的選擇要準(zhǔn)確、濃度應(yīng)適中、振蕩時系統(tǒng)應(yīng)保持不變,平衡時間應(yīng)在2 ~ 3 d之內(nèi),必要時可用樹脂純化方法排除液相中膠體的干擾。土壤中元素的總量或單一化學(xué)提取含量可以用于確定外源同位素的濃度。
在建立同位素稀釋法的過程中,研究者可以根據(jù)具體情況對實(shí)驗條件進(jìn)行調(diào)整,擴(kuò)大了技術(shù)的使用范圍。特別適用于分析堿性土壤、受咸潮影響的沉積物等重金屬遷移性、生物可利用性的研究。此外,同位素稀釋技術(shù)在環(huán)境變化的系統(tǒng)中也有很大的優(yōu)勢,如淹水/落干的潮灘沉積物、水稻田、石油污染場地、回填土等。開發(fā)基于同位素稀釋法的原位監(jiān)測技術(shù),不但可以更深入地了解環(huán)境中微量元素的地球化學(xué)反應(yīng)與過程,還能進(jìn)行更準(zhǔn)確的環(huán)境評價與預(yù)測。

