腹腔鏡下宮頸癌根治術中應用不同舉宮器械的臨床效果及預后對比
賈叢 苑中甫 常蕾 李志花 袁玲
[關鍵詞] 宮頸癌;根治性子宮切除術;微創手術;舉宮器械;腹腔鏡
[中圖分類號] R737.3? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1673-9701(2021)17-0008-05
Comparison of clinical effects and prognosis of different uterine lifting devices during laparoscopic radical resection of cervical cancer
JIA Cong? ?YUAN Zhongfu? ?CHANG Lei? ?LI Zhihua? ?YUAN Ling
Department of Gynecology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou? ?450000, China
[Abstract] Objective To explore the clinical effects and prognostic effects of different uterine lifting devices during radical laparoscopic hysterectomy in patients with cervical cancer. Methods A total of 372 patients with cervical cancer who underwent laparoscopic radical resection in our hospital from January 2016 to January 2018 were retrospectively analyzed. The patients were divided into three groups according to the different uterine lifting devices during the operation, including the simple uterine lifter group (group A, n=124), cup-shaped uterine lifter group (group B, n=144), and the simple uterine lifter combined with cup-shaped uterine lifter group (group C, n=104). The clinical-pathological data,perioperative indicators,and long-term prognosis of the three groups were observed. Results The comparison of perioperative indexes showed that the indexes of the operation time, hospitalization time, and intraoperative blood loss in group B were better than those in group A [(236.49±34.48) min vs. (248.53±34.04) min, P<0.05; 21.00 d vs. 23.00 d, P<0.05; 135.00 mL vs. 175.00 mL, P<0.05]. There was no significant difference in the number of lymph node dissections, pelvic lymph node metastasis, postoperative lower limb lymphedema, and urinary retention in the three groups (P>0.05). The comparison of prognostic results showed that the overall survival rate of ⅠB3 and ⅡA patients in group A was significantly better than group B and group C (P<0.05). Conclusion Compared with the cup-shaped uterine lifter during laparoscopic radical resection of cervical cancer, the simple uterine lifter has more bleeding, longer operation time, and hospital stay. However, the long-term survival rate of using a simple uterine lifter for patients with stage ⅠB3 and ⅡA is better than the cup-shaped uterine lifter and the simple combined cup-shaped uterine lifter.
[Key words] Cervical cancer; Radical hysterectomy; Minimally invasive surgery; Uterine lifter; Laparoscopy
宮頸癌是僅次于乳腺癌的第二大女性惡性腫瘤,2018年宮頸癌占中國女性惡性腫瘤發病率的6.24%,占死亡率的3.96%[1]。目前,宮頸癌根治術仍是早期宮頸癌標準治療方式,腹腔鏡下宮頸癌根治術的可行性和安全性已經在諸多研究中得到證實[2-5]。2018年,同期發表于《新英格蘭醫學雜志》(The new England journal of medicine,NEJM)的兩項臨床研究認為宮頸癌微創手術的腫瘤學結局較開腹差[6-7]。國內外專家普遍認為腹腔鏡下宮頸癌根治術中舉宮器械的使用可能造成腫瘤細胞播散或轉移,應當選用簡易舉宮器輔助[8-9],但目前仍處于推測階段,尚無客觀證據證實。因此本研究比較腹腔鏡下宮頸癌根治術中應用不同舉宮器械的臨床效果及預后,希望為微創技術的改進和術中器械的選擇提供一定參考,現報道如下。
1 資料與方法
1.1 一般資料
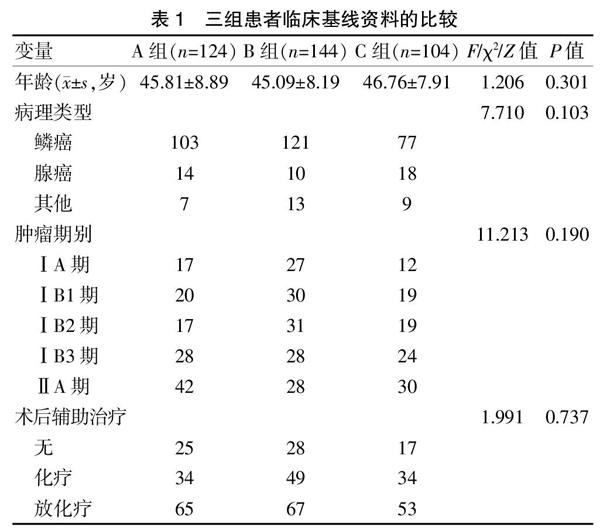
回顧性分析2016年1月至2018年1月鄭州大學第一附屬醫院收治的372例宮頸癌(ⅠA~ⅡA期)患者臨床資料,均符合《2019年NCCN指南》對宮頸癌的診治標準[10],納入標準:①所有患者均經病理檢查確診為宮頸癌;②確診宮頸癌后均于我院行腹腔鏡下宮頸癌根治手術。排除標準:①臨床資料及數據不完善;②患者來我院之前接受放療、化療或免疫治療;③合并其他系統惡性腫瘤。本研究共納入宮頸癌患者372例,根據術中舉宮器械的不同,將患者分為三組:簡易舉宮器組(A組)124例,杯狀舉宮器組(B組)144例,簡易舉宮器聯合杯狀舉宮器組(C組)104例。三組患者年齡、病理類型、腫瘤期別、術后輔助治療等一般資料比較,差異均無統計學意義(P>0.05),具有可比性。見表1。
患者均在術前行宮頸活檢且經病理確診為浸潤性宮頸癌,并根據國際婦產科聯盟(International federation of gynecology and obstetrics,FIGO)2018分期標準進行分期(注:2018年FIGO分期將IB期患者分為ⅠB1、ⅠB2、ⅠB3期,本研究根據婦科檢查記錄重新校正分期)。手術方式:ⅠA1期不伴淋巴脈管間隙浸潤(Lymph vascular space invasion,LVSI):行腹腔鏡下單純筋膜外子宮切除術;ⅠA1期伴LVSI及以后期別:行腹腔鏡下根治性子宮切除術;對附件的處理:年齡<50歲行雙側輸卵管切除+卵巢移位術,年齡≥50歲行雙側輸卵管卵巢切除術。
1.2 方法
手術均由我院經驗豐富的婦科主任醫師實施,術中舉宮器械的選擇根據手術醫師的經驗和習慣決定,與患者病情無關。根據患者術中不同的舉宮器械使用方式,將患者分為A、B、C三組,三組患者術中舉宮器械操作情況如下:A組:簡易舉宮器組,探針探明宮腔深度,調節簡易舉宮器的深度同宮腔深度,應用簡易舉宮器至子宮離體(切開陰道前壁后從陰道填塞紗布卷支撐陰道并防止氣體外泄);B組:杯狀舉宮器組,根據宮頸大小選擇合適的穹隆杯,探針探明宮腔深度,腹腔鏡直視下放置杯狀舉宮器,并應用至子宮離體;C組:簡易舉宮器聯合杯狀舉宮器組,環切陰道前操作同A組,但在環形切開陰道穹窿時取出簡易舉宮器并更換杯狀舉宮器,應用單極電鉤環形切陰道1周。
1.3 觀察指標與隨訪
收集患者臨床病理特征資料(FIGO分期,病理類型,腫瘤期別,術后輔助治療);手術相關指標(手術時間、術中出血量、是否中轉開腹或中轉其他手術方式、住院時間、術后病理);術中、術后并發癥(泌尿系損傷、下肢淋巴水腫、術后尿潴留)。查閱患者住院病歷,并通過電話、網絡及門診隨訪了解患者術后生存狀況。隨訪時間從手術結束至2020年5月或患者死亡。
1.4 統計學處理
運用SPSS 21.0統計學軟件進行數據分析,研究變量以(x±s)或[M(P25,P75)]表示。對該研究中的定量資料進行正態性檢驗,參數采用F檢驗,非參數采用Kruskal-Wallis檢驗。定性資料中無序分類資料行Pearson χ2檢驗,不滿足Pearson χ2檢驗條件者,應用Fisher確切概率法檢驗。等級資料采用多個獨立樣本K-S檢驗。不同腫瘤期別的患者進行分層分析時,采用Kaplan-Meier法繪制生存曲線并進行Log-rank檢驗,檢驗水準α=0.05。
2 結果
2.1 三組手術相關指標比較
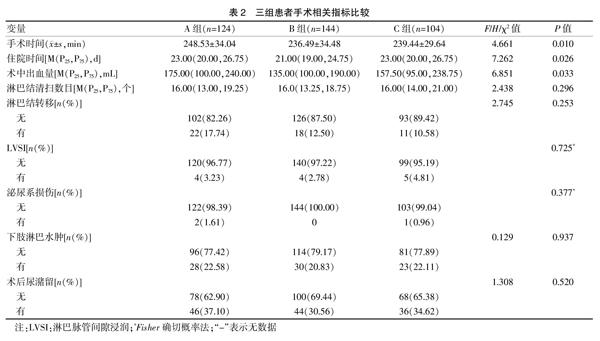
所有患者均順利完成手術,無中轉開腹,陰道壁切緣均陰性。三組患者的手術時間、術中出血量及住院時間比較,差異均有統計學意義(P<0.05)。兩兩比較顯示,B組及C組患者的手術時間均短于A組[(236.49±34.48)min vs.(248.53±34.04)min,P=0.003,(239.44±29.64)min vs.(248.53±34.04)min,P=0.039],B組出血量少于A組(135.00 mL vs. 175.00 mL,P=0.042),B組患者的住院時間較A組短(21 d vs. 23 d,P=0.021)。三組患者的淋巴結清掃數目、LVSI、盆腔淋巴結轉移率比較,差異無統計學意義(P>0.05)。見表2。
2.2 三組手術并發癥情況比較
三組患者手術并發癥情況見表2。三組泌尿系損傷、術后尿潴留、下肢淋巴水腫發生率比較,差異無統計學意義(P>0.05)。術后尿潴留和下肢淋巴水腫均經保守治療后痊愈。
2.3 遠期預后
372例患者平均隨訪時間為(40.71±9.15)個月。對所有患者進行Kaplan-Meier生存分析顯示:A組患者1年、2年OS分別為100.00%、96.70%,B組分別為96.50%、87.50%,C組分別為100.00%、94.20%;Log-rank檢驗提示,A組的總生存率顯著高于B組,差異有統計學意義(P=0.009)。見封三圖2。按不同腫瘤期別對患者進行分層,分別進行生存分析及Log-rank檢驗,結果顯示,對于IB3期和IIA期宮頸癌患者,A組的生存時間顯著高于B組、C組,差異有統計學意義(P=0.046,P=0.044)。見封三圖3~4;IA~IB2期三組宮頸癌患者的生存結局比較,差異無統計學意義(P>0.05)。
3 討論
近年來,腹腔鏡技術的可行性、安全性及微創意義也得到了一致認可,多項臨床試驗表明,早期宮頸癌患者微創手術與開腹手術比較具有創傷小、術中失血量少、住院時間短、患者恢復快等優勢。雖然發表在NEJM的兩項臨床研究[6-7]使得宮頸癌腹腔鏡手術備受爭議,但微創手術仍然是外科領域發展的新趨勢,不能因此盲目否定腹腔鏡手術,而是應當反思腹腔鏡手術中是否存在可能的漏洞,并針對微創技術和方法進行不斷改進。
本研究結果顯示,三組不同舉宮器械組的患者術中淋巴結清掃數目,盆腔淋巴結轉移率,淋巴脈管間隙浸潤陽性率比較,差異無統計學意義,這提示腹腔鏡宮頸癌根治術中,比較簡易舉宮器,應用杯狀舉宮器并沒有增加患者腫瘤細胞沿淋巴途徑轉移的風險。其次,本研究對比三組患者的手術相關指標,發現與B組比較,A組手術時間較長,術中出血量較多,B組的住院時間較A組和C組更短。這與蘇悅等[11]研究結果相符。分析可能原因如下:①杯狀舉宮器比較簡易,舉宮器固定更為牢固,術中容易調整子宮方向;②杯狀舉宮器能更加清楚地顯示穹隆的位置,增加下推膀胱返折腹膜的速度;③杯狀舉宮器可以使陰道壁擴張,在環切陰道時具有一定的張力,方便操作,節省手術時間[12],且ⅠB~ⅡA期的宮頸癌患者多伴隨陰道壁血管充盈,舉宮杯壓迫可以減少術中出血量。三組患者術后并發癥比較顯示,不同舉宮器械組患者泌尿系損傷、下肢淋巴水腫、尿潴留發生率比較,差異無統計學意義(P>0.05)。但值得一提的是,A組和C組各有1例患者術后發現膀胱陰道瘺,A組1例患者術后神經源性膀胱,考慮其原因可能是分離膀胱子宮間隙及處理骶主韌帶時,簡易舉宮器不能充分暴露解剖層次,造成誤傷。相對來說,在上述易損傷膀胱和輸尿管的步驟中,杯狀舉宮器具有獨特優勢。
本研究中,按照臨床病理分期分層后發現,宮頸癌ⅠB3期和ⅡA期的患者應用簡易舉宮器的預后更好,ⅠB2期及之前的患者應用不同舉宮器械預后不存在顯著性差異。推測其可能原因為ⅠB2期及之前患者腫瘤病灶小且局限于宮頸,放置舉宮杯的過程中病灶中央容易壞死的部位甚至是腫瘤的全部都被舉宮杯包裹,所以即使腫瘤細胞被擠壓破裂,也并未脫落于陰道中。Uppal等[13]也提出接受腫瘤直徑≤2 cm的早期宮頸癌患者接受微創手術和開腹手術OS沒有差異。ⅠB3期患者病灶較大,ⅡA期患者雖無宮旁浸潤,但已經超出宮頸,杯狀舉宮器的頂部及外側壁可能會摩擦擠壓病灶,導致腫瘤細胞脫落并播散于陰道中。而簡易舉宮器因與宮頸的接觸面積小,一般選擇非腫瘤組織部位進行鉗夾,即使在調整方向時對陰道壁產生壓迫,面積也比較小,故能很大程度地避免腫瘤細胞的脫落和播散。值得注意的是,C組與A組生存曲線差異無統計學意義,這說明杯狀舉宮器造成腫瘤細胞散落于腹腔的主要環節可能發生在斷陰道殘端時。Matsuo等[14-15]的研究結果也指出腹腔鏡宮頸癌根治術中應用舉宮器械會造成腫瘤細胞脫落,在切開陰道殘端時,由于CO2氣腹的作用導致腫瘤細胞容易在腹腔內播散和轉移。針對這種情況,有研究[16]指出在腹腔鏡手術中可以采用“No look,No touch”技術,盡可能地減少腫瘤暴露于手術野,避免直接操作腫瘤,具體的措施包括:①制作陰道袖套;②免舉宮器械;③宮頸處理最小化;④標本裝袋。事實上,這些措施在很多醫療單位已經開始實施。另外,2020V1版本NCCN宮頸癌指南指出:根治性子宮切除術的標準術式是開腹入路(1類),但對于宮頸癌ⅠA1期不伴LVSI的患者手術途徑可選擇經陰道、開腹或微創[17]。本研究單獨選取宮頸癌ⅠA1期不伴LVSI的患者20例,進行生存分析,研究結果顯示,ⅠA1期不伴LVSI的患者行腹腔鏡下單純子宮切除術中應用不同舉宮器械,患者均未出現復發或死亡,預后比較,差異無統計學意義(P=1.000),這也說明ⅠA1期不伴LVSI的患者行腹腔鏡手術是相對安全的。
綜上所述,腹腔鏡宮頸癌根治術中應用杯狀舉宮器比較簡易舉宮器具有手術時間短、術中出血量少,住院時間短等優點,但是對于ⅠB3期及ⅡA期的宮頸癌患者術中應用簡易舉宮器的遠期預后優于杯狀舉宮器和簡易舉宮器聯合杯狀舉宮器。本研究進一步證實腹腔鏡宮頸癌根治術中杯狀舉宮器的使用會破壞無瘤原則的可能性,這為本研究腹腔鏡宮頸癌根治術中無瘤原則相關技術提供一定的依據,目前,多家中心正在開展實施腹腔鏡宮頸癌根治術中無瘤原則相關技術,如免舉宮器械的子宮懸吊術、制作陰道袖套等,尚需要多中心大樣本的數據來得到更精準的臨床結論。
[參考文獻]
[1] 王寧,劉碩,楊雷,等.2018全球癌癥統計報告解讀[J].腫瘤綜合治療電子雜志,2019,5(1):87-97.
[2] Puntambekar SP,Palep RJ,Puntambekar SS,et al. Laparoscopic total radical hysterectomy by the pune technique:Our experience of 248 cases[J]. J Minim Invasive Gynecol,2007,14:682-689.
[3] Chen Y,Xu H,Li Y,et al. The outcome of laparoscopic radical hysterectomy and lymphadenectomy for cervical cancer:A prospective analysis of 295 patients[J]. Ann Surg Oncol,2008,15:2847-2855.
[4] Nam JH,Park JY,Kim DY,et al. Laparoscopic versus open radical hysterectomy in early-stage cervical cancer:Long-term survival outcomes in a matched cohort study[J].Ann Oncol,2012,23:903-911.
[5] Shazly SA,Murad MH,Dowdy SC,et al. Robotic radical hysterectomy in early stage cervical cancer:A systematic review and meta-analysis[J]. Gynecol Oncol,2015,138:457-471.
[6] Ramirez PT,Frumovitz M,Pareja R,et al.Minimally invasive versus abdominal radical hysterectomy for cervical cancer[J].N Engl J Med,2018,379:1895-1904.
[7] Melamed A,Margul DJ,Chen L,et al.Survival after minimally invasive radical hysterectomy for early- stage cervical cancer[J].N Engl J Med,2018,379:1905-1914.
[8] 《婦產與遺傳(電子版)》雜志編輯部.宮頸癌手術,開腹還是腹腔鏡?(上篇)[J].婦產與遺傳(電子版),2018,8(4):3-5.
[9] 《婦產與遺傳(電子版)》雜志編輯部.宮頸癌手術,開腹還是腹腔鏡?(下篇)[J].婦產與遺傳(電子版),2019,9(1):4-9.
[10] Koh WJ,Abu-Rustum N,Bean S,et al.Cervical cancer,Version 3.2019,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2019,17(1):64-84.
[11] 蘇悅,尹香花.舉宮杯在不同婦科腹腔鏡手術中的應用價值[J].實用臨床醫藥雜志,2011,15(17):87-88,91.
[12] 蘇悅,馬志松.PK鉗聯合舉宮杯在腹腔鏡闊韌帶子宮肌瘤切除術中的應用價值[J].腹腔鏡外科雜志,2013,18(8):588-590.
[13] Uppal Shitanshu,Gehrig Paola A,Peng Katherine,et al. Recurrence rates in patients with cervical cancer treated with abdominal versus minimally invasive radical hysterectomy:A multi-institutional retrospective review study[J] .J Clin Oncol,2020,38(10):1030-1040.
[14] Dietl Anna,Klar Maximilian,Aumann Konrad.Minimally invasive surgery for early-stage cervical cancer:Is the uterine manipulator a risk factor?[J].Am J Obstet Gynecol, 2019, 221(5): 537-538.
[15] Matsuo K,Chen L,Mandelbaum RS,et al. Trachelectomy for reproductive-aged women with early-stage cervical cancer:Minimally invasive surgery versus laparotomy[J].Am J Obstet Gynecol,2019,220(5):469.e1-469.e13.
[16] Kanao H,Matsuo K,Aoki Y,et al. Feasibility and outcome of total laparoscopic radical hysterectomy with no-look no-touch technique for FIGO IB1 cervical cancer[J].J Gynecol Oncol,2019,30(3):e71.
[17] Abu-Rustum NR,Yashar CM,Bean S,et al. NCCN guidelines insights:Cervical cancer,version 1.2020[J].J Natl Compr Canc Netw,2020,18(6):660-666.
(收稿日期:2021-01-12)

