MicroRNA-27a通過靶向HBx mRNA抑制HBV復制
代曉朋,宋 兵,牛霄英,蓋麗娜,張 麗,焦艷梅,傅占江,崔 澂
HBV感染是一個全球性的公共健康問題,全世界有超過2.5億HBV攜帶者,每年約有78萬人死于HBV相關性肝病[1-2]。HBV感染可引起免疫介導的肝損傷和癌變,最終導致肝細胞癌[3]。盡管目前存在有效的疫苗和基于干擾素和核苷酸/核苷類似物的治療策略,但徹底清除患者體內的HBV仍然是一個巨大挑戰[4-5]。因此,深入研究HBV復制和表達的調控機制,尋找新的有效抑制HBV感染和復制的靶點,有助于制定更好的治療策略來實現對HBV的控制。
微小 RNAs(microRNAs,miRNAs)是一類由19~25個核苷酸組成的單鏈非編碼RNA分子,miRNAs可以通過與靶基因的3′ -非翻譯區(untranslated region,UTR)完全互補或不完全互補結合,在轉錄后水平通過降解靶mRNA或抑制mRNA翻譯調控靶基因表達[6]。MiRNAs不僅參與了細胞的生長、發育、分化和內環境穩態等多種生物學過程,而且參與復雜的宿主-病毒相互作用和病毒生命周期調控[7]。在病毒性肝炎等多種疾病中miRNAs表達異常,研究表明,miRNAs能調控HBV和HCV等病毒復制[8-10]。因此,對miRNAs的深入研究不僅有助于了解疾病發生的機制,也有助于開發新型的治療癌癥和病毒感染藥物。
研究表明,miR-1231、miR-101、miR-581和miR-199a-5p等miRNAs參與調控HBV復制[11-14]。miRNAs參與癌癥的發展和纖維化的形成,提示它們在控制乙型肝炎(乙肝)相關的肝臟病理損傷(如肝細胞癌和肝纖維化)方面具有潛在的治療優勢[15-16]。但是,絕大多數miRNAs在HBV復制中的作用仍不明確,尋找新的調控HBV復制的miRNAs,深入研究miRNAs在病毒-宿主中的相互作用,對于制定新的更有效的控制病毒感染和抗病毒治療的策略具有十分重要的意義。
MiR-27a在肝臟中表達豐富,有研究表明,肝癌患者血循環中miR-27a的表達水平較健康者、慢性乙肝患者以及肝硬化患者降低[17]。HBV相關肝癌組織中miR-27a較其癌旁組織表達增加,且過表達miR-27a可以促進肝癌細胞的增殖、遷移和侵襲,縮短細胞的周期[18]。另外,分離HBV感染者血液中的HBsAg顆粒,可以檢測到HBsAg攜帶的包括miR-27a在內的多個miRNAs,這些miRNAs可能與病毒的分布、持續感染和致病有關[19]。上述研究結果提示,miR-27a可能在HBV-宿主相互作用中發揮重要的作用。
本研究首先檢測了miR-27a在HBV穩定表達細胞系HepG2.2.15和對照細胞系HepG2中的表達差異。然后,運用生物信息學和功能實驗方法,闡明了miR-27a在調節HBV復制和表達中的作用及潛在的分子機制。
1 材料與方法
1.1 材料 腺病毒Ad-HBx、pcDNA3.1-HBx等HBV蛋白表達載體由本研究室留存。MiR-27a mimics、miR-27a inhibitor及其無關陰性對照(negative control,NC)由 GenePharma Co.Ltd.(中國上海)合成;HBsAg診斷試劑盒、HBeAg檢測試劑盒購自北京萬泰生物藥業股份有限公司;HBsAg測定試劑盒(化學發光法)、HBeAg測定試劑盒(化學發光法)購自北京中同蘭博醫學檢驗實驗室有限公司;HBV核酸定量檢測試劑盒(PCR-熒光探針法)購自凱杰生物工程(深圳)有限公司;GoScript Reverse Transcription System反轉錄試劑盒、Go Taq qPCR Master Mix定量檢測試劑盒購自Promega公司。連接酶、pMD-18T載體等基因克隆及表達相關試劑購自北京全式金生物技術有限公司;HBXIP 抗體(H-5)購自圣克魯斯生物技術有限公司。
1.2 方法
1.2.1 細胞培養和轉染 肝癌細胞系HepG2、Huh7由本實驗室留存,培養條件為含10%胎牛血清、2 mmol/L L-谷氨酰胺、100 U/ml青霉素和100 mg/ml鏈霉素的DMEM培養基。HepG2.2.15(由HepG2細胞系穩定轉染1.3倍全長HBV獲得)由本實驗室留存,培養條件為含380 μg/ml G418的RPMI 1640培養基。細胞均在37 ℃含5% CO2的恒溫孵箱中進行培養,并根據細胞生長情況及時換液。
將HBx全長序列克隆pcDNA3.1質粒中,構建重組pcDNA3.1-HBx表達載體;將HBx 3′ UTR的基因序列克隆到報告基因質粒pGL3中,構建重組 pGL3-HBx 3′ UTR;構建 HBx 3′ UTR 靶位點突變報告基因檢測載體pGL3-HBx 3′ UTR-Mutant。克隆構建、靶位點突變等相關引物見表1。

表1 引物和序列Table 1 Primers and sequences
提前24 h將要轉染的細胞用胰酶消化,計數后鋪6孔板(5×106個/孔)或 12 孔板(5×105個/孔)(轉染時每組3個重復),16~18 h后待細胞生長到90%~95%融合度用Lipofectamine 2000進行轉染。mRNA和蛋白質檢測于72 h后收集細胞,熒光素酶報告基因檢測于48 h后收集細胞。
1.2.2 實時定量PCR(quantitative real-time PCR,qRTPCR)檢測miRNA、mRNA和HBV DNA 細胞培養24 h后,首先按照 TRIzol Reagent(invitrogen)說明書提取細胞內總RNA,檢測基因表達水平。根據GoScript Reverse Transcription System反轉錄試劑盒說明書,取1 μg總RNA反轉錄為cDNA,反轉錄反應條件為:16 ℃退火30 min,42 ℃反應30 min,85 ℃反應5 min。然后根據Go Taq qPCR Master Mix定量檢測試劑盒說明書,取2 μl反轉錄的cDNA,分別以U6 snRNA和β-actin為miRNAs和HBV mRNA檢測內參,檢測miR-27a、HBV mRNA相對表達水平(反轉錄及定量檢測引物見表1)。反應條件為:95 ℃,2 min;95 ℃,15 s;60 ℃,60 s共40個循環;熔解曲線。用2-△△Ct法計算相對表達量[20]。HBV DNA檢測按照HBV核酸定量檢測試劑盒(PCR-熒光探針法)說明書進行。
1.2.3 ELISA檢測HBsAg、HBeAg吸光度及濃度 吸光度檢測根據HBsAg診斷試劑盒、HBeAg檢測試劑盒說明書進行;濃度檢測根據HBsAg測定試劑盒(化學發光法)、HBeAg測定試劑盒(化學發光法)說明書進行。
1.2.4 Western blot檢測HBx蛋白表達 細胞處理:將細胞用PBS清洗,用胰酶消化后收集細胞,加入適量的冰上預冷的裂解液(含蛋白酶抑制劑)置于冰上10~20 min裂解細胞,12 000×g 4 ℃離心5 min去除細胞碎片,取等量樣品加5×loading buffer煮沸10 min 后上樣。電泳:以初始電壓為 60 V的電流強度進行穩流電泳,當樣品跑到濃縮膠與分離膠交界處時調為80 V,當目的蛋白泳動至距膠下緣1 cm左右結束。轉膜:使用半干法進行轉膜,轉膜條件為200 mA,45 min。取出膜并用TBST洗膜液漂洗,在含5%牛奶的封閉液中封閉1 h。將一抗稀釋后室溫下輕搖孵育1 h,4 ℃靜置過夜。一抗孵育結束后用洗膜液洗5次,每次 8 min。根據一抗來源選擇合適的二抗,1∶1000稀釋,在室溫條件下輕搖1 h。二抗孵育結束后用洗膜液洗5次,每次8 min。在暗室中顯色。
1.2.5 靶基因預測 使用ViTa(http://vita.mbc.nctu.edu.tw/)預測miR-27a在HBV上的靶位點。
1.2.6 雙熒光素酶報告基因檢測 將含有miR-27a結合位點的pGL3-HBx 3′ UTR或結合位點突變的pGL3-HBx 3′ UTR-M與miR-27a表達質粒及內參質粒(pRL-TK)按照 Lipofectamine 2000說明書進行轉染,48 h后用PBS清洗細胞,加入Passive Lysis Buffer裂解細胞,室溫震蕩15 min。按照說明書分別加入裂解液檢測螢火蟲熒光素酶反應強度和內參海腎熒光素酶反應強度。RLU1為螢火蟲熒光素酶反應強度,RLU2 為內參海腎熒光素酶反應強度,相對熒光強度為Ratio=RLU1/ RLU2。
1.3 統計學處理 每個實驗至少重復3次,用GraphPad Prism 8軟件進行統計分析,正態分布的計量數據用±s表示。2組熒光素酶相對活性、mRNA和miRNAs表達水平的比較采用成組t檢驗。P<0.05表明差異具有統計學意義。
2 結 果
2.1 MiR-27a過表達對HBV復制和表達的影響 將miR-27a mimics及NC分別轉染Huh7細胞,qRT-PCR檢測miR-27a表達水平,結果如圖1A所示,miR-27a mimics轉染細胞后miR-27a表達水平顯著升高。進一步探究miR-27a過表達對HBV復制和表達的影響,將miR-27a mimics及NC分別與pHBV1.2組合轉染Huh7細胞,qRT-PCR檢測miR-27a過表達對HBV DNA和HBV RNA的影響,結果如圖1B(HBV DNA)和圖1C(HBV RNA)所示,miR-27a表達抑制HBV DNA和HBV RNA,提示miR-27a抑制HBV的復制和轉錄;ELISA檢測miR-27a過表達對HBeAg和HBsAg的影響,吸光度檢測結果如圖1D(HBeAg)和圖1E(HBsAg)所示,濃度檢測結果如圖1F(HBeAg)和圖1G(HBsAg)所示,結果提示miR-27a過表達抑制HBeAg和HBsAg表達,提示miR-27a抑制HBV蛋白表達。以上研究結果表明,在肝癌細胞系Huh7中,miR-27a過表達抑制了HBV復制和表達。
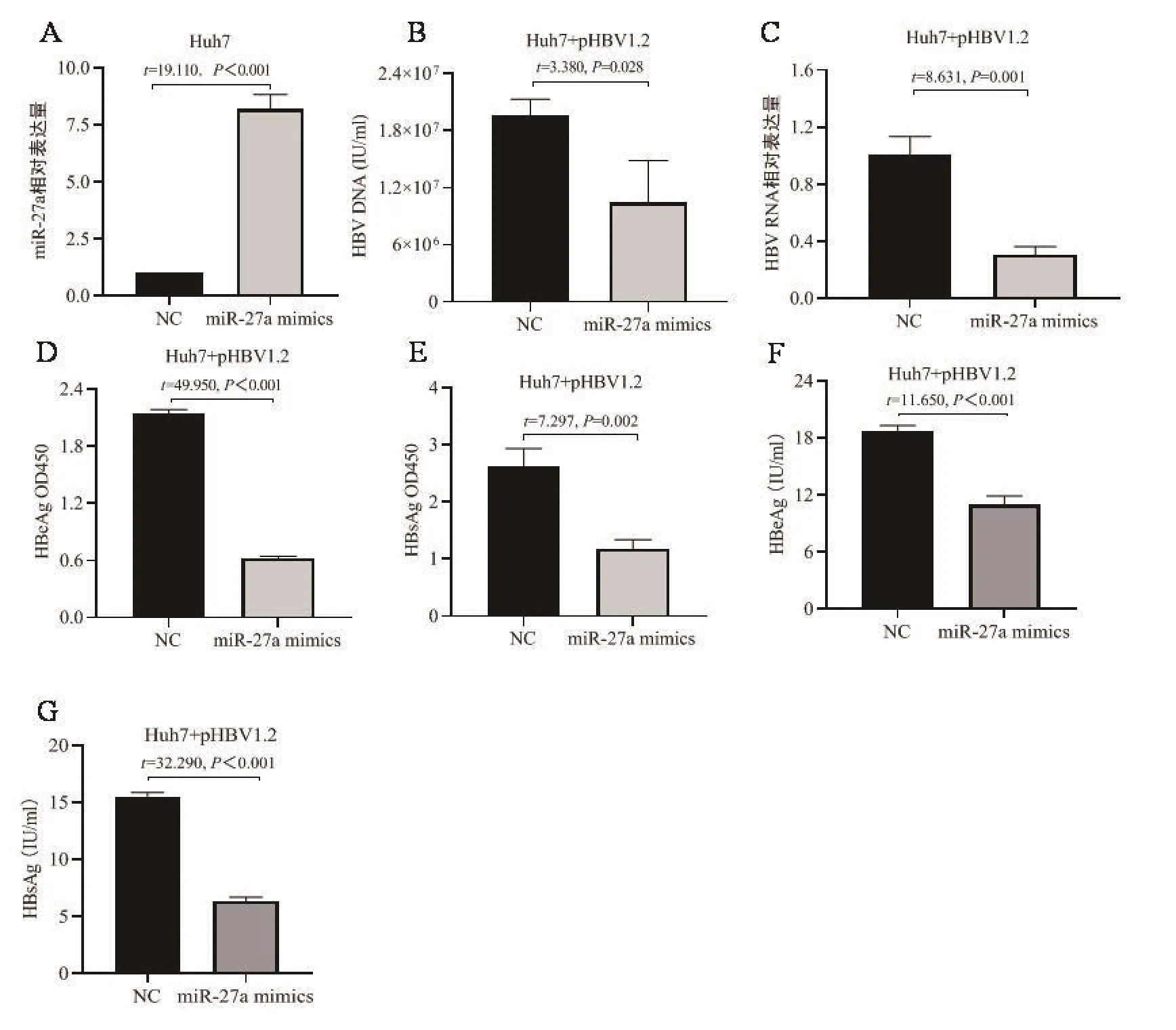
圖1 MiR-27a過表達對HBV復制和表達的影響A.MiR-27a mimics及NC轉染Huh7細胞,miR-27a相對表達量檢測;B~G.MiR-27a mimics及NC分別與pHBV1.2組合轉染Huh7細胞,HBV復制和表達相關指標檢測,HBV DNA(B)、HBV RNA(C)、HBeAg 吸光度(D)、HBsAg 吸光度(E)、HBeAg 濃度(F)、HBsAg 濃度(G)Figure 1 Effect of miR-27a overexpression on HBV replication and expression
2.2 抑制內源性miR-27a表達對HBV復制和表達的影響 將miR-27a inhibitor及NC轉染Huh7細胞,qRT-PCR檢測miR-27a表達水平,結果如圖2A所示,轉染miR-27a inhibitor后miR-27a表達水平顯著降低,提示miR-27a inhibitor可有效抑制miR-27a表達。將miR-27a inhibitor及NC分別與pHBV1.2組合轉染Huh7細胞,qRTPCR檢測抑制內源性miR-27a對HBV DNA和HBV RNA的影響,結果如圖2B(HBV DNA)和圖2C(HBV RNA)所示,抑制內源性miR-27a使HBV DNA和HBV RNA表達水平升高,提示抑制內源性miR-27a表達能夠促進HBV的復制和轉錄;ELISA檢測抑制內源性miR-27a對HBeAg和HBsAg的影響,吸光度檢測結果如圖2D(HBeAg)和圖2E(HBsAg)所示,濃度檢測結果如圖2F(HBeAg)和圖2G(HBsAg)所示,結果顯示抑制內源性miR-27a表達促進HBeAg和HBsAg表達,提示miR-27a促進HBV蛋白表達。以上研究結果表明,在肝癌細胞系Huh7中,抑制內源性miR-27a表達促進了HBV復制和表達。
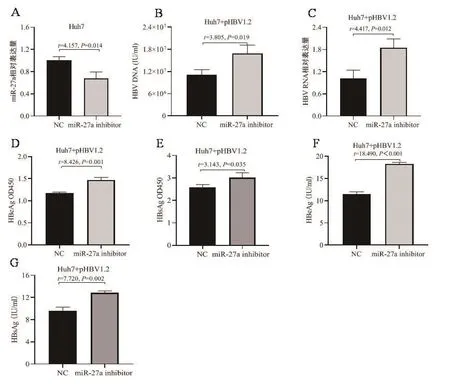
圖2 抑制內源性miR-27a表達對HBV復制和表達的影響A.MiR-27a inhibitor及NC轉染Huh7細胞,miR-27a相對表達量檢測;B~G.MiR-27a inhibitor及NC分別與pHBV1.2組合轉染Huh7細胞,HBV復制和表達相關指標檢測,HBV DNA(B)、HBV RNA(C)、HBeAg 吸光度(D)、HBsAg 吸光度(E)、HBeAg 濃度(F)、HBsAg 濃度(G)Figure 2 Effect of downregulation of endogenous miR-27a expression on HBV replication and expression
2.3 MiR-27a直接靶向HBx 以上研究發現miR-27a可抑制HBV的復制與表達,進一步分析miR-27a調控HBV復制和表達的分子機制。推測存在兩種可能的機制,第一種是miR-27a通過直接靶向HBV RNA而抑制HBV復制和表達;第二種是miR-27a通過靶向HBV復制過程中的調控因子而間接影響HBV復制和表達。通過ViTa在線預測,發現HBx含有miR-27a的靶位點,如圖3A所示 。
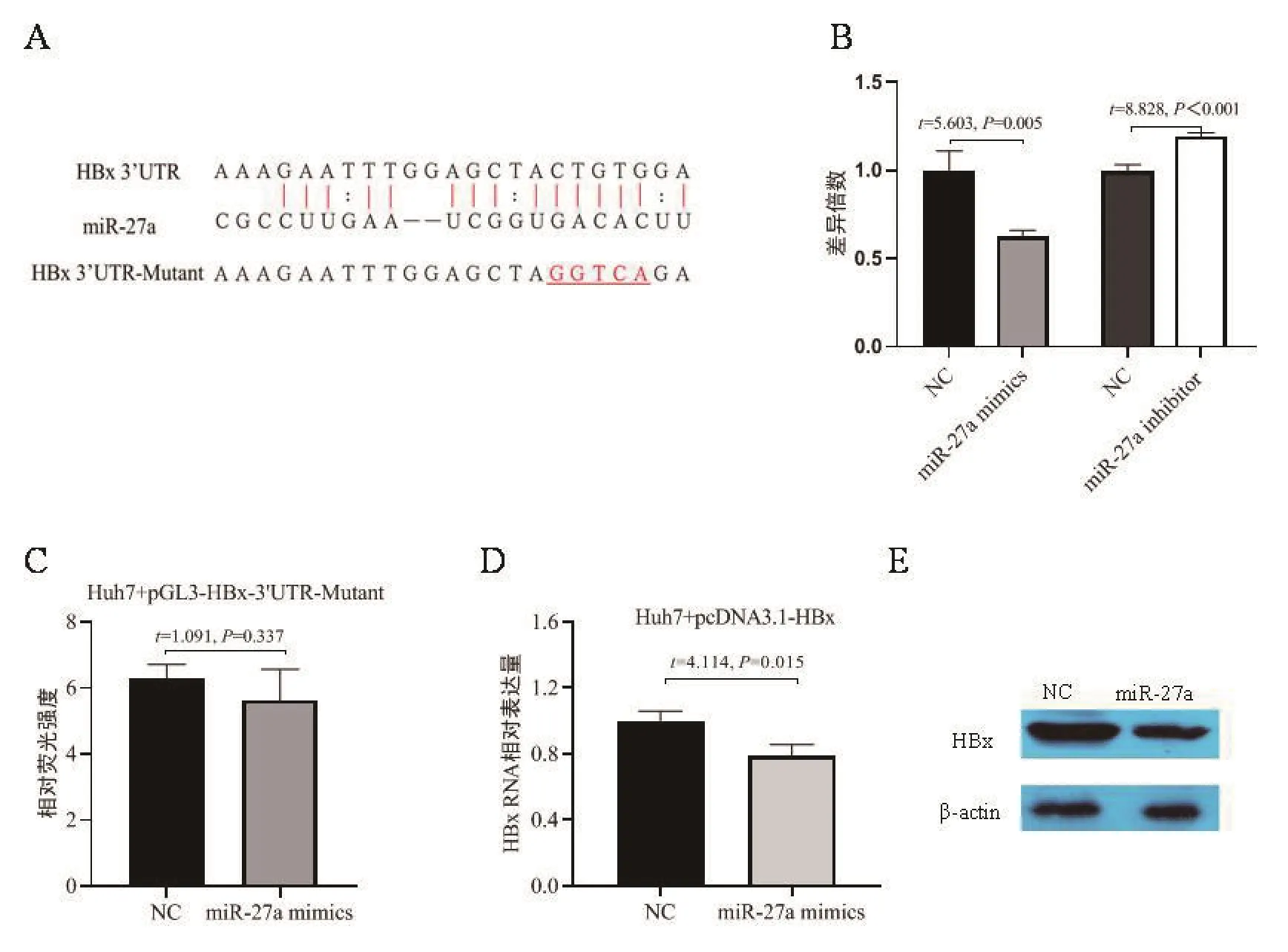
圖3 MiR-27a直接靶向HBxA.MiR-27a與HBx的結合位點及其突變位點;B.MiR-27a mimics/miR-27a inhibitor及其各自的NC分別與miR-27a結合位點的HBx報告基因載體組合轉染Huh7細胞,雙熒光素酶報告基因檢測相對熒光強度;C.MiR-27a mimics及NC分別與miR-27a結合位點突變HBx報告基因載體組合轉染Huh7細胞,雙熒光素酶報告基因檢測相對熒光強度;D~E.MiR-27a mimics及NC分別與HBx表達載體組合轉染Huh7細胞,檢測HBx RNA(D)和HBx蛋白(E)Figure 3 MiR-27a targets HBx directly
將miR-27a mimics/miR-27a inhibitor及相應的NC分別與pGL3-HBx 3′ UTR-Mutant組合轉染Huh7細胞,48 h后收集細胞,檢測雙螢光素酶活性,結果如圖3B所示,miR-27a使含有HBx 3′ UTR的報告基因活性降低。進一步將HBx上miR-27a的結合位點突變(突變位點如圖3A所示),構建含有HBx 3′ UTR突變序列的報告基因載體pGL3-HBx 3′ UTR-Mutant,將 miR-27a mimics及其 NC 分 別 與 pGL3-HBx 3′ UTR-Mutant組 合 轉染Huh7細胞,48 h后收集細胞,檢測雙螢光素酶活性,結果如圖3C所示,miR-27a表達對含有突變位點的報告基因活性沒有顯著影響。以上結果提示miR-27a能夠直接靶向HBx RNA。進一步構建含有HBx序列的表達載體pcDNA3.1-HBx,探究miR-27a對HBx RNA及蛋白表達的影響,將miR-27a mimics及NC分別與pcDNA3.1組合轉染Huh7細胞,72 h后收集細胞,qRT-PCR檢測HBx RNA,結果如圖3D所示,western blot檢測HBx蛋白表達,結果如圖3E所示,轉染miR-27a能夠抑制HBx RNA和蛋白表達。以上結果提示,miR-27a能夠直接靶向HBx RNA,從而間接抑制HBV的復制和表達。
2.4 HBV對miR-27a表達的影響 將pHBV1.2及其空載體轉染Huh7細胞,72 h后收集細胞,qRT-PCR檢測miR-27a表達水平,結果如圖4A所示,瞬時轉染pHBV1.2使miR-27a的表達水平下降,提示HBV能夠抑制miR-27a的表達。與對照細胞HepG2的miR-27a表達水平相比,穩定表達HBV的HepG2.2.15細胞miR-27a表達水平顯著降低,如圖4B所示。由于miR-27a能夠直接靶向HBx 3′ UTR,本研究將表達HBx的腺病毒(Ad-HBx)感染Huh7細胞,檢測HBx的表達對miR-27a的影響,結果如圖4C所示,Ad-HBx感染Huh7細胞使miR-27a表達水平下降,提示HBx使miR-27a表達水平降低。
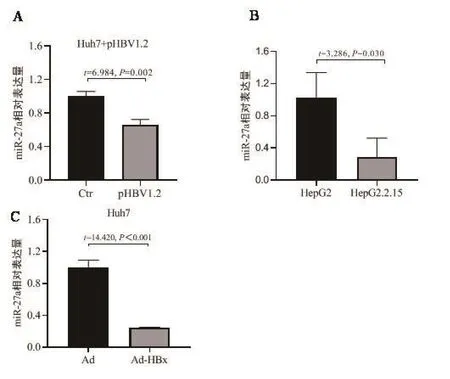
圖4 HBV對miR-27a表達的影響A.pHBV1.2及其對照(Ctr)轉染Huh7細胞,qRT-PCR檢測miR-27a相對表達;B.qRT-PCR檢測HepG2和HepG2.2.15細胞miR-27a相對表達;C.Ad-HBx表達載體和空腺病毒Ad感染Huh7細胞,qRT-PCR檢測miR-27a相對表達Figure 4 Effect of HBV on miR-27a expression
3 討 論
HBV感染是導致活動性肝炎、肝纖維化、肝硬化和肝癌等肝臟疾病的主要因素[21]。盡管針對HBV感染的診斷和治療已經取得了很大的進步,但這并不能從根本上消除HBV感染[22]。因此,亟需尋找和開發新的抗HBV靶點和藥物。越來越多的證據表明miRNAs在HBV感染中發揮重要的調控作用。MiR-27a在多種生物學過程中發揮重要作用,包括基因多態性、腫瘤發生、增殖、細胞凋亡、侵襲、遷移和血管生成[23]。在患肝癌的肥胖患者中,miR-27a通過靶向FOXO1促進肝癌細胞的增殖[24]。MiR-27a在肝癌組織和肝癌細胞系中表達上調,通過調節PPAR-γ的表達促進肝癌細胞增殖,并作為癌基因在肝癌細胞中發揮重要作用[25]。然而,miR-27a在HBV感染中的潛在作用和分子機制仍未明確。
本研究發現在HBV感染的肝癌細胞Huh7中miR-27a表達水平顯著降低;隨著miR-27a表達水平的升高,Huh7細胞中HBV RNA、HBV DNA、HBeAg和HBsAg等HBV復制和基因表達的指標顯著降低;抑制內源性miR-27a的表達能夠促進HBV的復制和表達。提示miR-27a可能是一種潛在的HBV復制抑制因子。
MiRNAs調控HBV的機制主要分為兩類:一類是miRNAs直接靶向作用于HBV的轉錄本,如 miR-125a-5p、miR-199a-3p、miR-210、miR-1231,其中miR-125a-5p和miR-199a-3p靶位點位于表面蛋白和聚合酶重疊的編碼區域,而miR-210的靶位點位于pre-s1編碼區域,miR-1231靶向 HBV 核心蛋白 mRNA[12,26]。第二類是通過作用于相關的細胞蛋白影響HBV生命周期,如miR-146a靶向 flap endonuclease 1[27],miR-802靶向SMARCE1分 子[28],miR-200c靶 向 nuclear factor IA[29],miR-302c-3p 靶 向 BMPR2[30],miR-185-5p 靶向 ELK1分子等[31]。本研究發現miR-27a可以直接靶向HBx 3′ UTR,抑制HBx轉錄和表達,最終抑制HBV的復制與表達。
研究表明,HBV X蛋白可以引起宿主miRNAs的變化,如:HBx 促進miR-29a和miR-143表達,抑制miR-101、miR-122、miR-132、miR-148a、miR-152、let-7和miR-16家族的成員表達[32]。目前HBV影響miRNA表達的分子機制主要有兩種,一種是HBV mRNA通過自身含有的miRNAs互補位點與miRNAs結合,這樣細胞內大量的HBV RNA起到海綿體作用從而抑制其miRNAs發揮作用,例如miR-122和miR-15a[33-34];另一種是轉錄因子參與HBV對miRNAs的調控,如c-Myc參與HBx對miR-15a/16的抑制作用[35]。本研究表明miR-27a可以直接靶向HBx 3′ UTR,提示在HBV感染中,HBx的轉錄產物可能作為“海綿體”與miR-27a結合,從而使miR-27a表達水平降低。
本研究尚有不足之處,由于缺乏體內研究,可能會削弱miR-27抑制HBV復制和表達的證據。HBV感染導致miR-27a表達水平下降,但是有研究表明在肝癌中miR-27a的表達水平升高,因此,miR-27a在HBV相關的肝癌中的變化及臨床意義須要進一步深入研究。
綜上所述,本研究發現miR-27a在HBV感染的Huh7細胞中表達下調;miR-27a通過直接靶向抑制HBx mRNA進而抑制了HBV復制和表達。上述研究結果提示,miR-27a在HBV-宿主的相互作用中發揮重要作用,miR-27a可作為一種潛在的控制病毒感染的治療靶點。

