哈維氏弧菌Bfr 蛋白的原核表達及免疫特性研究
張志強,王苗,杜萬年,劉勃興,康元環,單曉楓,吳同壘,朱國強,史秋梅
(1.河北科技師范學院河北省預防獸醫學重點實驗室,河北 秦皇島 066000;2.吉林農業大學動物科學技術學院,吉林 長春 130000;3.揚州大學,江蘇 揚州 225009)
哈維氏弧菌Vibrio harveyi(又稱哈氏弧菌)廣泛引起多種海洋魚類、甲殼類動物感染發病,造成重大經濟損失[1],是重要的漁業致病菌。目前,多用抗生素和化學藥物處理哈維氏弧菌感染發病的動物,治療效果并不顯著,且導致水體污染和菌株耐藥現象極其普遍[2]。目前針對哈維氏弧菌疫苗的開發工作已經開展,發現哈維氏弧菌菌蛻成分作為免疫成分能較好地預防哈維氏弧菌感染;亞單位疫苗研究證實,細菌的外膜蛋白OmpK、OmpU 和OmpW具有較好的免疫保護效果[3-5];有一部分在其他病原上免疫效果優異的蛋白,如硫氧還蛋白也可作為哈維氏弧菌的優良候選疫苗[6]。這些研究為哈維氏弧菌疫苗的開發提供了重要參考。
Bfr 是細菌外膜表面編碼的儲鐵蛋白。致病菌通過Bfr 蛋白將攝取的鐵儲存起來,用于應對宿主體內鐵貧瘠的環境[7]。研究發現,細菌Bfr 蛋白是一種T 細胞抗原,能刺激機體IFN-γ 產生以及淋巴細胞增殖[8-10],設計表達Bfr 蛋白的核酸疫苗能誘導產生較高水平的抗體[10]。揭示了Bfr 作為疫苗的潛在價值。目前有關哈維氏弧菌Bfr 蛋白的研究尚未見報道。本研究以Bfr 蛋白為研究對象,利用原核表達系統表達哈維氏弧菌Bfr 蛋白,以探索其免疫特性。
1 材料與方法
1.1 材料
1.1.1 菌株、載體與實驗動物
哈維氏弧菌菌株VHCL-1 分離自患病的半滑舌鰨Cynoglossus semilaevis,保存于河北科技師范學院動物傳染病研究室。原核表達載體pET-32a 由本實驗室保存。SPF 級6~8 周齡昆明小鼠購自北京維通利華實驗動物技術有限公司。實驗用斑馬魚Danio rerio 體長約3~5 cm,購自秦皇島某花鳥市場,實驗適應飼養2 周。
1.1.2 主要試劑
Ex Taq DNA 聚合酶、限制性內切酶和T4DNA連接酶購自寶生物工程(大連)有限公司;小鼠抗His標簽單克隆抗體(His-MAb)、HRP 標記山羊抗小鼠IgG 抗體(HRP-IgG)、異丙基-β-D-硫代半乳糖苷(IPTG)及Ni2+argose 填料購自康維世紀公司;DH5α 和BL21 感受態細胞由河北科技師范學院動物傳染病研究室制備保存;細菌基因組DNA 提取試劑盒和質粒小提取試劑盒購自北京艾德萊生物科技有限公司。
1.2 方法
1.2.1 bfr 基因的克隆
參考細菌基因組DNA 提取試劑盒說明書提取哈維氏弧菌VHCL-1 的基因組。根據GenBank 上已公布的哈維氏弧菌bfr 基因序列(GenBank 登錄號:CP 025796.1),分別設計含BamH I 和Sal I 酶切位點的上下游引物,上游引物P1:5'-CGGGATCCATGAAAGGCGATCCAATCATAATCC-3'(BamH I),下游引物P2:5'-GCGTCGACACTCTTCATCAACGTAT TGCGCTTG-3'(Sal I)。以哈維氏弧菌VHCL-1 的基因組為模板鏈擴增bfr 基因。PCR 反應體系為50 μL,反應條件為95℃5 min;94℃30 s,54℃30 s,72℃1 min,30 個循環;72℃延伸10 min,擴增的目的片段用純化試劑盒純化,再將純化產物與載體PMD18-T 連接,16℃連接2 h 后轉化至DH5α 感受態細胞,經LB 液體培養1 h 后,取200 μL 涂布于平板培養基,經過夜培養后,挑取單菌落進行PCR驗證,并送至上海生工生物科技有限公司測序[11,12]。
1.2.2 生物信息學分析
用DNA STAR 的MegAlign 軟件將所測菌株的bfr 基因序列與GenBank 中已知不同細菌的bfr 基因序列進行Blast 對比分析,將已測序的菌株序列進行系統進化樹分析。
1.2.3 表達載體pET-32a-bfr 的構建
對測序正確的pMD-18T-bfr 和pET-32a 載體用BamH I 和Sal I 雙酶切后,經T4 連接酶連接并轉入大腸桿菌BL21 感受態細胞中。挑取單克隆進行PCR 驗證,陽性克隆參照質粒提取試劑盒說明書提取質粒,進行雙酶切驗證和序列測定,保證構建的表達載體pET-32a-bfr 在表達中不發生突變和移碼。
1.2.4 rBfr 蛋白的誘導表達
參照文獻[11]描述的方法,將含pET-32a-bfr 重組質粒的大腸桿菌BL21 接種于LB 液體培養基后,當OD600達到0.4~0.6 時,向培養基中加入1 mmoL/L誘導劑IPTG 進行誘導表達,以不誘導的含pET-32abfr 的BL21 為對照組。37℃再次震蕩培養4 h 后離心收集菌液,PBS 洗凈后水煮法提取細菌蛋白進行十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳分析。將重組表達菌體進行擴大培養,超聲破碎菌體,離心分離沉淀、上清,利用SDS-PAGE 方法分析目的蛋白在沉淀和上清中的含量,用Ni2+親和層析方法純化蛋白,并用BCA 蛋白濃度檢測試劑盒測定純化蛋白濃度,于-70℃保存。
1.2.5 Western blot 分析
參照文獻[12]描述的方法,SDS-PAGE 電泳后,將蛋白膠轉移至PVDF 膜,用鑷子取出PVDF 膜浸泡在含5%脫脂奶粉(w/v)的封閉液中,浸泡條件為:4℃、12 h。TBST 洗液清洗3 次,每次清洗3 min。加鼠抗His-Tag 單克隆抗體(體積比1∶1000 稀釋)后室溫放至搖床孵育2 h,TBST 漂洗后加入HRP-Tag 山羊抗鼠IgG(體積比1∶5000 稀釋)室溫放至搖床孵育2 h,TBST 漂洗后使用BAD 顯色液在避光條件下顯色5 min,ddH2O 終止反應,拍照觀察結果。
1.2.6 rBfr 蛋白免疫小鼠抗體水平檢測
參照文獻[12]描述的方法,利用小鼠模型評價rBfr 的免疫效果。將40 只健康昆明鼠隨機分成兩組,每組20 只。實驗組以純化的rBfr 蛋白作為免疫原,分別于第0 d、15 d 和30 d 進行免疫,首免以50 g弗式完全佐劑乳化的蛋白皮下注射免疫,二免和三免蛋白用弗氏不完全佐劑免疫;在每次免疫對應的時間點,對照組小鼠免疫等體積乳化的PBS;在小鼠免疫前后不同時間,尾尖采取小鼠血液并分離血清,以rBfr 蛋白作為包被抗原,利用間接ELISA 方法檢測小鼠血清中抗體的效價,以陰性血清OD450平均值加3 倍標準差作為陰陽性判定標準。
1.2.7 哈維氏弧菌感染斑馬魚實驗
將60 尾斑馬魚隨機分成6 組,實驗組5 組,分別以不同濃度的哈維氏弧菌腹腔接種斑馬魚,接種劑量為10 μL/尾,接種菌量分別為1010cfu、109cfu、108cfu、107cfu 和106cfu,測定哈維氏弧菌VHCL-1菌株對斑馬魚的致病力。
2 結果與分析
2.1 bfr 基因擴增及同源性分析
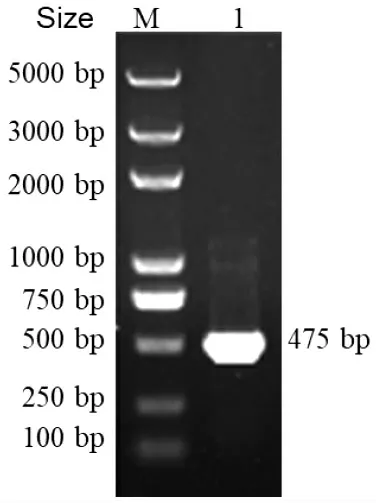
圖1 bfr 基因的克隆Fig.1 Cloning of bfr gene
PCR 擴增bfr 基因的結果見圖1。由圖1 可知,于475 bp 處出現特異性條帶,條帶大小與預測的bfr 基因開放閱讀框大小一致。將bfr 基因片段克隆到pMD18-T 載體上進行測序。由圖2 可知,弧菌屬各成員細菌間bfr 氨基酸同源性均在80%以上,其中與沙門菌Salmonella 和大腸桿菌Escherichia coli的氨基酸序列同源性分別達67%和68%,表明Bfr蛋白高度保守。
2.2 重組蛋白rBfr 的表達驗證
SDS-PAGE 凝膠電泳分析重組蛋白顯示,在約25 ku 處表達出rBfr 目的蛋白,而空載對照組在該位置處無明顯條帶(圖3-A),Western blot 分析結果也同樣于25 ku 處出現目的條帶(圖3-B),表明rBfr 重組蛋白成功表達。
2.3 rBfr 重組蛋白可溶性分析及純化
對rBfr 重組蛋白進行可溶性分析,結果顯示(圖4-A),菌體超聲破碎上清和沉淀中rBfr 均有表達,表明表達的rBfr 蛋白部分可溶。而取誘導表達上清進行純化,在25 ku 處純化出目的蛋白(圖4-B),測定蛋白濃度為0.36 mg/mL。
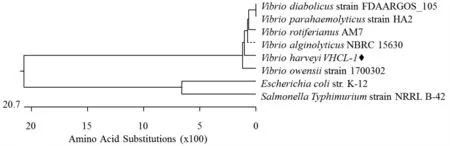
圖2 不同菌株bfr 氨基酸同源性分析Fig.2 Homology analysis of bfr from Vibrio harveyi and other bacterial strains
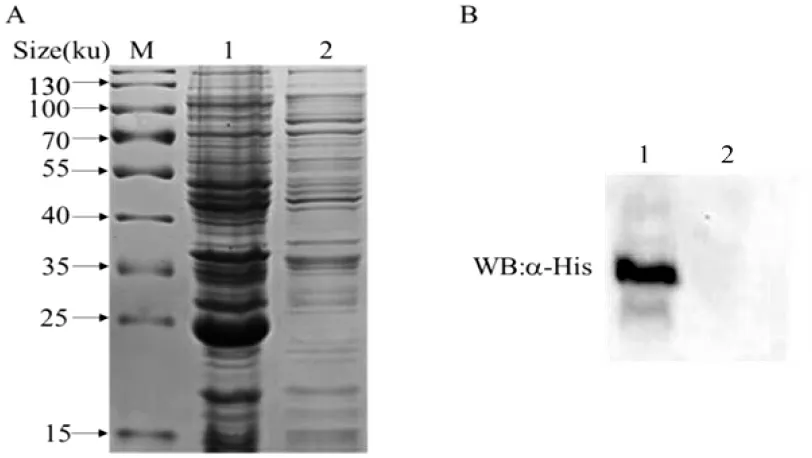
圖3 rBfr 蛋白的表達驗證Fig.3 Analysis of prokaryotic expression of rBfr
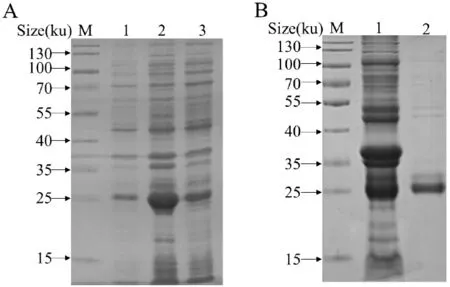
圖4 rBfr 蛋白的純化Fig.4 Analysis of purification of rBfr from E.coli
2.4 rBfr 蛋白免疫小鼠實驗結果
將rBfr 蛋白免疫小鼠4 次采集的血清按1∶100 進行稀釋,以500 ng/mL 重組蛋白包被酶標板,羊抗鼠IgG-HRP 二抗進行1∶5000 倍稀釋。結果顯示(圖5),在二免后,免疫小鼠即產生較高水平的特異性抗體,在加強免疫后達到最高水平,表明rBfr蛋白具有優良的免疫原性。
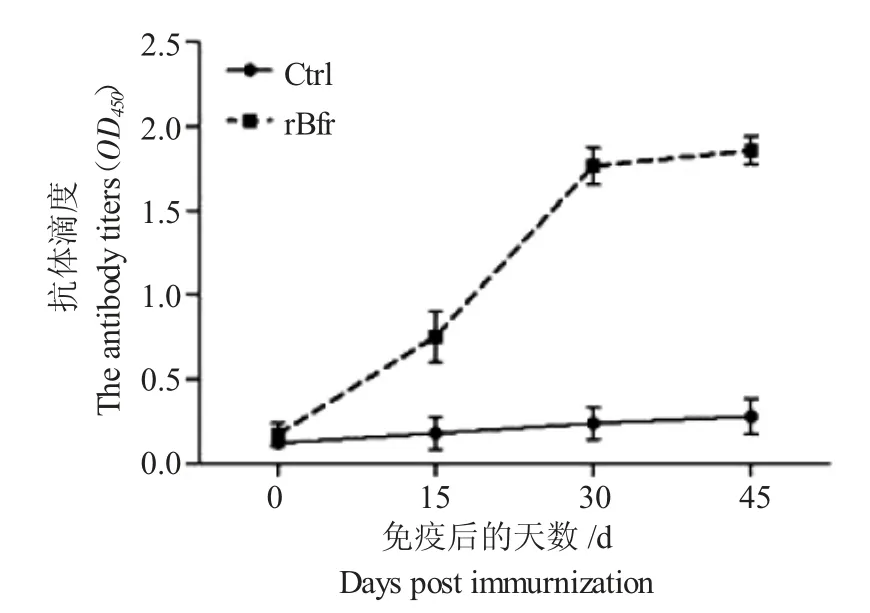
圖5 免疫小鼠抗體水平變化Fig.5 The changes in specific antibody levels of mice induced by rBfr
2.5 哈維氏弧菌感染斑馬魚實驗結果
將不同濃度的哈維氏弧菌腹腔感染斑馬魚,結果僅有最高劑量組即1010cfu 接種劑量組斑馬魚死亡2 尾,其余組均無死亡,表明哈維氏弧菌對斑馬魚的致病力較低。
3 討論
哈維氏弧菌對水產養殖業危害十分嚴重,感染宿主范圍廣泛,日益引發關注[13]。然而,目前對哈維氏弧菌的研究尚處于起步階段,遠不如對遲緩愛德華菌Edwardsiella tarda、鰻弧菌Vibrio anguillarum以及嗜水氣單胞菌Aeromonas hydrophila 的研究深入[14]。疫苗的應用能夠使免疫動物獲得針對特定病原的免疫力,是疫病防治的高效手段,在水產疫病防控中,遲緩愛德華菌、鰻弧菌和嗜水氣單胞菌等疫苗的使用證實了疫苗在水產養殖業的應用前景[15]。針對哈維氏弧菌尚無商品化疫苗這一現狀,本研究借鑒其它病原的研究成果,以哈維氏弧菌儲鐵蛋白為研究對象,嘗試利用原核表達和動物模型評估其免疫效力。
Bfr 蛋白的免疫特性已在大腸桿菌和沙門氏菌等諸多細菌中得到證實[16]。本研究中,首先對該蛋白的保守性進行分析,發現Bfr 蛋白在弧菌屬細菌成員間高度保守,與其它腸桿菌科細菌也具有較高的同源性(可達67%以上),揭示了該蛋白可作為弧菌屬致病菌的疫苗候選蛋白。Bfr 蛋白成功在原核中表達和純化,表達的Bfr 蛋白重組菌培養物經過離心后,菌體沉淀為棕紅色,而空白對照組菌體為黃白色,猜測可能與Bfr 蛋白結合有色三價鐵離子有關[17]。
本研究將純化的Bfr 蛋白免疫小鼠,激發小鼠產生高水平的特異性抗體,表明該蛋白具有較高的免疫原性。在接下來的研究中,筆者嘗試建立哈維氏弧菌感染小鼠模型以評估rBfr 蛋白的免疫保護效果。然而,接種哈維氏弧菌的小鼠并無死亡和疾病癥狀,表明哈維氏弧菌對小鼠不具有致病性,與前人研究一致[13]。斑馬魚是漁業疾病的經典模型,在多種病原致病機制研究中得到廣泛應用[18,19]。本研究試圖建立哈維氏弧菌感染斑馬魚模型,結果并不理想,接種斑馬魚并未有明顯的死亡和病變。但是,用哈維氏弧菌過夜培養物上清成分接種斑馬魚,發現接種的斑馬魚全部死亡,表明哈維氏弧菌胞外產物具有致病性,與已有的研究一致[20,21]。針對此現象分析認為,哈維氏弧菌是海水病原,生長和增殖需要一定的鹽度,所以其致病力和試驗結果也會受外界環境因素的影響[22],有待于進一步研究確認。
本研究確定了哈維氏弧菌Bfr 蛋白具有優良的免疫原性和潛在的應用價值,為研制哈維氏弧菌疫苗提供了參考。

