細胞免疫功能指標與新型冠狀病毒肺炎患者病情的相關性
連利霞,孔存權,劉鴻雁,朱偉彥
(河南省人民醫院/鄭州大學人民醫院 腫瘤中心,河南 鄭州 450003)
新型冠狀病毒肺炎(corona virus disease 2019,COVID-19)是由新型冠狀病毒感染引起的肺炎[1]。多數COVID-19患者預后較好,少數可進展為重癥或危重癥,甚至出現急性呼吸窘迫綜合征、膿毒癥休克、多器官功能障礙綜合征等嚴重并發癥,預后差[2]。因此,預防COVID-19進展為重癥或危重癥是提高治愈率的關鍵環節。老年及合并慢性基礎疾病是影響預后的主要因素,但仍難完全解釋COVID-19患者病情加重和死亡的原因。有研究提出,免疫功能紊亂和細胞因子風暴可能扮演著更重要的角色[3]。目前多以外周血淋巴細胞進行性下降、炎癥因子水平進行性上升等免疫炎癥指標作為重型或危重型的臨床預警指標。有研究探討了COVID-19患者的免疫功能變化[4],但目前比較不同類型患者的細胞免疫功能的研究較少。基于此,本研究分析細胞免疫功能指標與COVID-19患者病情的相關性。
1 資料與方法
1.1 臨床資料收集2020年1月22日至3月9日河南省人民醫院收治的51例COVID-19患者的臨床資料,包括性別、年齡、初發癥狀、基礎疾病、分型、實驗室檢查等指標。根據《新型冠狀病毒肺炎診療方案(試行第七版)》對患者進行臨床分型。其中普通型23例,重型17例,危重型11例。將普通型患者納入對照組(23例),將重型或危重型患者納入觀察組(28例)。
1.2 納入標準和排除標準(1)納入標準:采集鼻咽分泌物標本,經嚴重急性呼吸綜合征冠狀病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)核酸檢測試劑盒(熒光PCR法)檢測確診。(2)排除標準:①入院前確診,入院時結果已轉陰;②資料缺失。
1.3 觀察指標采集患者靜脈血約5 mL至EDTA抗凝管中。(1)采用Sysmex XN-1000自動血液分析儀及配套試劑檢測C反應蛋白(C reactive protein,CRP)、血常規,包括白細胞計數(white blood cell count,WBC)、中性粒細胞計數(neutrophilic granulocytes,NEU)、單核細胞計數(monocyte count,MONO)、總淋巴細胞計數(lymphocyte count,LYM)。(2)采用FACSCANTO流式細胞儀(美國BD公司)檢測T淋巴細胞亞群,試劑盒購自青島瑞斯凱爾生物科技有限公司。操作方法:①于標本管中加入25 μL緩沖液和25 μL標本,離心10 min,轉速為3 000 r·min-1,離心半徑為15 cm;②加入捕獲微球抗體、檢測抗體各25 μL,震蕩孵育2 h,加入25 μL SA-PE,震蕩孵育30 min;③加入洗滌緩沖液離心5 min,轉速為1 800 r·min-1,離心半徑15 cm,倒出液體,加入配制洗滌緩沖液,渦旋10 s,上機檢測,檢測指標包括T淋巴細胞計數、NK細胞計數、B細胞計數、CD4+T淋巴細胞計數、CD4+T淋巴細胞比率、CD8+T淋巴細胞計數、CD8+T淋巴細胞比率、CD3+T淋巴細胞比率、CD4+/CD8+T淋巴細胞比值、CD19+細胞比率、CD3-CD16+CD56+細胞比率等免疫細胞亞群。

2 結果
2.1 一般資料和細胞免疫指標與對照組比較,觀察組年齡較大,合并基礎疾病占比、WBC、NEU、CD4+/CD8+T淋巴細胞比值較高,CD8+T淋巴細胞比率較低(P<0.05);兩組性別、MONO、LYM、CRP、T淋巴細胞計數、NK細胞計數、B細胞計數、CD4+T淋巴細胞計數、CD8+T淋巴細胞計數、CD3+T淋巴細胞比率、CD4+T淋巴細胞比率、CD19+細胞比率、CD3-CD16+CD56+細胞比率比較,差異無統計學意義(P>0.05)。見表1。
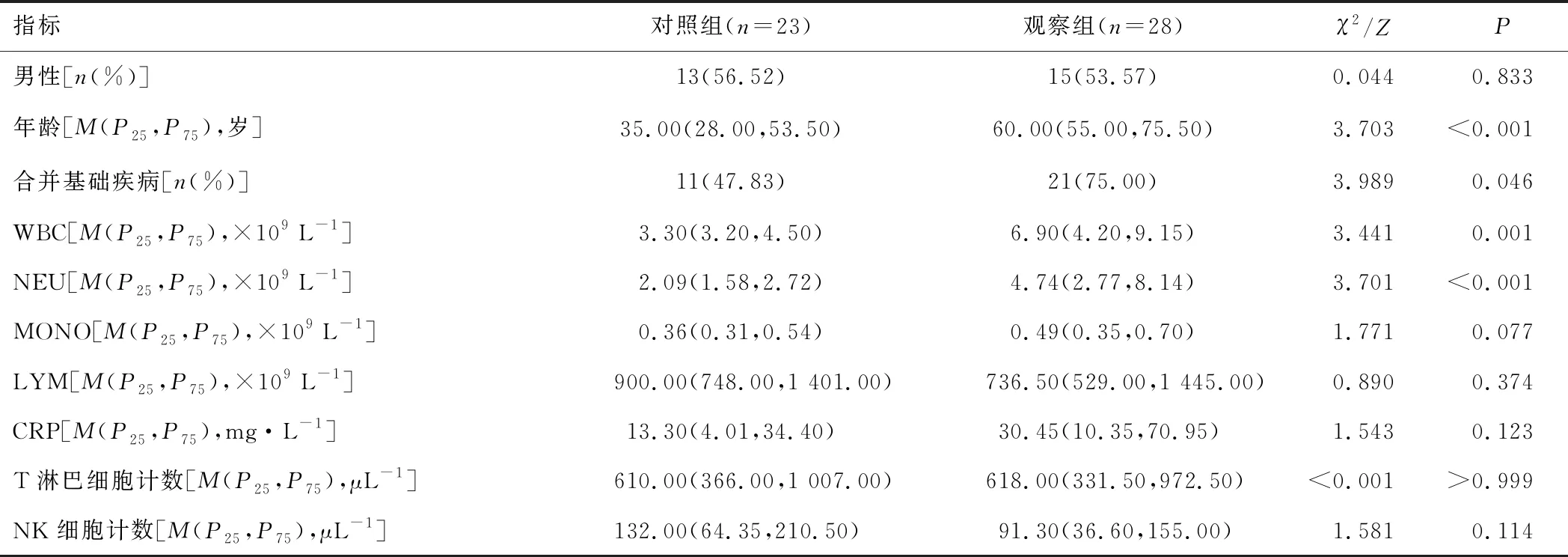
表1 兩組一般資料、細胞免疫指標比較
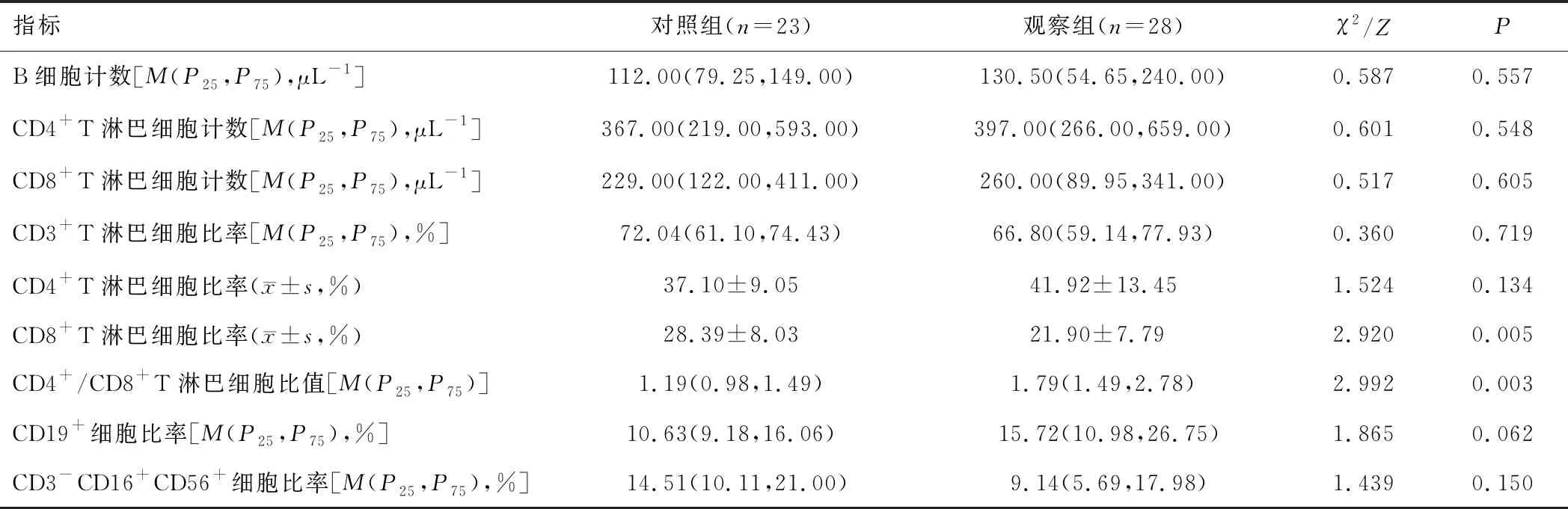
表1(續)
2.2 細胞免疫功能與COVID-19患者病情的相關性以兩組差異有統計學意義(P<0.05)的指標為自變量,以患者病情嚴重程度為因變量,采用logistic回歸模型進行分析,結果顯示未合并基礎疾病和較高的CD8+T淋巴細胞比率為保護因素,而較高的CD4+/CD8+T淋巴細胞比值為危險因素(P<0.05)。見表2。
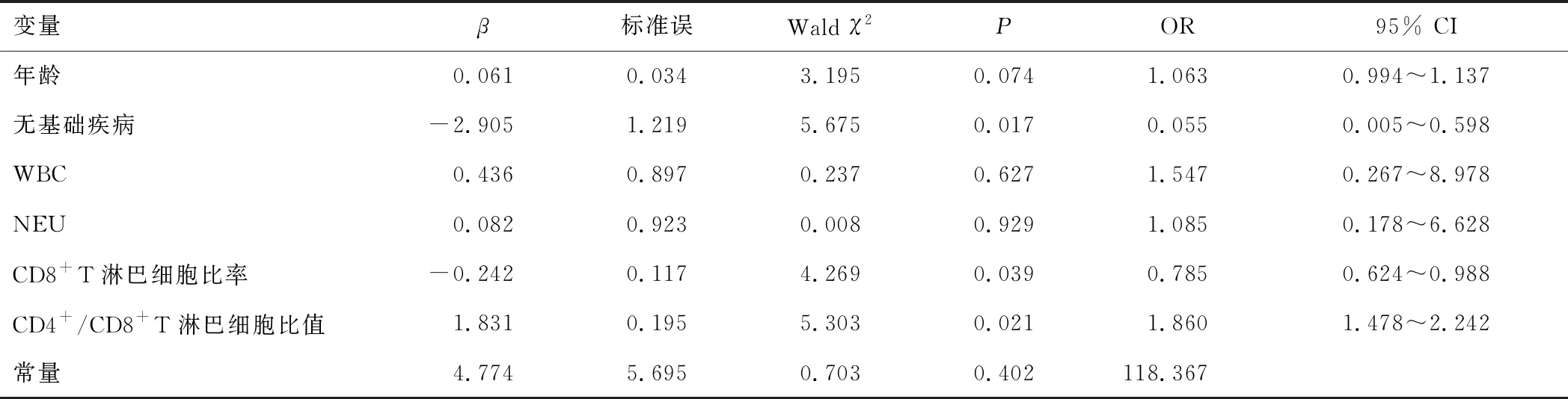
表2 COVID-19患者病情相關因素的logistic回歸分析
3 討論
SARS-CoV-2引發以呼吸系統感染為主要表現的傳染病,即為COVID-19。SARS-CoV-2主要通過飛沫和接觸傳播,傳染性較強,傳播速度快,人群普遍易感。人體免疫可分為固有免疫和適應性免疫。T淋巴細胞參與適應性免疫過程,T細胞分為CD4+細胞和CD8+細胞。CD4+細胞主要合成和分泌細胞因子,對免疫應答起輔助和調節作用。CD8+細胞通過細胞毒作用特異性殺傷病毒等胞內感染病原體所感染的靶細胞和體內突變細胞。Wang等[5]研究表明,COVID-19患者淋巴細胞計數減少,SARS-CoV-2可能主要作用于淋巴細胞,且老年普通型COVID-19患者進展為重癥的風險更高。CD4+/CD8+失衡、CD8+異常激活、調節性T淋巴細胞數目減少所致的免疫抑制效應是感染性疾病發生的主要原因[6]。
本研究結果顯示,相對普通型患者,重癥或危重癥COVID-19患者除年齡較大、合并基礎疾病占比較高外,還表現為WBC、NEU水平升高,在T細胞亞群指標方面主要是CD8+細胞比率的下降和CD4+/CD8+T淋巴細胞比值的升高。這提示了重癥或危重癥COVID-19患者存在外周血炎癥細胞數量的增加和細胞免疫功能亢進。細胞免疫功能亢進可能是導致COVID-19病情加劇的病理機制之一。通過本研究結果可見,普通型COVID-19患者表現為明顯的免疫抑制狀態,這與SARS-CoV-2感染密切相關。人類免疫缺陷病毒、丙型肝炎病毒、皰疹病毒、腺病毒等感染均會導致機體免疫功能受損[7-8]。針對冠狀病毒感染導致的嚴重急性呼吸綜合征(severe acute respiratory syndrome,SARS)的研究顯示,SARS患者在感染早期會出現WBC、粒細胞計數的下降和粒細胞百分比的升高以及CD3+、CD4+和CD8+細胞絕對數的下降,而細胞免疫功能會隨著病情的好轉逐漸改善[9-10]。COVID-19患者也呈現出了類似的變化趨勢。感染SARS-CoV-2后,患者處于免疫抑制狀態,故在疾病治療中應高度重視針對繼發性感染的預防和控制工作。
本研究結果顯示,較低的CD8+T淋巴細胞比率和較高的CD4+/CD8+T淋巴細胞比值會提升普通型COVID-19進展為重癥或危重癥的風險。低CD8+T淋巴細胞比率可能提示著肺等靶器官中的淋巴細胞浸潤和免疫損害程度加劇。在病毒感染人體細胞后,機體能夠激活自身免疫系統來清除細胞內的病毒,甚至能通過細胞自噬來直接吞噬、降解入侵的病毒[11]。針對COVID-19患者的尸檢結果顯示:患者的肺泡腔內可見漿液、纖維蛋白性滲出物及透明膜形成,肺泡隔血管充血、水腫,肺組織可出現灶性出血、壞死、間質纖維化,滲出細胞以單核細胞和巨噬細胞為主,可見淋巴細胞浸潤;脾明顯縮小,脾和淋巴結內的CD4+和CD8+T淋巴細胞數量明顯減少;骨髓三系細胞數量減少。這與SARS的細胞免疫功能變化類似[12-13]。因此,COVID-19患者一旦出現外周血CD8+T淋巴細胞比率的下降,則提示著肺內免疫損傷程度的加劇,病情進展至重癥或危重癥的風險上升。
CD4+/CD8+T淋巴細胞比值的失衡會導致機體處于免疫過激狀態。在免疫過激狀態下,免疫細胞會分泌更高水平的干擾素、白細胞介素、趨化因子、集落刺激因子、腫瘤壞死因子等炎癥因子。以上炎癥因子又會趨化和激活更多的免疫細胞并分泌更多的細胞因子。這種正反饋循環最終形成細胞因子風暴,導致肺內大量正常細胞被殺死,直到患者出現呼吸衰竭甚至死亡。這種細胞因子風暴也是導致SARS、甲型H1N1流感、禽流感等呼吸道傳染性疾病患者發生急性呼吸窘迫綜合征及預后不良的重要因素[14]。在本研究中,CD4+/CD8+T淋巴細胞比值升高可能是CD8+T淋巴細胞下降所致。一項針對武漢大學中南醫院41例 COVID-19患者的研究顯示,COVID-19重癥率和病死率分別高達32%、15%,明顯高于武漢地區平均水平,這可能與該研究中發生細胞因子風暴的患者占比較高有關[15]。糾正T淋巴細胞亞群失衡,從而減少細胞因子風暴的產生成為了治療COVID-19的新思路。近期先后出現了采用間充質干細胞移植術[16]及應用腎素-血管緊張素系統抑制劑[17]調節COVID-19患者免疫功能的研究。總之,在COVID-19的治療中,應重視免疫過激狀態,采取有效的手段調節患者的免疫功能,以預防和控制細胞因子風暴的發生,阻止病情向重癥或危重癥進展。
合并基礎疾病、CD8+T淋巴細胞比率、CD4+/CD8+T淋巴細胞比值是重癥或危重癥COVID-19發生的影響因素。對合并基礎疾病的患者進行積極治療并采取有效手段調節患者的免疫功能,有助于促進患者康復。

