外源施加生長素吲哚-3乙酸對丹參根系形態和有效成分積累的影響
鄒海燕,劉麗芬,楊春洪,昝雄云,王幼平,張順倉
揚州大學生物科學與技術學院,江蘇 揚州 225009
丹參Salvia miltiorrhizaBge.是唇形科鼠尾草屬植物,為我國傳統中藥材之一,其有效成分包括水溶性的酚酸類成分和脂溶性的丹參酮類成分,主要用于治療心血管系統疾病[1-2],具有抑菌、抗炎、保護肝臟[3-4]、抗腫瘤[5-6]等作用。丹參是以根莖入藥的中藥材,根系形態和有效成分含量是影響藥材產量和品質的重要因素。目前丹參次生代謝調控方面的研究已取得許多突破性的進展[7],但其根系發育和次生代謝有無關聯性,2個生理過程對同一外源誘導因子的不同響應目前鮮有報道。
生長素是最早被發現的植物內源激素,主要的活性形式是吲哚-3乙酸(indole-3-acetic acid,IAA),在植物種子休眠、細胞的伸長、植物向性及生長發育等多個生理過程中發揮作用[8-9]。近年來的研究表明,生長素是影響植物側根發育的主要植物激素之一,參與了從植物側根建成細胞的選擇到側根露出的整個側根發育過程[10]。另外,生長素對植物次生代謝產物的合成積累同樣具有調控作用,能顯著提高揮發油[11]、花青素[12]、類黃酮[13]等在植物中的含量。目前有關生長素對丹參根系發育和有效成分積累的調控作用及機制知之甚少。本研究設置不同的IAA質量濃度,分別采用葉面噴施和根部澆灌的方式處理丹參植株,初步探究IAA對丹參根系形態、酚酸類成分含量及丹參酮類成分含量的綜合性調控作用。
1 材料與儀器
1.1 材料與試劑
丹參種子于2018年8月取自陜西天士力植物藥業有限責任公司商洛藥材基地,經揚州大學生物科學與技術學院吳曉霞副教授鑒定為唇形科鼠尾草屬植物丹參Salvia miltiorrhizaBge.。IAA購自生工生物工程(上海)股份有限公司,色譜級甲醇和乙腈購自美國TEDIA公司,對照品丹酚酸A(批號96574-01-5)、迷迭香酸(批號20283-92-5)、丹酚酸B(批號115939-25-8)購自上海源葉生物科技有限公司,質量分數大于98%;隱丹參酮(110852200305)、丹參酮ⅡA(批號110766-200417)、丹參酮I(批號0867-200104)購自中國食品藥品檢定研究院。
1.2 儀器
Agilent 1260型高效液相色譜儀(美國Agilent公司),5804R型高速冷凍離心機(德國Eppendorf公司),SK5210HP型超聲清洗機(上海人和科學儀器有限公司),SHB-III循環水式多用真空泵(鄭州長城科工貿有限公司),?20 ℃低溫冰箱(青島海爾集團),可調式微量移液器(德國Eppendorf公司),101A-3型干燥箱(上海市儀器總廠),BS223S電子天平(德國Sartorius公司)。
2 方法
2.1 丹參幼苗的培養和IAA處理
將丹參種子直播于營養缽中(缽口直徑21 cm,缽高21 cm),放入植物培養室內進行培養,出苗60 d后選取長勢一致的幼苗,20株/組共10組用于IAA處理。處理分為葉面噴施和根部澆灌2種,均設置5個IAA質量濃度(0、5、10、20、30 mg/L)。各組處理均在同一植物培養室中進行,植物培養室光暗周期設定為16/8 h,溫度設定為25℃/20℃晝夜變溫。IAA處理每周1次,處理4次后于正常培養條件下繼續培養2周,收集樣品后進行各個指標的測定。
2.2 地上部分和根系形態指標測定
用直尺測量株高、冠幅、根長,用游標卡尺測定蘆頭、一級側根和二級側根的直徑,用電子天平測定植株地上部分和根鮮質量,并記錄各處理組植株的葉片數、一級側根數和二級側根數。
2.3 丹參酚酸類和丹參酮類成分的HPLC測定[14]
2.3.1 供試品溶液的制備 將樣品于45 ℃烘至恒定質量,研缽中磨碎,過0.45 mm篩,精確稱取粉末0.05 g,加 6 mL甲醇-水(7︰3)超聲提取45 min,12 000×g離心10 min后取上清,用提取液補足原體積后過0.22 μm濾膜用于HPLC成分測定。
2.3.2 對照品溶液的制備 測定的酚酸類成分包括迷迭香酸、丹酚酸B和丹酚酸A,丹參酮類成分包括隱丹參酮、丹參酮I和丹參酮IIA。精確稱量對照品粉末,水溶性成分對照品用甲醇-水(7︰3)溶解,脂溶性成分對照品用甲醇溶解。各對照品溶液按比例混合,使混合液中迷迭香酸、丹酚酸B、丹酚酸A、隱丹參酮、丹參酮I和丹參酮IIA的終質量濃度分別為0.125、0.685、0.130、0.048、0.050、0.042 5 mg/mL。
2.3.3 色譜條件 色譜條件為以乙腈(A)和0.01%磷酸水溶液(B)為流動相進行二元梯度洗脫:0~10 min,5%~20% A;10~15 min,20%~25% A;15~25 min,25%~20% A;25~28 min,20%~30% A;28~40 min,30% A;40~45 min,30%~45% A;45~50 min,45%~50% A;50~58 min,50%~58% A;58~67 min,58%~50% A;67~70 min,50%~60% A;70~80 min,60%~65% A;80~85 min,65%~100%A,體積流量1.0 mL/min,柱溫30 ℃。色譜圖見圖1。
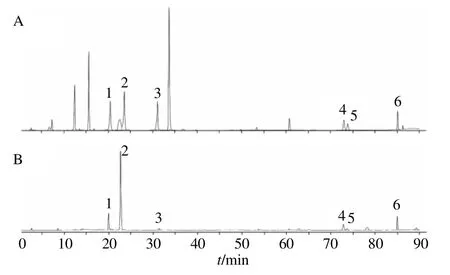
圖1 對照品 (A) 和丹參樣品 (B) 的HPLC圖Fig.1 HPLC chromatogram of standards (A) and samples(B)
2.3.4 方法學考察 以葉面噴施對照組樣品為材料進行方法學考察,精密度、穩定性、重復性試驗RSD值均小于3%,6個成分的平均加樣回收率為96.59%~99.48%,RSD值為0.92%~1.86%,均符合實驗要求。
2.4 數據處理與分析
酚酸類成分含量、丹參酮類成分含量、根系形態指標等的差異顯著性分析利用PASW Statistics 25進行,每組實驗從處理的20株中隨機選取6株作為生物學重復(n=6),數據以±s表示,P<0.05為差異顯著。
3 結果與分析
3.1 不同質量濃度的IAA及施加方式對丹參地上部分形態學指標的影響
測定了不同處理組中葉片數、冠幅、株高和地上部分鮮質量(圖2)。結果表明,不同質量濃度的IAA噴施處理后,只有20 mg/L處理組中葉片數顯著增加(P<0.05),為對照組(0 mg/L)中的1.23倍。較高濃度的IAA噴施增加了丹參植株的冠幅,如20 mg/L和30 mg/L處理組中冠幅分別為對照組的1.24倍和1.30倍。株高在IAA噴施處理后變化不大,只在30 mg/L處理組得到了顯著的提高(P<0.05)。地上部分鮮質量隨著IAA質量濃度的增加呈現先降低后升高的趨勢,30 mg/L處理組為對照組的1.21倍。一定質量濃度的IAA澆灌處理后,上述形態學指標值也得到了一定程度的提高,如5 mg/L處理組中葉片數是對照組的1.93倍。10 mg/L處理組中冠幅和地上部分鮮質量分別是對照組的1.40倍和1.35倍。
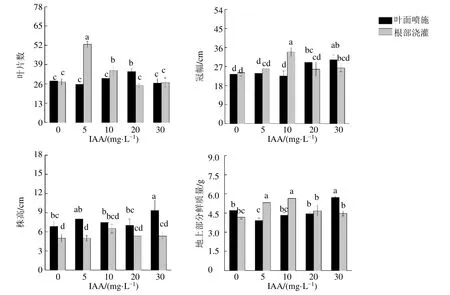
圖2 不同質量濃度的IAA及施加方式對丹參地上部分形態學指標的影響 (n=6)Fig.2 Effects of different concentrations of IAA and application methods on acrial part morphology of S.miltiorrhiza (n=6)
3.2 不同質量濃度的IAA及施加方式對丹參根系形態的影響
IAA處理顯著改變了丹參的根系形態(圖3)。IAA噴施處理后,一級側根數在5 mg/L處理組和20 mg/L處理組中顯著降低(P<0.05),分別為對照組的45.50%和72.75%。一級側根直徑和一級側根長度則顯著提高(P<0.05),如20 mg/L處理組中一級側根直徑和一級側根長度分別為對照組的1.36倍和1.18倍。IAA噴施處理顯著(P<0.05)提高了丹參的二級側根數目,如20 mg/L處理組中二級側根數為對照組的2.00倍,二級側根直徑和長度則無明顯變化。蘆頭直徑受IAA噴施處理的影響不大,根鮮質量則在處理后顯著提高(P<0.05),如20 mg/L處理組中根鮮質量為對照組的1.55倍。IAA澆灌處理后,一級側根數目無顯著變化(P>0.05),一級側根直徑和長度則顯著提高(P<0.05),如10 mg/L處理組中一級側根直徑和一級側根長度分別為對照組的1.19倍和2.11倍。一定質量濃度的IAA澆灌處理同樣促進了丹參二級側根的發育,如5 mg/L處理組中二級側根數是對照組的1.54倍,20 mg/L處理組中二級側根直徑是對照組的1.40倍,30 mg/L處理組中二級側根長度是對照組的1.72倍。除個別處理組外,IAA澆灌處理對丹參蘆頭直徑和根鮮質量影響不大。
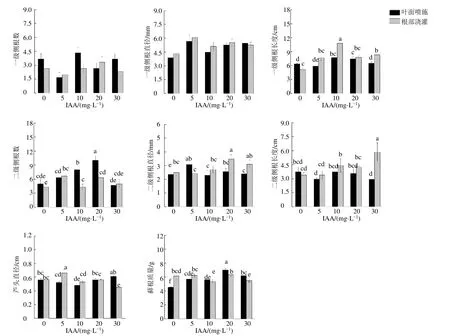
圖3 不同質量濃度的IAA及施加方式對丹參根系形態的影響 (n=6)Fig.3 Effect of different concentrations of IAA and application methods on root morphology of S.miltiorrhiza (n=6)
3.3 不同質量濃度的IAA及施加方式對丹參地上部分酚酸類成分積累的影響
IAA噴施處理大幅提高了丹參地上部分迷迭香酸的含量,4個處理組中迷迭香酸的量分別為對照組中的2.07、3.56、3.28、3.48倍(圖4-A)。丹參地上部分丹酚酸B的積累同樣受IAA噴施處理上調,4個處理組中的含量分別為對照組的1.17、1.61、1.77、1.33倍(圖4-B)。丹酚酸A的量在IAA噴施處理后則未呈現一定的規律性,除20 mg/L處理組外,其余處理組中丹酚酸A的量顯著降低(P<0.05,(圖4-C)。IAA澆灌處理后,5 mg/L處理組和20 mg/L處理中地上部分迷迭香酸的含量顯著提高(P<0.05),分別為對照組的1.40倍和1.54倍(圖4-A)。地上部分丹酚酸B的含量則在IAA澆灌處理后顯著降低(P<0.05),20 mg/L處理組中的含量僅為對照組的42.34%(圖4-B)。地上部分丹酚酸A的含量在IAA澆灌處理后未呈現規律性(圖4-C)。

圖4 不同質量濃度的IAA及施加方式對丹參地上部分迷迭香酸 (A)、丹酚酸B (B)、丹酚酸A (C) 積累的影響 (n=6)Fig.4 Effects of different concentrations of IAA and application methods on accumulation of rosmarinic acid (A),salvianolic acid B (B) and salvianolic acid A (C) in acrial part of S.miltiorrhiza (n=6)
3.4 不同質量濃度的IAA及施加方式對丹參根中酚酸類成分積累的影響
IAA噴施處理有利于丹參根系中酚酸類成分的積累。迷迭香酸的含量在4個IAA濃度處理組中均顯著提高(P<0.05),其中5 mg/L處理組中含量最高,為對照組的1.60倍(圖5-A)。和迷迭香酸的積累情況相似,根系中丹酚酸B和丹酚酸A的含量也在IAA噴施處理后顯著提高(P<0.05),如20 mg/L處理組中丹酚酸B的含量是對照組的1.77倍,30 mg/L處理組中丹酚酸A的含量是對照組的2.42倍(圖5-B、C)。
IAA澆灌處理降低了根系中迷迭香酸的積累量,如30 mg/L處理組中迷迭香酸的含量為對照組的68.35%(圖5-A)。除30 mg/L處理組中含量顯著降低外,IAA澆灌處理對根中丹酚酸B的積累影響不大(圖5-B)。根中丹酚酸A的含量則在IAA澆灌處理后大幅提高,5 mg/L處理組中丹酚酸A的含量為對照組的3.25倍(圖5-C)。
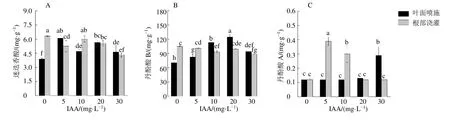
圖5 不同質量濃度的IAA及施加方式對丹參根系迷迭香酸 (A)、丹酚酸B (B)、丹酚酸A (C) 積累的影響 (n=6)Fig.5 Effects of different concentrations of IAA and application methods on accumulation of rosmarinic acid (A),salvianolic acid B (B) and salvianolic acid A (C) in roots of S.miltiorrhiza (n=6)
3.5 不同質量濃度的IAA及施加方式對丹參根中丹參酮類成分積累的影響
IAA噴施處理顯著提高(P<0.05)了丹參根中丹參酮類成分的含量,10 mg/L處理組中隱丹參酮、丹參酮Ⅰ和丹參酮ⅡA的含量分別是對照組的1.83、1.92、1.23倍,20 mg/L處理組中3種成分的含量則分別為對照組的1.83、1.92、1.49倍。與IAA噴施處理相似,IAA澆灌處理同樣大幅提高了丹參根中丹參酮類成分的含量,10 mg/L處理組中隱丹參酮、丹參酮Ⅰ和丹參酮IIA的含量分別是對照組的3.17、1.92、1.94倍,20 mg/L處理組中3種成分的含量則分別為對照組的2.25、1.75、2.23倍(圖6)。
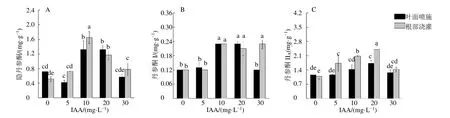
圖6 不同濃度的IAA及施加方式對丹參根系隱丹參酮 (A)、丹參酮I (B)、丹參酮IIA (C) 積累的影響 (n=6)Fig.6 Effects of different concentrations of IAA and application methods on accumulation of cryptotanshinone (A),tanshinone I (B),tanshinone IIA (C) in roots of S.miltiorrhiza (n=6)
4 討論
IAA對植物側根發育的調控機制目前已經基本明確。植物主根基部分生組織區域的中柱鞘細胞在IAA的振蕩調節下脫分化形成側根建成細胞,側根建成細胞受IAA及其下游基因的調控,進行多次的垂周分裂和平周分裂形成側根原基。側根原基繼續分裂,并釋放果膠裂解酶等來改造其周圍皮層或表皮細胞的細胞壁,助其突破皮層和表皮細胞而露出[10]。IAA對側根發育的調控具有復雜性,如在側根發生起始階段發揮作用的IAA主要來源于根尖部位,而側根露出過程中發揮作用的IAA則主要來源于地上部分的莖芽[15]。有研究表明,外源IAA同樣可以影響植物側根的發育和形態建成,且其調控作用與IAA質量濃度密切相關。如10 μmol/L IAA可以促進北柴胡的側根發育,當IAA質量濃度升高到100 μmol/L時則呈現出了顯著的抑制作用[16]。本研究中,葉面噴施和根部澆灌IAA均顯著影響了丹參的根系形態。總體上來說,2種施加方式均增加了一級側根的數目和長度,促進了二級側根的發育,說明外源IAA被丹參不同的器官吸收后均會被運輸到根中發揮作用。IAA不同的施加方式對丹參根系的影響又有不同之處,如一定質量濃度的IAA葉面噴施后可以降低丹參一級側根數目,澆灌處理后則未發現類似變化。這可能是由于葉面噴施的IAA需要運輸才能到達根部細胞,兩種施加方式對根部細胞中內源IAA質量濃度的影響程度不同。但具體的機制有待于進一步深入研究。
除調控植物側根發育外,IAA還在多種植物中影響次生代謝產物的積累。如在0.1~1.0 mg/L的質量濃度范圍內,IAA可顯著提高蕎麥Fagopyrum esculentumL.芽中蘆丁的含量[17]。IAA處理可以提高擬南芥Arabidopsis thalianaL.中槲皮素和山柰酚的含量,并使類黃酮生源途徑上的關鍵酶基因CHS、FLS和F3'H的表達量提高3.00倍以上[18]。對桃Prunus persicaL.果實施加外源IAA可以提高生長素信號途徑上PpPIN和PpTIR1基因的表達,并提高果皮中花青素的含量增加果皮的著色率[19]。本研究中葉面噴施和根部澆灌IAA均影響了丹參中酚酸類成分的的含量,但相較于根部澆灌,葉面噴施IAA能更加高效地促進丹參地上部分和根中酚酸類成分的積累。與酚酸類成分積累情況不同的是,2種IAA施加方式雖然均顯著提高了丹參根中丹參酮類成分的含量,但根部澆灌方式的促進效果更加明顯。說明丹參中2類主要有效成分對IAA的響應機制不同,其具體的調控通路有待于進一步深入研究。
利益沖突所有作者均聲明不存在利益沖突

