重組梅毒螺旋體黏附素在小鼠模型中的免疫原性及免疫保護性研究
(1.南華大學衡陽醫學院病原生物學研究所 特殊病原體防控湖南省重點實驗室,湖南省衡陽市 421001;2.南岳生物制藥有限公司,湖南省衡陽市 421007;3.南華大學衡陽醫學院,湖南省衡陽市 421001)
梅毒是由梅毒螺旋體(Treponema pallidum,Tp)感染引起的一種性傳播疾病,嚴重危害成人與新生兒身心健康并可增加艾滋病感染和傳播的風險[1]。盡管青霉素可以有效地治療梅毒,但梅毒發病人數在中國仍呈不斷上升趨勢[2]。疫苗是防控梅毒經濟有效的措施,然而至今未獲成功[3]。
Tp雖缺乏內毒素,也不產生明顯外毒素,但具有突破神經系統和胎盤屏障的強大侵襲力[4],這與其表面黏附素密切相關[4-5]。黏附素不但可以介導對宿主細胞和(或)細胞外基質(extracellular matrix,ECM)如纖連蛋白、層粘連蛋白、纖維蛋白原等[6-8]的黏附,有些黏附素(如Tp0751)還具有裂解ECM的金屬激酶活性[9],導致Tp通過循環系統或組織間隙播散。黏附素位于Tp表層,直接接觸免疫系統,因此抗黏附成為研發梅毒疫苗的中心環節[3-4]。Tp0751、Tp0136和Tp0435是目前發現的重要Tp黏附素,三者在新西蘭兔模型中的免疫保護性已有研究報道,但Tp0751的細胞定位和保護性具有明顯爭議[6,10-11];Tp0136全蛋白具有部分免疫保護性[8],但其氨基端(N端)保守區能否誘導免疫保護未見報道;Tp0435在新西蘭兔體內未誘生出保護性[12]。新西蘭兔是公認的梅毒疫苗模型,但目前仍缺乏公認的檢測兔細胞因子的免疫試劑[13],Lu等[14]觀察到Tp能在C57BL/6小鼠體內增殖和播散的實驗結果為應用新的梅毒疫苗動物模型提供了依據。
本研究嘗試以C57BL/6小鼠為動物模型,觀察各黏附素免疫誘導小鼠的特異性體液免疫和細胞應答水平、Tp攻擊后在免疫小鼠體內播散情況,為篩選梅毒疫苗侯選分子提供實驗依據。
1 材料和方法
1.1 主要材料與儀器
Tp Nichols標準株、被轉化重組質粒pET-30a-Tp0136N(Tp0136氨基端保守區,即第32~234位氨基酸)或pET-30a-Tp0435(Tp0435去信號肽后全長蛋白,即第23~156位氨基酸)的E.coli JM109重組表達菌、被轉化pET-30a-Tp0751(Tp0751去信號肽后全長蛋白,即第24~237位氨基酸)的E.coli BL21表達菌為南華大學病原生物學研究所保存[15]。QIAamp DNA Mini Kit購自德國Qiagen公司,Talent熒光定量PCR試劑盒(SYBR Green)購自天根生化科技(北京)有限公司,辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗鼠IgG購自美國Proteintech公司,Leuko Act Cktl With GolgiPlug、Cytofix/Cytoperm Soln Kit、Mouse BD Fc BlockTM、PE抗鼠CD4抗體、FITC抗鼠CD8a抗體、PerCPCy5.5抗鼠IL-4抗體、APC抗鼠IFN-γ抗體購自美國BD公司。C57BL/6小鼠購自湖南斯萊克景達實驗動物有限公司。定量PCR儀(LightCycler96)購自美國Roche公司,流式細胞儀FACSCalibur購自美國BD公司。
1.2 重組蛋白的表達與純化
以異丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)誘導重組表達質粒pET-30a-Tp0136N、pET-30a-Tp0435在E.coli JM109中表達;pET-30a-Tp0751在E.coli BL21中表達;SDS-PAGE分析表達產物,鎳柱純化表達產物,純化蛋白分裝,-80 ℃保存備用。
1.3 重組蛋白免疫動物及血清采集
將5~6周齡的雄性C57BL/6小鼠40只隨機分為4組(PBS對照組、rTp0751組、rTp0136N組、rTp0435組),每組10只。將蛋白與等體積弗氏佐劑混勻,以2周為間隔,按0、2、4周時間點分3次皮下注射,重組蛋白免疫劑量為每只30 μg/次。每次免疫前及末次免疫2周后采集小鼠尾靜脈血,分離血清,保存于-80 ℃備用。
1.4 ELISA檢測免疫血清特異性IgG抗體
分別以100 μL純化rTp0751、rTp0136N及rTp0435(10 mg/L)包被96孔酶標板,以上述制備的各待測免疫鼠血清(1∶100稀釋)(同時設陰性對照)為一抗,以HRP標記的羊抗鼠IgG(1∶10 000稀釋)為二抗,四甲基聯苯胺(tetramethylbenzidine,TMB)顯色,酶標儀在450 nm波長下讀數。
1.5 流式細胞術檢測小鼠脾細胞內IFN-γ與IL-4
無菌取末次免疫2周后小鼠脾細胞(每組5只),調整細胞密度為2×104個/μL,按試劑盒使用說明用流式細胞儀檢測小鼠脾細胞內干擾素-γ(interferon-γ,IFN-γ)與白細胞介素-4(interleukin-4,IL-4)含量。
1.6 Tp攻擊感染與qPCR檢測小鼠各組織中Tp載量
末次免疫后第3周,取來自新西蘭兔睪丸的新鮮Tp,對各組小鼠(每組5只)皮下、直腸、陰莖海綿體3個部位攻擊感染,每只小鼠攻擊Tp總數為3×106個。攻擊后6周,取小鼠心、脾、腦組織,QIAamp DNA Mini Kit提取各組織DNA。根據文獻[10,16]合成Tp內鞭毛flaA與鼠β-actin基因引物,引物序列如下:flaA上游引物5′-AACGCAAACGCAATGATA AA-3′,下游引物5′-CCAGGAGTCGAACAGGAGAT AC-3′;β-actin上游引物5′-GTGACGTTGACATCCGTAAAGA-3′,下游引物5′-GCCGGACTCATCGTACT CC。按照SYBR green試劑盒說明,在20 μL反應體積(含2 μL DNA樣本,10 μL 2×mix,1.2 μL的0.03 mmol/L正向和反向引物,6.8 μL雙蒸水)中進行定量PCR。所有檢測在LightCycle 96儀器上進行。擴增flaA和β-actin的qPCR條件如下:預變性,95 ℃孵育15 min;隨后40個循環擴增,95 ℃ 10 s,58 ℃ 10 s,72 ℃ 20 s。熔解曲線分析1個循環:95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。線性質粒DNA從107~10拷貝數的連續10倍稀釋,小鼠gDNA從150~1.17 mg/L的連續2倍稀釋,分別構建flaA和β-actin的標準曲線,采用標準曲線法進行數據分析。
1.7 統計學分析
采用SPSS軟件對數據進行統計學分析,每組標本均設置3個復孔,取平均值,應用T-Test檢驗,P<0.05表示差異有統計學意義。
2 結 果
2.1 原核重組蛋白表達分析
SDS-PAGE結果顯示,重組質粒pET-30a-Tp0751、pET-30a-Tp0136N與pET-30a-Tp0435經誘導分別表達相對分子質量約為26 kDa(可溶性)、23 kDa(包涵體形式)與17 kDa(可溶性)大小的重組蛋白(圖1)。
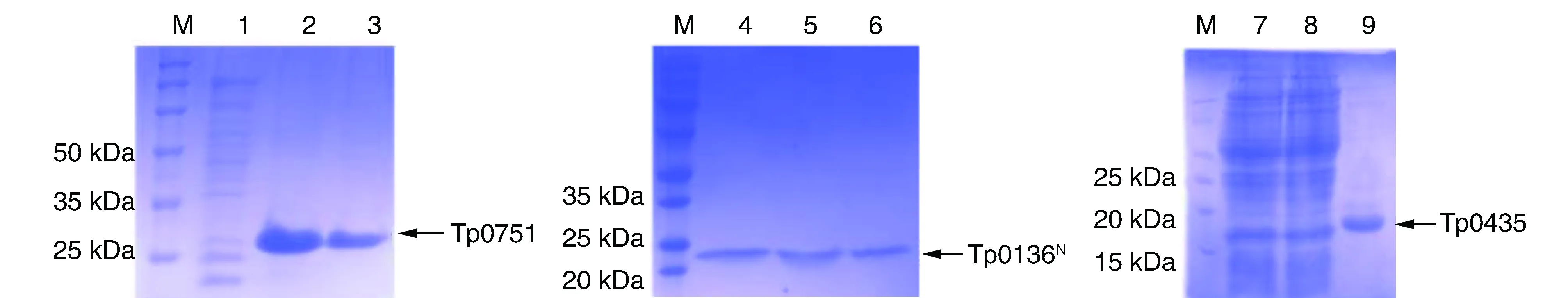
圖1 各重組蛋白的SDS-PAGEM為Maker;1、7和8為全菌蛋白,其他為純化蛋白。
2.2 血清特異性IgG抗體水平
各免疫組小鼠血清特異性IgG水平隨免疫時間增加而逐漸升高,并于末次免疫后2周(即初次免疫后第6周)達到峰值,且均高于PBS對照組(P<0.01;圖2)。
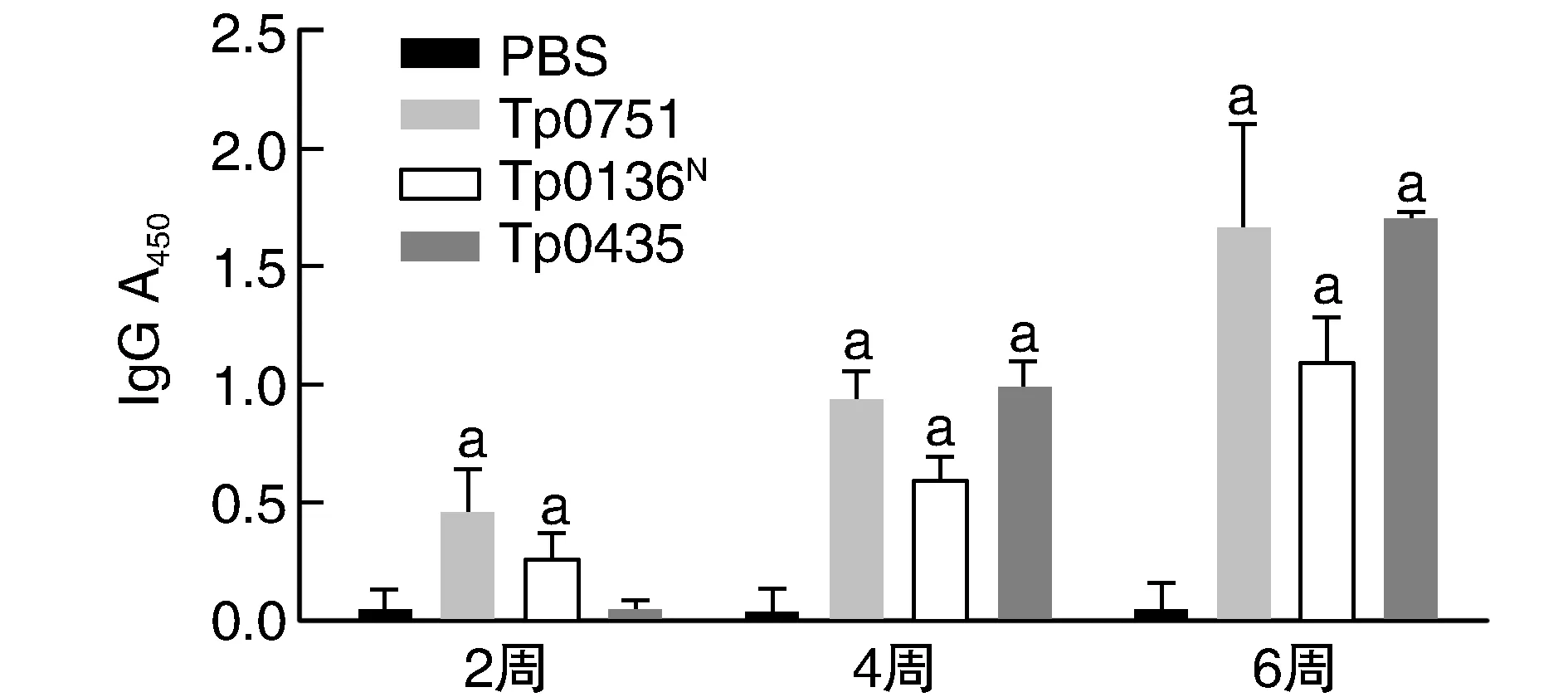
圖2 各組小鼠不同時間點血清特異性IgG水平a為P<0.05,與PBS對照組比較。
2.3 免疫小鼠脾細胞內IFN-γ、IL-4水平含量
流式細胞術檢測結果顯示各免疫組CD4+IFN-γ+和CD8+IFN-γ+含量均高于PBS對照組(P<0.01;圖3)。各組小鼠可檢測到的CD4+T細胞產生IL-4水平均極低(圖3)。
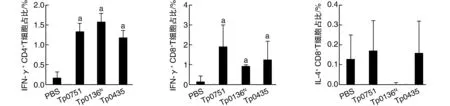
圖3 各組小鼠脾細胞胞內IFN-γ及IL-4水平a為P<0.01,與PBS對照組比較。
2.4 攻擊后各組小鼠不同組織內Tp載量
qPCR檢測Tp攻擊感染后小鼠不同組織Tp-DNA載量顯示,在脾臟、心臟與腦組織中,rTp0751、rTp0136N組Tp載量明顯低于PBS對照組(P<0.05),rTp0435組與PBS對照組差異無顯著性(圖4)。
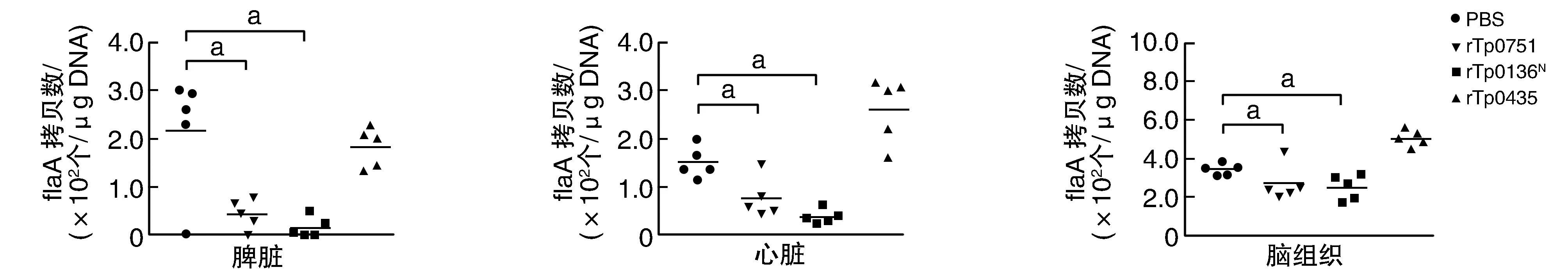
圖4 Tp攻擊后各組小鼠不同組織內Tp載量a為P<0.05,與PBS對照組比較。
3 討 論
Tp不可體外人工培養和基因操作,外膜蛋白稀少,缺乏內毒素(脂多糖)和常見毒力因子,缺乏理想的疫苗動物模型是梅毒疫苗研究進展緩慢的主要限制因素[3-4,13]。Tp強大侵襲力這一特點使得抗黏附作用一直成為梅毒疫苗研究的焦點。一方面,抗黏附素抗體不但能阻止Tp對宿主細胞或ECM的黏附,使其失去組織定植能力而終止早期感染及播散,而且可調理巨噬細胞吞噬[17];另一方面,黏附素誘導的特異性細胞免疫應答,即通過黏附素特異性活化的CD4+Th1細胞、CD8+CTL等產生IFN-γ等細胞因子激活巨噬細胞,加強其吞噬殺傷Tp的活性,被認為是Tp早期感染后清除的主要機制[18]。因此,理想的梅毒疫苗應能同時誘生適應性體液免疫和細胞免疫的混合型免疫應答,以此共同清除Tp[3-4,13]。本研究顯示,與PBS對照組比較,各重組蛋白免疫組小鼠的血清特異性IgG水平隨免疫次數的增加逐漸升高,并于末次免疫后2周達到峰值,表明重組蛋白Tp0751、Tp0136N、Tp0435具有良好的免疫原性。小鼠末次免疫后2周,與PBS對照組相比,3種重組蛋白的免疫鼠脾細胞中的CD4+T細胞和CD8+T細胞均能產生了大量的IFN-γ,提示3種重組蛋白均可有效激發免疫小鼠產生細胞免疫應答。以上黏附素誘生的高水平的適應性體液免疫和細胞免疫應答為獲得保護性免疫提供了基礎。
既往評價動物體內Tp載量常用暗視野顯微鏡或鍍銀染色后鏡檢觀察,此類方法靈敏度較低,主觀因素影響大。qPCR檢測動物感染后遠端靶組織中Tp-DNA載量,具有靈敏、客觀、定量、自動化等優點,被認為是梅毒疫苗方法學的一個重大進步[19]。本研究檢測Tp攻擊6周后小鼠脾臟、心臟、腦組織中Tp的DNA載量,發現Tp0751、Tp0136N小鼠免疫組的各組織中Tp載量均明顯低于PBS對照組,而Tp0435免疫組與對照組無明顯差異,表明Tp0751、Tp0136N免疫后能有效阻止Tp在小鼠體內播散。有關Tp0751在Tp的細胞定位和在新西蘭兔模型中是否能誘導免疫保護性存在分歧,Parker等[6]認為Tp0751為Tp表層的黏附素并具有金屬激酶活性,隨后Lithgow等[10]觀察到其免疫新西蘭兔后宿主器官的Tp負荷明顯減低;Luthra等[11]則認為Tp0751位于Tp的胞質,不能誘導調理素抗體產生,也不能在新西蘭兔體內誘導免疫保護性。本研究結果支持Lithgow等[10]的結論,即Tp0751免疫后能延緩Tp在動物體內的播散,但具體免疫保護機制有待深入研究。Tp0136在Tp株間具有高度異質性[7],不適合以全蛋白作為疫苗分子,但其在氨基端(N端)存在一個能結合細胞纖連蛋白和血漿纖連蛋白的高度保守區,本研究中以該保守區免疫能誘導高水平抗體和細胞免疫應答,且免疫后明顯延緩Tp在小鼠體內播散,這與前期報道Tp0136全長蛋白免疫后可延緩Tp攻擊后新西蘭兔皮損潰瘍形成[7]具有一致性,表明該保守區可能為梅毒疫苗的重要候選分子。本研究中Tp0435免疫小鼠的遠端組織Tp載量未明顯減低,這與Parveen等[12]報道的Tp0435免疫兔的Tp攻擊部位皮損直徑和Tp載量未明顯減低結果有一致性,再次證實了Tp0435盡管免疫原性強但不適宜作為候選疫苗分子。Tp0435屬于強免疫原性的脂蛋白,最近發現其除了存在于Tp內膜,還可表達于Tp細胞表面,其未能誘導免疫保護性可能是Tp膜表面的Tp0435表達隨機且有限,導致相應抗體不能有效調理吞噬細胞吞噬Tp的調理作用[12],同時也提示抗體在阻止Tp播散中具有重要作用,單獨的細胞免疫不足以阻斷Tp播散。
長期以來新西蘭兔被公認為Tp感染和疫苗研究的動物模型,但存在諸多不足,如缺乏公認的用于ELISA或流式細胞技術檢測的兔細胞因子和兔淋巴細胞表面標志分子(如CD4、CD8)的單克隆抗體的免疫檢測試劑[13],難以評價免疫兔體內的細胞應答水平,且建立新西蘭兔模型成本高。Tp感染鼠除不能觀察到類似人類一期梅毒硬下疳的皮膚潰瘍外,其他病程進展與新西蘭兔相似[16],而且目前小鼠細胞因子檢測試劑豐富成熟,構建小鼠模型成本低,可作為新西蘭兔動物模型的補充用于研究抗原免疫原性和觀察Tp體內播散[14]。
綜上所述,本研究以C57BL/6小鼠為免疫和感染攻擊模型,觀察到Tp0751、Tp0136N與Tp0435能誘導小鼠高水平的細胞免疫與體液免疫應答,Tp0751與Tp0136N免疫小鼠后能有效阻止Tp向遠端靶組織播散,具有部分免疫保護性,可望作為梅毒疫苗候選分子。

