苯乙雙胍通過激活AMPK抑制肝癌細胞增殖、集落形成及侵襲
(中南大學湘雅醫學院附屬株洲醫院腫瘤科,湖南省株洲市412000)
肝癌是中國常見的惡性腫瘤之一,居中國癌癥發病率的第五位[1],手術是其主要治療手段,但大部分病人發現時已為腫瘤中晚期,喪失了手術機會。即使進行了手術切除、原位肝移植和射頻消融術,由于肝癌的高侵襲性和復發率,其預后仍不理想[2]。近年來研究表明,二甲雙胍除降糖作用外,還具有抗腫瘤作用[3]。苯乙雙胍同為雙胍類衍生化合物,結構上不同于二甲雙胍[4],抗腫瘤活性也不同于二甲雙胍。苯乙雙胍無需任何轉運蛋白即可通過細胞膜[5]。因此,苯乙雙胍比二甲雙胍有更好的組織生物利用度,其抗腫瘤作用是二甲雙胍的50倍[6],且苯乙雙胍具有直接抗腫瘤作用[7],也可增強化療、放療[8]或者靶向治療[9]的療效。目前關于苯乙雙胍在肝癌中作用的報道少見,本文就苯乙雙胍對肝癌細胞增殖、集落形成、侵襲能力的影響,以及其分子機制進行研究,現報道如下。
1 材料和方法
1.1 材料
苯乙雙胍(中國阿拉丁試劑公司);p-AMPK兔抗人單克隆抗體(美國CST公司);p-mTOR兔抗人單克隆抗體(美國CST公司);β-actin兔抗人單克隆抗體(美國CST公司);LipofectamineTM2000脂質體(上海碧云天生物科技公司);siRNA-AMPK(廣州銳博生物科技有限公司);倒置熒光顯微鏡-DMI3000B(德國Leica公司);全自動化學發光圖像分析系統-4600(上海天能科技有限公司);多功能酶標儀-Synergy HTX(美國BioTeK公司);人肝癌細胞株Hep-G2由中南大學湘雅醫院贈予;人肝癌細胞株SMMC-7721由湖南師范大學醫學院贈予。
1.2 細胞培養
SMMC-7721、Hep-G2細胞培養在含10%胎牛血清和1%雙抗的完全培養基中,培養箱控制在37 ℃、5% CO2、100%濕度的環境下,3~4天傳代1次。由于苯乙雙胍在兩個細胞系的敏感度不同,故選擇不同的濃度進行后續實驗[10]。
1.3 細胞轉染
由于Hep-G2對苯乙雙胍更加敏感,因此選擇Hep-G2進行轉染實驗。Veiga等[5]研究苯乙雙胍作用于肝癌也同樣選擇的是Hep-G2細胞。取3×105個對數生長期的Hep-G2細胞接種在6孔板中,培養12 h后轉染,利用脂質體2000將無義siRNA及AMPK siRNA轉染細胞,依據轉染siRNA不同分siAMPK組(轉染AMPK siRNA)及siCtrl組(轉染無義siRNA),轉染5 h后更換為完全培養基,siAMPK序列:5′-AATTACTTCTGGTGCAGCATAGCGG-3′,siCtrl序列:5′-TTCTCCGAACGTGTCACGT-3′。
1.4 MTT細胞增殖實驗
取8×103個對數生長期的SMMC-7721、Hep-G2、siRNA Hep-G2以及siAMPK Hep-G2細胞接種在96孔板中,置于培養箱中24 h后,用不同濃度的苯乙雙胍(0、200、400、600、800、1 000、1 200 μmol/L處理SMCC-7721細胞,0、40、80、160、320、640 μmol/L處理Hep-G2細胞)處理72 h,然后吸出培養基,PBS輕柔清洗2遍,每孔中加入50 μL MTT溶液,繼續培養5 h后向每個孔中添加150 μL二甲基亞砜,避光震蕩15 min,酶標儀檢測每孔在490 nm波長處的光密度(OD值)。細胞相對活力=實驗組OD值/對照組OD值,使用Prism軟件繪制MTT曲線。
1.5 克隆實驗
取8×103個對數生長期的SMMC-7721、Hep-G2細胞接種在24孔板的每孔中,置于培養箱中24 h,用不同濃度的苯乙雙胍(SMMC-7721細胞為0、10、20 μmol/L,Hep-G2細胞為0、25、50 μmol/L)處理5~7天,當對照組細胞(苯乙雙胍濃度為0 μmol/L)生長至70%~80%時,取出24孔板,棄去完全培養液,用PBS輕柔清洗2遍,加10%福爾馬林固定3 h,每孔加1 mL 0.1%結晶紫浸染1 h,浸染后用礦泉水緩慢輕柔清洗,倒置在紙上干燥,放入酶標儀中,選擇波長為550 nm進行定量,使用Prism軟件進行統計學分析。
1.6 侵襲實驗
使用侵襲實驗檢測細胞侵襲能力[11]。取對數生長期的4×104個SMMC-7721細胞、8×104個Hep-G2、siRNA Hep-G2以及siAMPK Hep-G2細胞分別混勻在無血清的培養基中,同時加入不同濃度的苯乙雙胍(SMMC-7721細胞為0、100、200 μmol/L,Hep-G2細胞為0、50、100 μmol/L),接種在小室上室,在24孔板下室加入500 μL完全培養液,常規培養24 h后,將小室上培養液丟棄,用10%多聚甲醛固定3 h,0.1%結晶紫染色5 h。用鑷子將小室放在清水中輕輕洗滌,去除表面結晶紫,用棉簽輕輕拭去上室的細胞。在顯微鏡下采集圖片并計數細胞穿膜數。相對侵襲能力=實驗組穿膜細胞數/對照組穿膜細胞數。
1.7 Western blot法
使用不同濃度苯乙雙胍(0、100、200、400 μmol/L處理SMMC-7721細胞,0、50、100、200 μmol/L處理Hep-G2細胞)處理細胞24 h后收板。向每個孔中加200 μL蛋白裂解液裂解細胞,放置在100 ℃的水浴鍋中加熱10 min,取出備用。隨后制膠、上樣、電泳、轉膜、剪膜、封閉,在4 ℃孵育一抗14~16 h,洗條帶1 h,室溫下孵育二抗1 h,使用TANON機器拍攝,用Image J軟件分析目標條帶的灰度值(蛋白相對表達水平=實驗組灰度值/對照組灰度值)。
1.8 統計學處理
2 結 果
2.1 轉染效果鑒定及對AMPK表達影響
結果顯示siCtrl組和siAMPK組AMPK蛋白相對表達量分別是0.94±0.08和0.15±0.07,siAMPK組細胞幾乎無AMPK蛋白表達(P<0.05;圖1)。成功轉染Hep-G2細胞株。
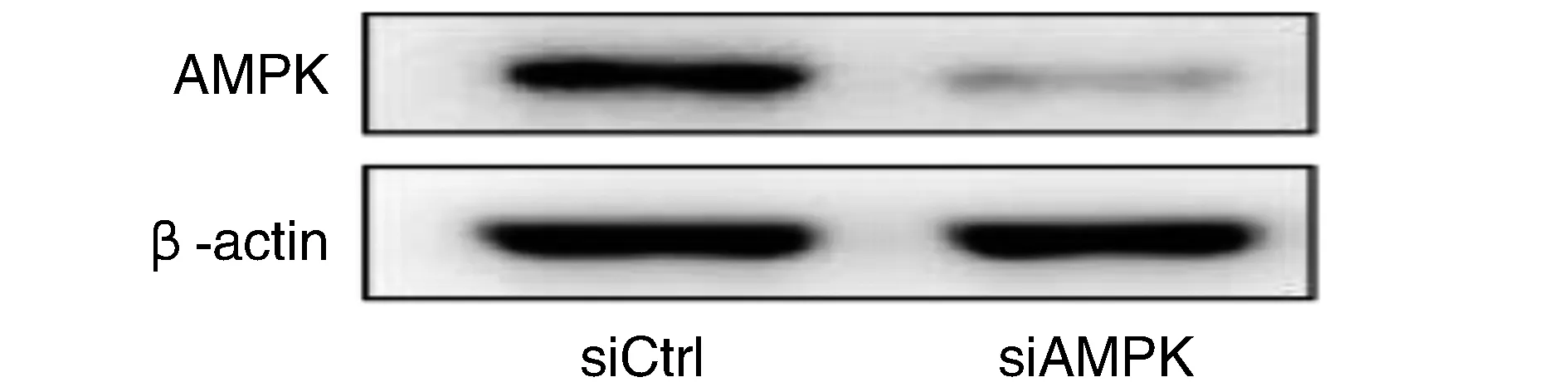
圖1 沉默AMPK后的AMPK蛋白表達
2.2 SMCC-7721和Hep-G2細胞增殖實驗結果
與苯乙雙胍濃度為0 μmol/L相比,SMMC-7721、Hep-G2細胞活力隨苯乙雙胍濃度增高而下降(圖2)。與siAMPK組相比,siCtrl組對苯乙雙胍的抑制作用更為敏感(P<0.05;圖3)。
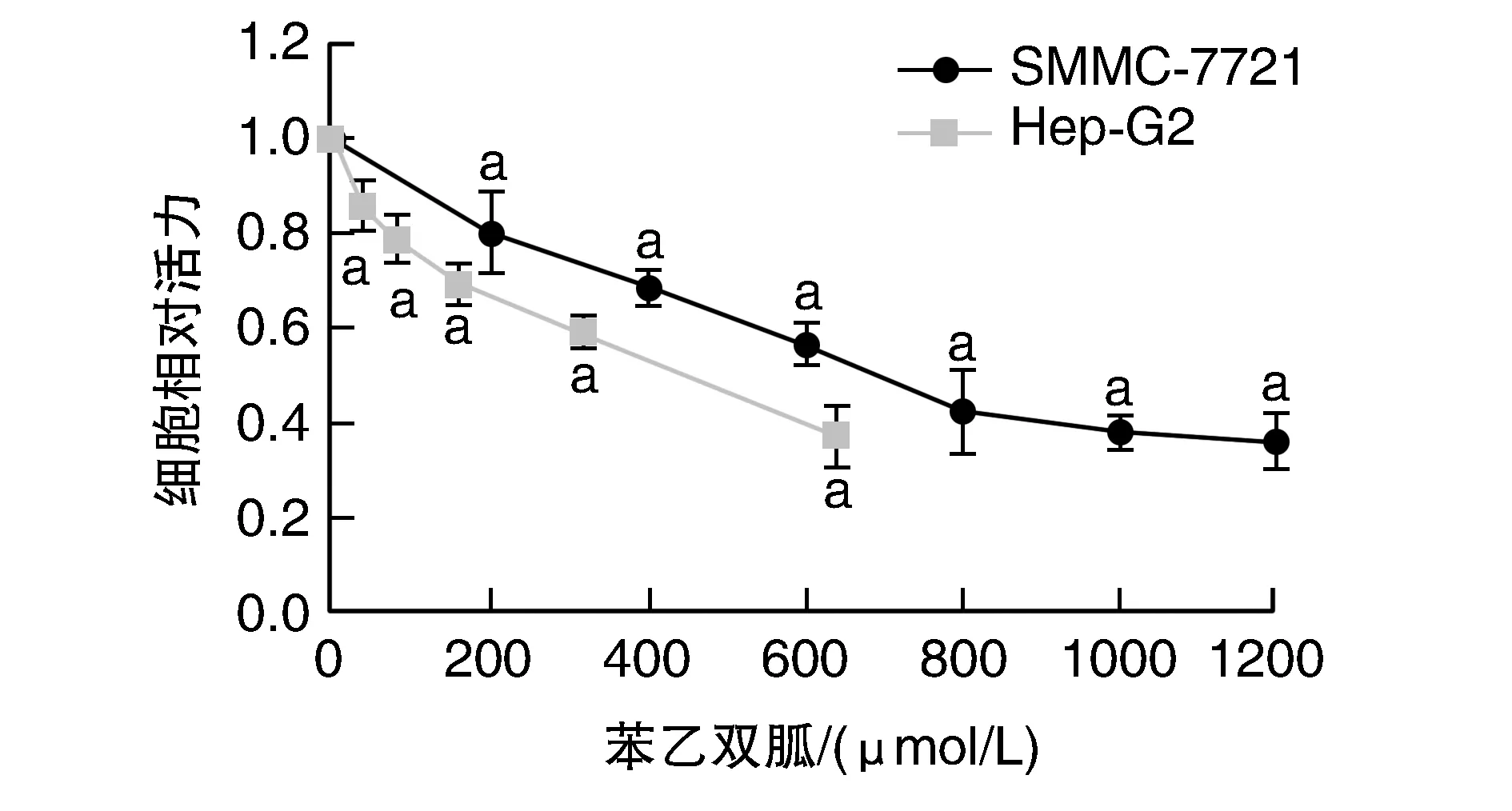
圖2 細胞增殖實驗結果a為P<0.05,與同細胞苯乙雙胍0 μmol/L比較。
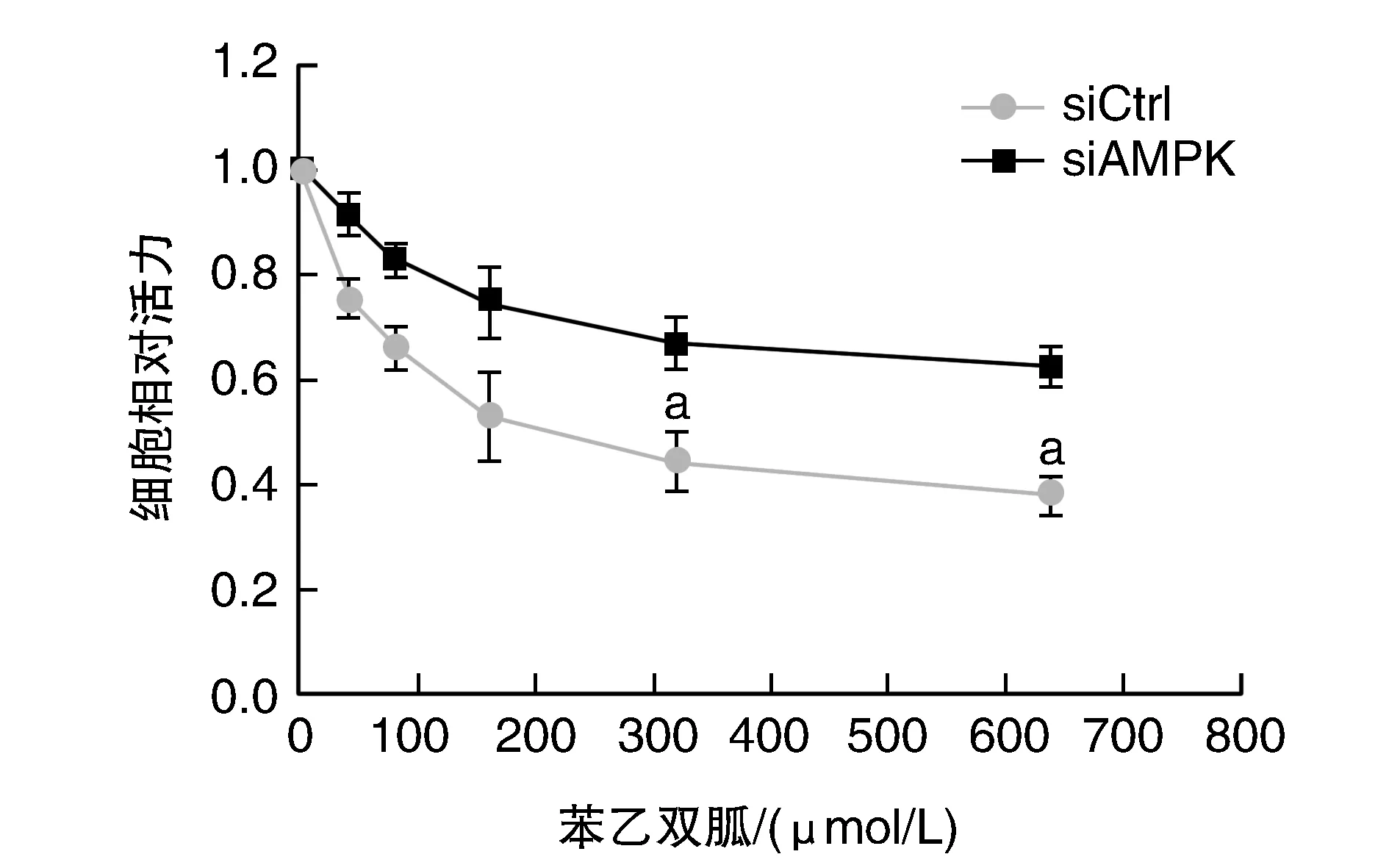
圖3 沉默AMPK對Hep-G2細胞增殖的影響a為P<0.05,與siCtrl組比較。
2.3 SMCC-7721和Hep-G2細胞克隆實驗結果
不同濃度的苯乙雙胍處理Hep-G2和SMMC-7721細胞后,與苯乙雙胍0 μmol/L組比較,苯乙雙胍處理后細胞的集落形成能力明顯下降(P<0.05;圖4)。
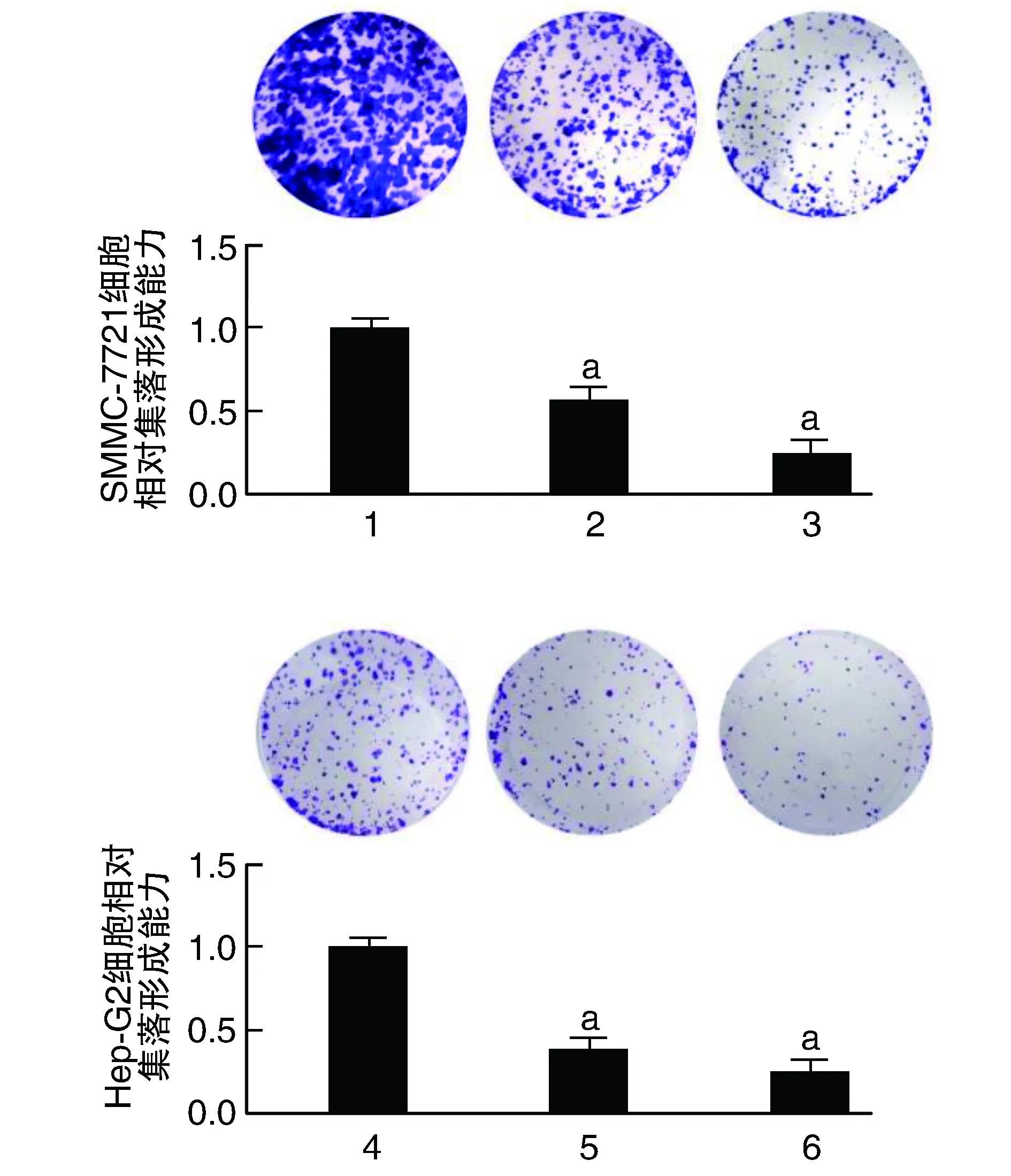
圖4 SMMC-7721和Hep-G2細胞克隆實驗結果1、2、3、4、5、6分別為0、10、20、0、25、50 μmol/L的苯乙雙胍組。a為P<0.05,與同細胞苯乙雙胍0 μmol/L組比較。
2.4 SMCC-7721和Hep-G2細胞侵襲實驗結果
與0 μmol/L組比較,苯乙雙胍處理組細胞的侵襲能力明顯下降,但相同濃度苯乙雙胍(100 μmol/L)處理兩個細胞系,Hep-G2侵襲能力下降更為明顯(圖5)。
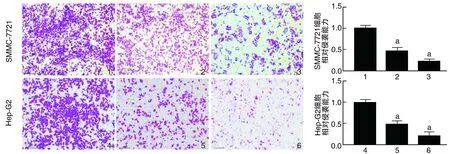
圖5 SMMC-7721和Hep-G2細胞侵襲實驗結果(結晶紫染色,100×)1、2、3、4、5、6分別為0、100、200、0、50、100 μmol/L的苯乙雙胍組,a為P<0.05,與同細胞苯乙雙胍0 μmol/L組比較。
60 μmol/L苯乙雙胍處理Hep-G2細胞以及沉默AMPK的Hep-G2細胞,如圖6所示。苯乙雙胍處理的siCtrl組與未予以苯乙雙胍處理的siCtrl組相比,侵襲能力下降。苯乙雙胍處理的siCtrl組與苯乙雙胍處理的siAMPK組相比,siAMPK使Hep-G2細胞的侵襲能力較siCtrl組更強,沉默AMPK后,使苯乙雙胍抗侵襲能力下降,但并非完全消失,而是使苯乙雙胍抗侵襲能力減弱(P<0.05)。
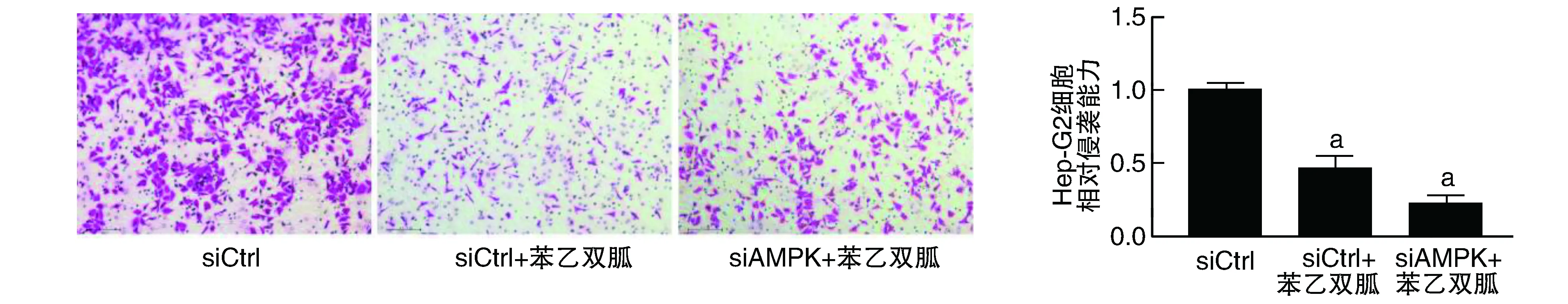
圖6 沉默AMPK對Hep-G2細胞侵襲的影響(結晶紫染色,100×)a為P<0.05,與siCtrl組比較。苯乙雙胍濃度為60 μmol/L。
2.5 SMCC-7721和Hep-G2細胞p-AMPK、p-mTOR蛋白表達情況
與0 μmol/L組比較,苯乙雙胍處理后的肝癌細胞,p-AMPK表達量增加,p-mTOR表達量下降。苯乙雙胍處理后蛋白表達水平與0 μmol/L組比較,差異具有統計學意義(P<0.05;圖7)。
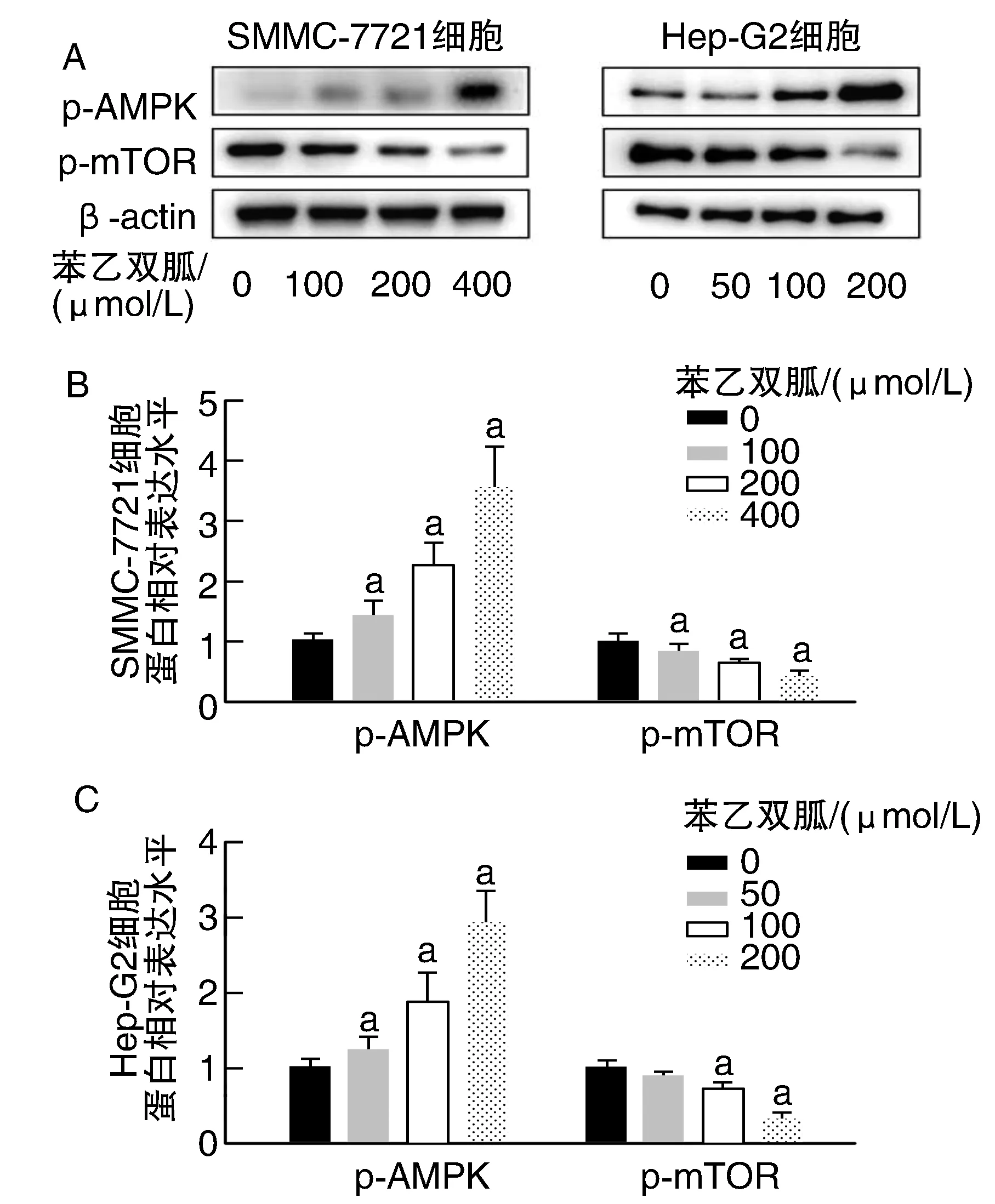
圖7 SMMC-7721/Hep-G2細胞p-AMPK、p-mTOR蛋白表達情況A為Western blot實驗結果;B、C為蛋白表達柱狀圖。a為P<0.05,與同細胞苯乙雙胍0 μmol/L組比較。
3 討 論
肝癌是癌中之王,惡性程度十分高,發現時往往處于晚期,失去了手術的機會,放療和化療有效率偏低,預后極差,因此尋找治療肝癌新藥物至關重要。苯乙雙胍作為降糖效果優于二甲雙胍的雙胍類降糖藥,因其乳酸毒性而逐漸退出臨床應用[12]。與二甲雙胍相比,苯乙雙胍具有更好的抗癌活性[13]。然而,迄今為止,很少有研究探討苯乙雙胍的抗腫瘤活性。苯乙雙胍能抑制線粒體呼吸鏈復合物I[7],降低三磷酸腺苷(adenosine triphosphate,ATP)合成,一磷酸腺苷(adenosine monophosphate,AMP)/ATP比率增高,最終誘導AMPK激活,進而抑制其下游信號通路蛋白mTOR[14],抑制肝癌細胞的生長、增殖和侵襲[15]。AMPK作為一種細胞內能量傳感器,負責調節代謝活動[16]。Appleyard等[17]研究表明,AMPK是雙胍類藥物作用的一個關鍵靶點,AMPK在肝臟中被激活。由此可知,苯乙雙胍具有抗腫瘤活性,但很少有研究報道苯乙雙胍與肝癌的關系。
本實驗結果表明,苯乙雙胍可以抑制SMMC-7721和Hep-G2肝癌細胞的活力、集落形成和侵襲能力,且隨著苯乙雙胍的濃度增大,肝癌細胞的活力、集落形成能力以及侵襲能力越低,其中可見Hep-G2細胞系較SMMC-7721細胞系對苯乙雙胍更為敏感。肝癌的特點就是極易發生肝內轉移,導致無法手術,治療效果欠佳[18],本實驗使用侵襲實驗檢測肝癌細胞SMMC-7721和Hep-G2侵襲能力,發現苯乙雙胍對兩種細胞系的侵襲能力皆起到抑制作用,從而可能抑制肝癌的轉移。AMPK和mTOR是腫瘤代謝中的重要靶點,Sabharwal等[19]發現苯乙雙胍可誘導線粒體功能障礙和分裂,可使代謝向糖酵解轉變,從而使肝癌細胞更容易受到mTOR抑制劑的影響,其研究得知苯乙雙胍與mTOR抑制劑協同激活AMPK,增加ROS的生成和細胞死亡,從而共同抑制肝癌細胞的生長和增殖。本實驗結果也表明苯乙雙胍作用于SMMC-7721和Hep-G2肝癌細胞,可激活AMPK,并抑制其下游通路蛋白mTOR,從而發揮其抗腫瘤作用。為進一步探索是否通過AMPK發揮作用,選擇對苯乙雙胍更為敏感的Hep-G2細胞,進行AMPK沉默。結果表明,siAMPK組細胞增殖能力較siCtrl組明顯增高,苯乙雙胍作用于siAMPK組仍可以抑制細胞的增殖,但相較于siCtrl組抑制減弱。與MTT實驗結果相似,侵襲實驗也證實siAMPK組對苯乙雙胍敏感度較siCtrl組降低,其遷移細胞數較siCtrl明顯增多。由此,進一步證實苯乙雙胍通過激活AMPK發揮作用,但沉默AMPK之后并不能完全抑制苯乙雙胍抗腫瘤作用,表明苯乙雙胍可能通過其他機制共同發揮抗腫瘤作用,例如通過作用于腫瘤干細胞[16,20]、抑制免疫[21]以及誘導細胞凋亡[22]等。除此之外,苯乙雙胍還可以與各種靶向藥物聯合應用作用于腫瘤細胞[23-24],增加靶向藥物的作用,延緩靶向藥物耐受時間,從而抑制腫瘤的生長、轉移和進展。這可為腫瘤提供一種新的治療方式。
綜上所述,苯乙雙胍抑制SMMC-7721和Hep-G2肝癌細胞的生長、增殖以及侵襲能力,其機制可能與激活AMPK,抑制mTOR有關。本實驗結果為苯乙雙胍未來應用于臨床治療肝癌提供理論基礎,但未與臨床化療、放療以及靶向藥物聯合,未來就其與藥物協同作用的機制尚有待進一步研究,苯乙雙胍有望成為肝癌治療的一種新的藥物。

