微污染水源水處理的工藝優化試驗分析
趙亞峰
( 遼寧省朝陽水文局,遼寧 朝陽 122000)
水生物和源水深度處理是微污染水源當前主要的兩種水處理方式,此外一些新的氧化以及超濾膜工藝和新技術也逐步被用于微污染水源處理中。目前,受技術和經濟條件的限制,一些新技術和新工藝還未得到全面應用,許多新技術依舊在摸索階段[1-5]。從國內微污染水源處理研究現狀可看出[6-10],除了采用傳統強化水處理技術,采用物理、化學以及生物相結合的技術對原水進行處理的工藝已逐步得到研究學者的關注和研究。近些年來,采用深度吸附處理的方式對微污染水源水中的有機污染物處理,活性炭、沸石以及硅藻土作為常用的吸附劑。目前,微污染水源公認的較為成熟的措施是采用活性炭進行吸附處理[11-14]。在這項技術中吸附污染物的回收利用處理不當將會增加工藝運行成本,同時處理系統的排泥量也會增加。因此,需要采用性價比較高的吸附方式對微污染水源水進行吸附以及再利用。為此,文章通過靜態實驗和動態實驗,模擬實際生產運行條件,探討微污染水源水處理的的工藝改造效果,以期研究成果在實際污水處理中具有更廣泛的推廣應用價值。
1 高錳酸鉀單獨氧化處理微污染水源水實驗
采用高猛酸鉀對微污染水源進行單獨氧化處理,通過測定氧化前后的污染物指標,確定最優的藥劑投放量以及氧化時間。
1.1 高錳酸鉀投加量對污染物去除效果影響
在6個250ml錐形瓶中加入200ml水樣,分別加入不同劑量的高錳酸鉀,使得高錳酸鉀濃度分別為0.5 、1.0 、1.5、2.0、2.5和3.0 mg/L,放入恒溫搖床,搖床溫度為5℃,轉速為150r/min,振蕩時間均為10min,測定高錳酸鹽指數和氨氮濃度值,結果見表1。
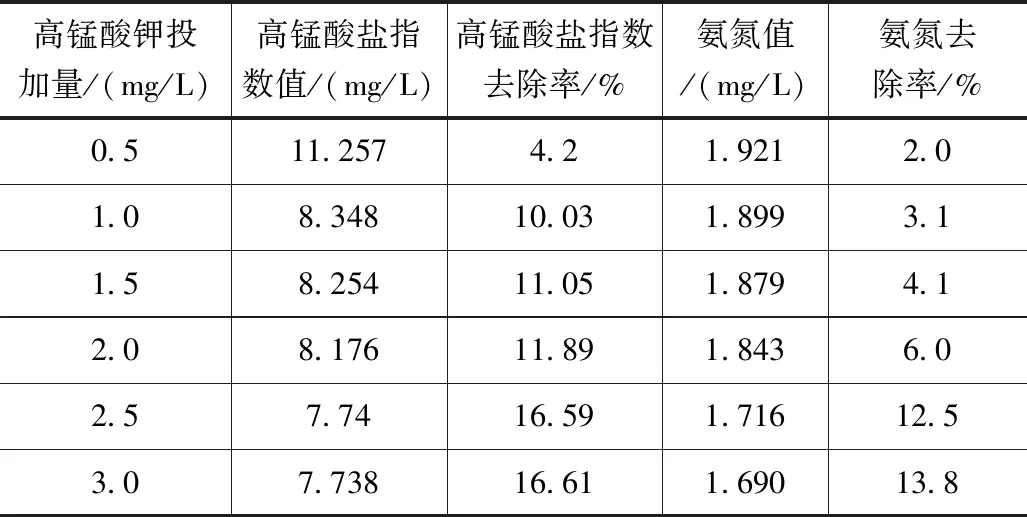
表1 高錳酸鉀投加量對高錳酸鹽指數和氨氮去除效果的影響
由表1可知,高錳酸鉀投加量對高錳酸鹽指數和氨氮去除率的影響較為明顯,但隨著投藥量超過2.5 mg/L后,影響程度逐步降低,兩項微水源污染處理指標的去除率分別穩定在16.61%與13.8%之間。
1.2 pH值對污染物去除效果影響
在5個250ml錐形瓶中加入200ml水樣,加入高錳酸鉀(濃度為2.5mg/L),調節水樣pH值分別為5.0、6.2、7.1、8.2和9.6,放入恒溫搖床,搖床溫度為5℃,轉速為150r/min,振蕩時間均為10min,測定高錳酸鹽指數和氨氮濃度值,結果見表2。
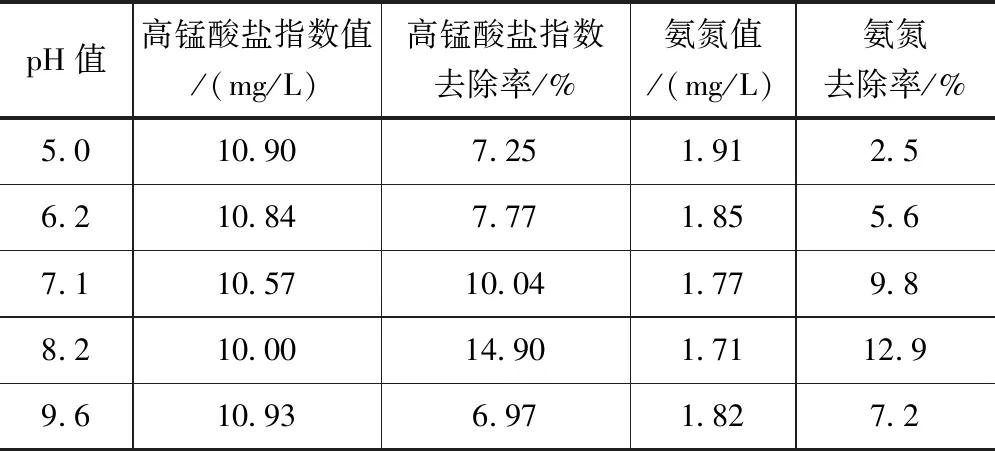
表2 pH值對高錳酸鹽指數和氨氮去除效果的影響
據表2 中的pH對高錳酸鹽指數和氨氮去除率的影響可知,不同的pH值對有機物的去除率影響程度較大。兩項污染指標在堿性較弱的環境下影響程度明顯高于酸性環境條件下,試驗表明,pH穩定在7.1與8.2之間對高錳酸鹽指數和氨氮兩個指標的去除率可達到最優。
1.3 氧化時間對污染物去除效果影響
在6個250ml錐形瓶中加入200ml水樣,均加入高錳酸鉀(濃度為2mg/L),放入恒溫搖床,搖床溫度為5℃,轉速為150r/min,振蕩時間分別為5、10、15、20、30和60min,測定高錳酸鹽指數和氨氮濃度值,見表3。
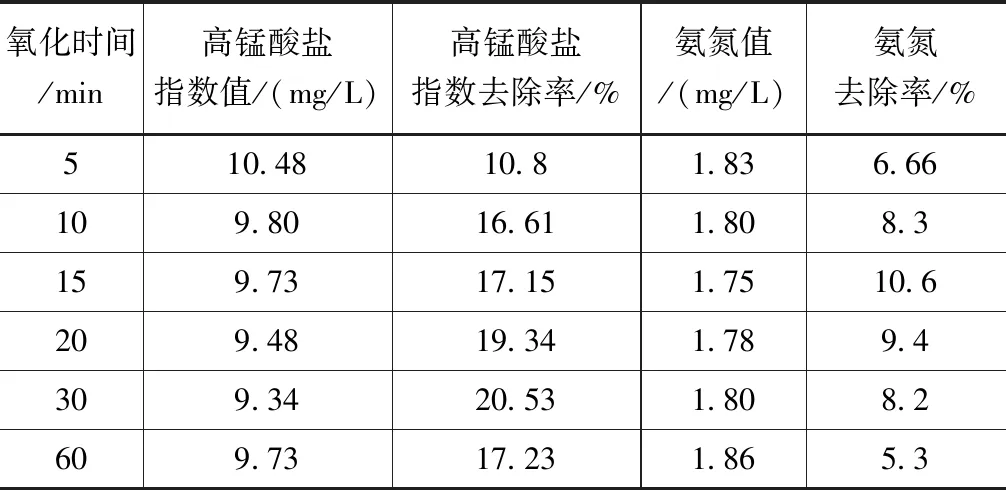
表3 氧化時間對高錳酸鹽指數和氨氮去除效果的影響
由于高錳酸鹽指數和氨氮氧化處理下的吸附率不同,30min氧化時間后高錳酸鹽的吸附率最佳,氨氮在氧化15min后吸附率達到最優,且吸附率隨著氧化時間的遞增有所差異,且變動幅度較高。在相對較短的氧化時間內吸附率很難達到最優,也表明了高錳酸鉀的氧化性較強。高錳酸鉀總體來看對微污染水源單獨氧化吸附效果較低,高錳酸鹽指數和氨氮的吸附率分別在20%以及15%以內。試驗也發現,高錳酸鉀單獨氧化,對濁度幾乎沒有去除效果,而且出現投加高錳酸鉀量越大,對應濁度也越大的現象。因此,為了更好地處理微污染水源水,可以考慮投加絮凝劑以及后續用沸石吸附。
2 高錳酸鉀與混凝劑聯用處理微污染水源水
采用燒杯試驗的方式將混凝劑與高錳酸鉀進行混合使用,通過優化混凝劑以及氧化劑的使用量進行微污染水源處理的最優工藝。
2.1 投藥順序的確定
分別采用30mg/L的PAC以及3mg/L的PAM投入2.5mg/L的高錳酸鉀中進行混合使用,對微污染水源水處理效果如圖1所示。

圖1 投藥順序對各污染因子去除率影響
從圖1中可看出,高錳酸鹽指數和氨氮的吸附率在優化混合后效果十分明顯,從投放順序可看出,濁度的吸附率在先氧化后混凝和后氧化先混凝的方式下效果明顯,先氧化后混凝對高錳酸鹽指數吸附率最高,三種方式對氨氮的吸附率總體可為30%~35%。通過各方式綜合對比,先氧化后混凝對微污染水源的水處理效果最優。
2.2 最佳投藥量確定
在6個250ml錐形瓶中加入200ml水樣,先氧化后混凝方式下的PAC以及PAM作為固定絮凝劑,其用量分別為30、3mg/L,分別加入不同劑量的高錳酸鉀,使得高錳酸鉀濃度分別為0.5、1.0、1.5、2.0、2.5、3.0 mg/L,放入恒溫搖床,搖床溫度為5℃,轉速為150r/min,氧化時間為25min,測定濁度、高錳酸鹽指數和氨氮濃度值,并對做污染物去除率隨高錳酸鉀投加量變化曲線進行分析,分析結果見圖2所示。

圖2 不同藥劑投放量影響下污染物去除效果分析曲線
從圖2中可看出,高錳酸鹽指數和氨氮的吸附率隨著錳酸鉀投加量的增加而逐步提高,但對濁度的效果影響相對較小,高錳酸鹽指數和氨氮的吸附率在投入3.0 mg/L的高錳酸鉀后達到最優。高錳酸鹽指數和氨氮的含量分別為3.58和1.23 mg/L時,高錳酸鹽指數和氨氮的含量已達到Ⅱ類水源水質標準。但為防止高錳酸鉀投加過量(水略顯粉紅色,且高錳酸鉀投加量過高會造成水中的Mn2+超標),高錳酸鉀投加量控制為2.5mg/L,處理后的水用沸石吸附。
3 天然沸石吸附等溫線實驗
將4g天然沸石(粒徑為30~100目) 以及氨氮濃度為25ml的溶液加入250ml錐形瓶,設置不同的初始濃度以及溫度變化,并以150 r/min的轉速對錐形瓶溶液進行恒溫振蕩,保持吸附平衡,上部的清液靜置后采用微孔濾膜處理,對氨氮在濾液中的濃度進行測定。
3.1 Langmuir等溫吸附模型
模型等溫吸附試驗的方程可簡化為
(1)
式中,Ce—吸附濃度,mg/L;qe—平衡時的吸附量,mg/kg;qm—最大吸附量,mg/kg;K—等溫吸附常數。
對不同溫度下的吸附濃度進行擬合計算,擬合參數以及擬合結果分別見表4和圖3。

表4 Langmuir等溫方程參數
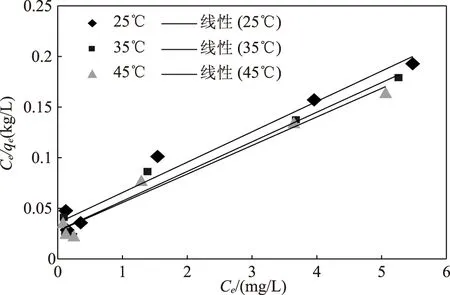
圖3 吸附等溫線的擬合
由表4可以看出,各溫度下的擬合方程相關系數都較高,沸石對氨氮的吸附量最大值隨著溫度的增加從33.52 mg/g變化到35.78 mg/kg,吸附劑與溶劑按照液相吸附理論隨著溫度的升高,其親和力逐步遞增。溶液中氨氮在吸附過程中其周圍吸附劑顆粒液膜阻力增加,從吸附劑的外層向內部細孔深處逐步擴散。溶液中氨氮隨著溫度的增加不但需要對液膜表面阻力進行抑制,而且可以有助于沸石從表面逐步向內部進行吸附氨氮,從而提高氨氮的吸附量。此外,低溫下難以產生的化學反應可以在高溫環境下發生。因此沸石對氨氮的吸附效果隨著溫度的升高而加大。
3.2 Freundlich等溫吸附模型
Freundlich等溫吸附模型化簡后得到的直線方程為
(2)
式中,Ce—吸附平衡時溶液濃度,mg/L;qe—平衡時的吸附量,mg/kg;Kf、n—為模型吸附系數,該系數和吸附容量具有較高的相關度。通常認為,當1/n為0.01~0.5時,較容易吸附;當1/n大于2時,較難吸附。利用該模型對實驗數據進行擬合分析,擬合方程參數見表5。
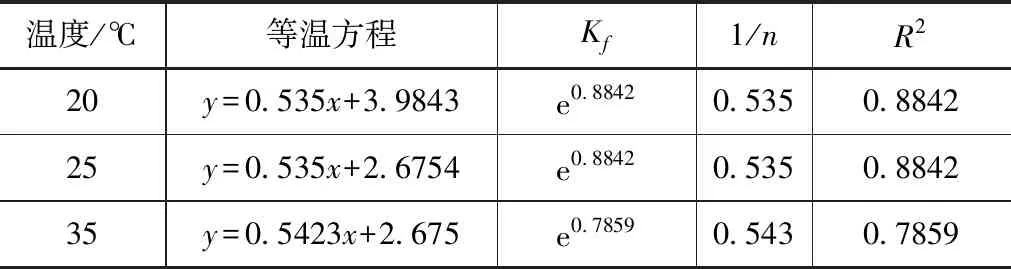
表5 Freundlich等溫方程參數
4 天然沸石吸附動力學實驗
吸附動力學試驗主要表征濃度、時間以及溫度之間的關聯程度。不同溫度以及不同時間下天然沸石對污染指標的吸附程度不同,通過吸附動力學試驗對其速率以及濃度時間變化特征進行分析,結果見表6。

表6 不同溫度下沸石吸附氨氮動力學表達式及參數
吸附速度受吸附劑影響主要表現為兩個過程,第一個過程是吸附離子逐步向外進行分散,吸附速率受液膜擴散速影響逐步增加;第二個過程為顆粒從吸附劑表面經液膜逐步向細孔內氣相進行擴散,在不離開孔壁狀態下分孔壁上吸附的分子向相鄰吸附位置進行轉移。從天然沸石動力吸附試驗分析結果可知,擬合效果可符合二級動力學方程的擬合要求,表明水溶液中氨氮的平衡吸附量采用等溫條件下沸石的準二級動力學模型進行估算是合理的。
5 試驗結論
(1)高錳酸鹽指數和氨氮在中性和弱堿性條件下具有較好的吸附效果,而在酸性或堿性條件下吸附效果均有所降低,pH值適宜范圍為7.2~8.3,當pH=8.3時吸附效果最優。
(2)高錳酸鹽指數和氨氮的吸附率隨著高錳酸鉀投加量的增加而提升,但對水體濁度吸附影響較低,建議控制高錳酸鉀投加量為2.5mg/L,以免投加的高錳酸鉀過量,可采用沸石來吸附處理后的水源。
(3)微污染水源中濁度和氨氮吸附均建議采用先氧化后混凝的工藝,先氧化后混凝和后氧化先混凝對高錳酸鹽指數吸附效果相似,都可采用。

