放療影像自動分割效果評估中幾何參數與劑量學參數之間的關聯性
余行,劉歡,傅玉川
四川大學華西醫院放療科,四川成都610041
前言
靶區及危及器官的勾畫是放射治療流程中重要的一步,相較于手動勾畫,自動分割具有提高勾畫效率、降低勾畫差異等優勢[1]。目前,有基于圖譜的自動分割商用軟件可應用于臨床,在對感興趣區域(Region of Interest,ROI)(主要是危及器官)進行自動分割后,由醫生對自動分割結果進行修改并確認[2]。近年來,基于深度學習的醫學影像自動分割方法迅速發展并開始運用于放射治療靶區及危及器官的自動分割[3-4],并以其魯棒性和靈活性顯示出巨大的潛力[5]。
無論是基于圖譜的自動分割,還是基于深度學習的自動分割,對分割結果的評估和驗證都是將其應用于臨床必不可少的環節之一。在評估過程中使用最廣泛的輪廓指標是幾何指數,包括體積差異、質心距離、一致性指數和邊緣分析等[6]。盡管幾何指數計算方便,并且可以選擇多種幾何參量來進行較為全面的評估,但它們缺乏臨床相關意義,不能直接反映勾畫差異對靶區和危及器官劑量分布的影響[7]。
本文利用深度學習模型自動分割生成的靶區及危及器官輪廓與醫生手動勾畫輪廓進行多參量的對比評估,探討對自動分割結果進行評估時將幾何參數與劑量學參數聯合使用的必要性與可行性,同時還分析了幾種常用幾何評估參數之間的相關性。
1 資料與方法
1.1 影像資料
圖像數據來自于2015年2月至2019年7月在四川大學華西醫院放療科接受治療的180例宮頸癌患者,分期為IB~IIA期,均于術后接受放射治療,其中162套CT數據用于訓練,18套CT數據用于測試。所有患者均在CT掃描前憋尿以保證膀胱充盈,掃描時采用仰臥位,雙手舉過頭頂,使用頭頸肩熱塑性面罩固定,并注射對比劑。圖像使用西門子模擬定位CT Siemens Somato(Siemens Healthcare,Forchheim,Germany)進行采集,圖像重建分辨率為512×512,層厚為3 mm。危及器官包括膀胱、左右股骨頭、小腸以及直腸。臨床靶區(Clinical Target Volume,CTV)分為原發灶的CTV和盆腔淋巴結的CTV,原發灶CTV包括宮頸腫塊、整個宮頸及宮體、宮旁組織及陰道,盆腔淋巴結CTV包括髂總、髂內、髂外、骶前及閉孔淋巴引流區[8]。
1.2 自動分割模型及結果
使用全卷積神經網絡FCN-8s[9]構建我們的自動分割模型,采用有公開代碼和參考模型的開源深度學習仿真工具Caffe[10],基于ImageNet數據庫進行遷移學習完成預訓練。使用Python作為編程語言對醫學影像DICOM RT文件進行相關的轉換、處理及計算。將162例患者的CT圖像用于模型的訓練,采用預訓練與數據擴增避免過擬合,在NVIDIA GTX 1080TI GPU上進行模型訓練。利用訓練好的模型對18例測試患者的CT圖像數據進行靶區和危及器官的自動分割,再將自動分割結果與醫生手動勾畫輪廓進行比較,表1列出了以幾何指數表示的分割結果,每一個幾何參數的定義將在第1.4節中詳細說明。
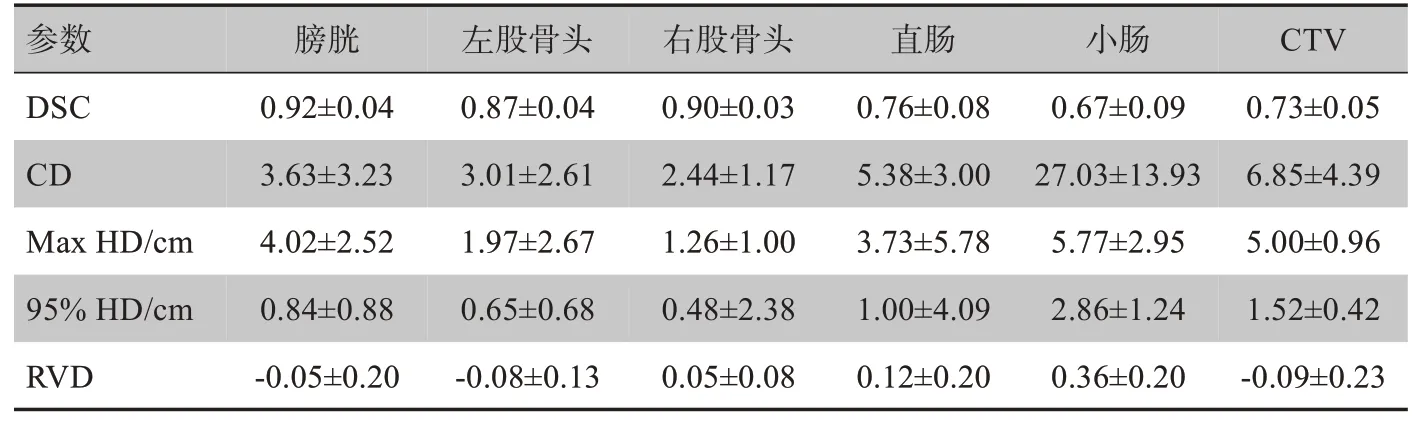
表1 以幾何參數表示的分割結果Tab.1 Segmentation results evaluated by geometric parameters
1.3 計劃設計
所有計劃均在Raystation 4.7計劃系統上進行設計,計劃靶區體積(Planning Target Volume,PTV)處方劑量為50.4 Gy/28次,危及器官的劑量限值分別為膀胱、直腸:V40<60%、V50<50%;左右股骨頭:V50<5%;小腸:V30<40%。計劃均采用容積旋轉調強(Volumetric Modulated Arc Therapy,VMAT)計劃,采用雙全弧照射(180°~181°,181°~180°),對于靶區而言,至少95%的靶區體積接受100%的處方劑量,靶區熱點劑量不超過處方劑量的107%。
1.4 幾何評估參數
參考各類評估方法,我們選取了5種廣泛應用的幾何評估參數指標[6,11-12],基于面積/體積的評估方法包括Dice相似性系數(Dice Similarity Coefficient,DSC)和相對體積差(Relative Volume Difference,RVD);基于距離的評估方法包括最大Hausdorff距離(Max Hausforff Distance,Max HD)、95%Hausdorff距離(95% Hausforff Distance,95% HD)和質心差(Centroid Difference,CD)。以醫生手動勾畫為標準來評價自動分割效果,本文中幾何參數的計算都基于開源軟件3D Slicer[13]。
1.4.1 DSCDSC是醫學圖像分割中常用的指標,其計算公式如下所示:

其中,|A|代表醫生手動勾畫的分割區域,|B|代表自動分割區域,|A∩B|代表A和B的交集。DSC的數值范圍介于0到1之間,其中1表示圖像之間完全重疊,0表示沒有重疊,數值越高代表分割效果越好。
1.4.2 RVDRVD表示分割圖像二者的體積差異,其計算公式如下所示:

其中,|A|表示自動分割結果,|B|表示醫生手動勾畫結果。
1.4.3 Max HD對于兩個給定的集合A和B,Max HD定義如下所示:
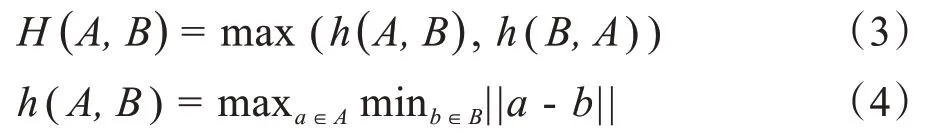
其中,||a-b||是歐幾里得距離,a和b分別是A和B邊緣上的點,同時h(A,B)通常被稱為直接HD。
1.4.4 95%HD95%HD與Max HD相似,但95%HD基于A和B中邊界點之間距離的第95個百分位的計算,其目的在于消除極端點對于分割結果的影響。
1.4.5 CDCD為兩組勾畫輪廓質心之間的距離,用于評價兩組輪廓之間的總體位置偏差,其定義如式(5)所示:
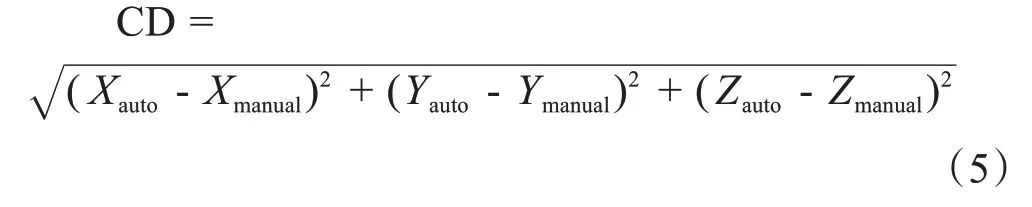
其中,(Xauto,Yauto,Zauto)為自動分割結構的質心坐標,(Xmanual,Ymanual,Zmanual)為醫生手動勾畫結構的質心坐標。
1.5 劑量評估參數
本研究為回顧性研究,利用已實施的放療計劃,分別獲得醫生手動勾畫輪廓和自動分割輪廓的劑量-體積直方圖,如圖1所示,并提取了多個劑量學參數。對于CTV,劑量學參數為ΔD95(95%靶區體積接受的最小照射劑量差)與ΔD98,對于危及器官,劑量學參數為ΔDmean,其公式如下所示:

其中,Dn,manual為醫生手動勾畫CTV劑量,Dn,auto為自動分割CTV劑量,Dmean,manual為醫生手動勾畫危及器官劑量,Dmean,manual為自動分割危及器官劑量。
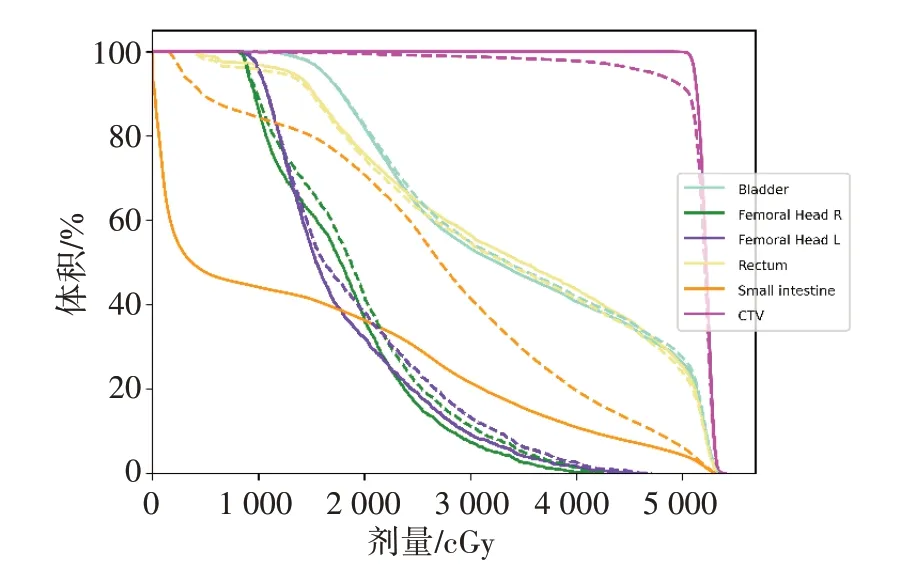
圖1 針對同一位患者醫生手動勾畫輪廓(實線)和自動分割輪廓(虛線)的劑量-體積直方圖Fig.1 Dose-volume histogram of manual segmentation contours(solid lines)and automatic segmentation contours(dashed lines)for a patient
1.6 統計學方法
所有數據均使用SPSS 20.0版(SPSS,Chicago,IL,USA)進行分析,計量資料采用均數±標準差表示,線性回歸分析探索靶區與危及器官劑量學參數與幾何參數的關系,采用Spearman相關性分析探究幾何參數間的相關性及醫生勾畫與自動分割劑量學間的相關性。P<0.05為差異有統計學意義。
2 結果
圖2顯示了對于不同ROI,醫生手動勾畫輪廓和自動分割輪廓之間的平均劑量對比。幾何參數與劑量學參數間關系如圖3所示。首先,幾何參數與劑量學參數之間的關系較弱,如圖3a所示幾何參數與劑量學參數的關系研究中,66.7%(20/30)的關聯系數R2<0.6,63.3%(19/30)的關聯系數R2<0.4。靶區及危及器官的輪廓一旦確定,其幾何參數就不會改變,而對于劑量學參數而言,它的參數選擇較廣,我們以靶區為例,分別選擇了ΔD95、ΔD98兩個參數作為劑量學參數(圖3a、圖3b),結果表明劑量學參數的選擇影響了關聯系數的數值大小,但其關聯關系仍然較弱。
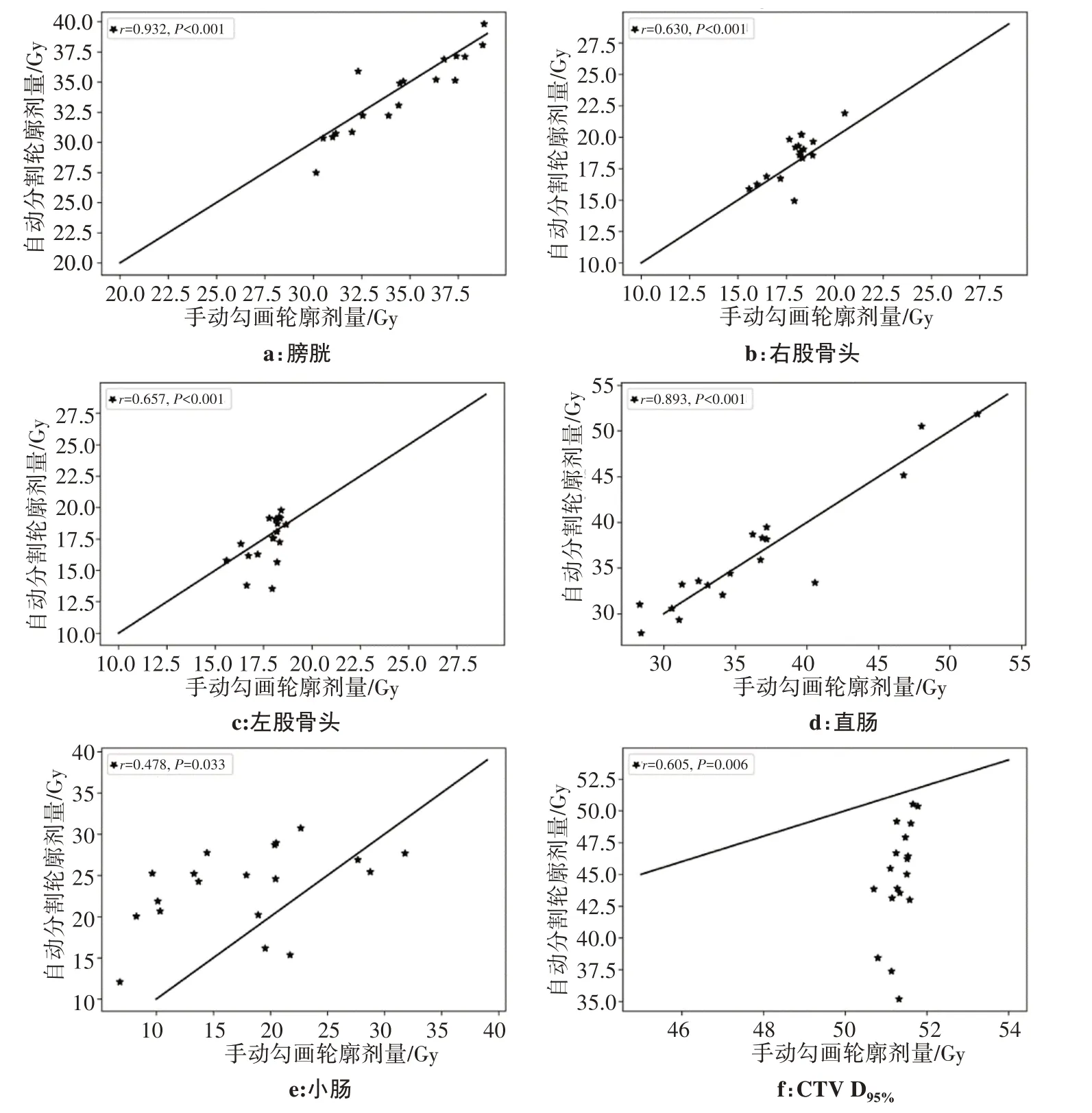
圖2 醫生手動勾畫與自動分割的劑量對比Fig.2 Comparison of dose parameters between manual segmentation and automatic segmentation
其次,幾何參數與劑量學參數之間的關系不穩定,沒有單一的幾何參數與劑量學參數始終顯示出較高或者較低的相關性(圖3a、圖3b),小腸的平均劑量ΔDmean與DSC的關聯系數R2為最高值0.922,而同樣對于DSC而言,CTV的ΔD95與其關聯系數R2僅為0.239,低于CTV與Max HD的關聯系數0.556。
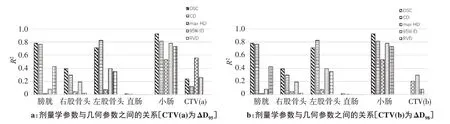
圖3 劑量學參數與幾何參數之間的關系Fig.3 Correlation between geometric parameters and dosimetric parameters
表2所示為幾何參數間的關系,相關系數|r的數值不超過0.625,CD與95%HD的關系系數|r最大,其余幾何參數間的|r|均小于0.5。
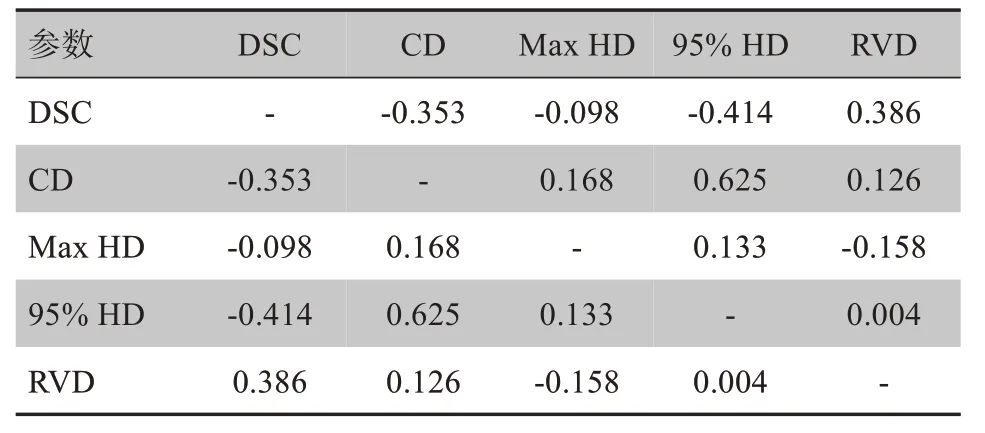
表2 幾何參數間的相關系數rTab.2 Correlation coefficient r between geometric parameters
3 討論
本研究利用基于caffe搭建的全卷積神經網絡FCN-8s對宮頸癌外照射放療中的危及器官和靶區進行自動分割,就常用的幾何評估常數而言,其分割結果優于臨床上常用的ABAS分割結果[14],因此用該模型的分割結果進行評估參數的關聯性研究是可行的。
在這項研究中,我們發現大多數幾何指數與關鍵劑量學終點之間關聯較弱且不一致,這表明使用幾何參數估算劑量學參數是不可接受的。劑量與幾何評估方法呈弱相關;幾何評估方法容易出現假陽性結果,這一般發生在危及器官上,即對于幾何學參數而言,分割結果不可以接受,然而就劑量學而言,其滿足臨床要求。一般來說,當DSC大于0.7時,可認為分割結果是可以接受的[15]。Kaderka等[16]研究表明,有時候即使DSC值很低,其劑量學參數也符合臨床要求,特別是對于小體積的危及器官。而對于靶區,評估容易出現假陰性結果,即靶區具有可以接受的幾何結果但其劑量結果不符合臨床要求,這是由于在靶區周圍具有較高的劑量梯度,相同程度的輪廓改變,其劑量影響大于對危及器官的影響。
通常在對圖像分割進行評估時,會選用不同的幾何參數對圖像分割進行評估。在我們的研究中,選取了評價標準中常見的5個參數[17-20],它們可以分為兩大類,一種是基于體積/面積的評估方式例如DSC、RVD;另一種是基于距離的評估方式如Max HD、95%HD及CD。DSC容易受結構體積/面積的影響,而對邊緣信息不敏感。例如兩組結構有相同的重疊體積/面積,而總體積/面積的和不同,將會導致其DSC值不同。基于距離的評估方式如Max HD對錯誤的點非常敏感[17]。我們的研究分析了幾種不同幾何評估參數間的關系,結果表明幾種參數間為弱相關(95%HD與CD)或者不相關。因此在對分割結果進行評估時,可以分別使用不同的參數。
本研究的不足之處在于,對于危及器官,我們僅提取了平均劑量作為劑量學參數,盡管對于靶區而言,我們選擇了ΔD95、ΔD98作為劑量學參數,但是沒有臨床上常見的CI指數。我們的結果表明,不同參數的選擇會對幾何參數與劑量學參數的相關系數造成影響,但是其趨勢及相關性強弱大致不變。因此,在后續研究中,將考慮納入更多的劑量學參數。
4 結論
在對放療領域的圖像分割結果進行評估時,應該同時考慮到幾何參數與劑量學參數。選擇幾何參數時,應聯合使用基于面積/體積的評估方式與基于距離的評估方式。

