中性粒細胞/淋巴細胞比值對晚期肝細胞癌FOLFOX肝動脈灌注化療近期療效的影響
吳林耿,陳猛,茍慶,麥啟聰,周澤健
1.廣東省人民醫院(廣東省醫學科學院)腫瘤中心介入治療科,廣東廣州510080;2.汕頭大學醫學院,廣東汕頭515041
前言
肝細胞癌(Hepatocellular Cancer,HCC)癥狀隱匿,25%~70%的患者確診時已處晚期,失去根治性治療的最佳時期[1]。靶向藥物治療(索拉菲尼和侖伐替尼)是目前最受國內外指南推薦的晚期HCC一線治療,然而因其客觀反應率低和對乙肝感染群體不敏感等限制,接受靶向治療患者的中位總生存期(Overall Survival,OS)僅為4.2~7.9個月[2-3]。因此,如何提高患者長期生存是目前晚期HCC治療中亟待解決的困局。多項研究表明,運用FOLFOX方案的肝動脈灌注化療(Hepatic Arterial Infusion Chemotherapy,HAIC)已被揭示可能作為晚期HCC一線治療有效的替代治療方法[4-5]。雖然HAIC可顯著提高晚期HCC患者的疾病無進展時間(Progression Free Survival,PFS)和OS,但其客觀緩解率(ORR)僅29.4%~40.0%。在此情況下,對治療反應提早預測并篩選出對HAIC反應不佳的人群,對晚期HCC臨床管理具有重要臨床意義。
機體的免疫微環境及慢性炎癥與腫瘤的發展、復發及轉移具有明確的相關性。外周血中性粒細胞/淋巴細胞比值(Neutrophil to Lymphocyte Ratio,NLR)是機體慢性炎癥反應的重要指標[6],其對多種腫瘤的療效、復發等具有良好的預測效能[7]。有報道表明在HCC患者中NLR能有效預測介入栓塞化療術、根治性外科切除及HAIC術后的療效及復發風險[8]。然而,目前尚未有探索NLR對FOLFOX方案的HAIC術后療效評估;此外,目前國內缺乏對NLR預測HAIC治療晚期HCC療效的研究。本研究通過對接受HAIC治療的晚期HCC患者進行回顧性研究,旨在探討FOLFOX方案的HAIC的有效性、安全性,以及NLR對療效預測的價值。
1 資料與方法
1.1 病例納入標準
對2018年1月~2019年12月在廣東省人民醫院接受FOLFOX方案HAIC治療的92例晚期HCC患者行回顧性分析。需滿足以下所有標準方納入分析:(1)經過病理學診斷或歐洲肝病學會(EASL)影像學標準[9]確診為HCC患者;(2)對靶向藥物不耐受或不同意行靶向治療患者;(3)有完整的相關病史隨訪資料及足夠長的隨訪時間;(4)預計生存期超過3個月;(5)ECGO PS評分<2分;(6)Child-Push評分A/B。
1.2 病例排除標準
符合下列條件中的任何一條,將不納入本研究:(1)同時患有嚴重的心血管疾病,如心肌梗塞、不穩定型心絞痛、恰當藥物治療后仍無法控制的高血壓、充血性心力衰竭、需藥物治療的心律失常;(2)曾患或體格檢查顯示中樞神經系統疾病(如原發性腦腫瘤、標準治療無法控制的癲癇、任何腦轉移或中風史);(3)有任何HAIC禁忌證者:門靜脈閉塞、凝血功能嚴重障礙、肝腎功能衰竭、嚴重的其他全身性疾病,如感染或糖尿病等;(4)對灌注化療所使用化療藥或造影劑過敏者;(5)曾患或現正并發其他惡性腫瘤,已治愈的基底細胞癌、原位癌除外。
1.3 手術方法
患者及家屬均對治療方式知情并簽署知情同意書。采用Seldinger穿刺法穿刺單側股動脈,使用5F RH(Terumo,日本)導管依次行腹腔動脈、肝總動脈造影(必要時行腸系膜上動脈、右腎動脈、膈動脈造影),確認腫瘤位置、數量、大小、靶血管,再使用微導管超選進入腫瘤供血動脈,留置導管及導管鞘,返病房行FOXFOL方案HAIC。具體方案如下:奧沙利鉑(130 mg/m2,第1天輸注,持續泵注時間3 h)、亞葉酸鈣(400 mg/m2,接奧沙利鉑,持續泵注時間2 h)、氟尿嘧啶(400 mg/m2,緩慢注射;2 400 mg/m2,最后連續輸注46 h)。所有化療藥物均經留置的動脈導管輸注,每3周為1個治療周期。
1.4 術后處理
化療期間常規予以護肝、護胃、抗腫瘤等支持治療,根據患者反應酌情使用止嘔、抗感染、止痛等對癥處理。
1.5 術后隨訪
所有入組患者均在治療前1周內行常規血液檢查,每間隔3周血常規復查,每6周影像學復查。終止治療的標準包括影像學評價進展,不可耐受的不良反應,死亡或患者拒絕進一步治療,另外病灶降期為可接受根治性手術亦作為標準。主要研究終點為PFS和肝內腫瘤無進展生存時間(ITPFS),腫瘤緩解率和安全性。PFS定義為從開始治療到影像學評估進展或死亡的時間。ITPFS被定義為從開始治療到影像學評價肝內腫瘤進展或死亡的時間。腫瘤緩解率包括客觀緩解率(ORR)和疾病控制率(DCR)。ORR定義為在首次放射學確診后,具有完全緩解加部分緩解并維持至少4周的患者的百分比,DCR為ORR加穩定疾病的患者的百分比。使用mRECIST標準評估患者治療療效,通過兩名放射科醫師獨立評估,以減少誤差的可能性。
1.6 統計學方法
采用SPSS19.0統計學軟件,符合正態分布的計量資料用均數±標準差表示,采用t檢驗;計數資料采用χ2檢驗,Kaplan-Meier描繪PFS生存曲線,生存率比較使用Log-Rank法檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 基線資料
入選患者年齡(53.4±12.8)歲,男82例、女10例。肝動脈灌注化療前NLR<4.0組53例,NLR≥4.0組39例。兩組中最常見的既往治療方法是靶向藥物治療,其他既往治療方法包括中藥治療等(表1)。在配對隊列中,各組之間在基線方面的任何主要混雜因素之間均不存在顯著差異。入組病例的基線人口統計學和臨床特征見表2。共入組92例患者,其中72例(78.3%)感染乙型肝炎病毒(HBV),所有入組HBV患者均進行了抗病毒治療。所有入組患者在治療過程中均未出現腫瘤治療相關死亡,治療并發癥以嘔吐、腹痛為主,對癥支持治療后均可緩解。
表1 HCC患者按NLR分層的既往治療Tab.1 Previous interventions of hepatocellular cancer(HCC)patients grouped according to neutrophil to lymphocyte ratio(NLR)

表2 不同NLR分組HCC患者基線特征Tab.2 Baseline characteristics of hepatocellular carcinoma patients grouped according to NLR
2.2 療效評估
根據mRECIST標準進行評價,沒有患者取得完全緩解(CR),29位(31.5%)患者獲得部分緩解(PR),ORR為31.5%,同時10位(10.9%)患者獲得疾病穩定(SD),DCR為42.4%,而53位(57.6%)患者疾病進展(PD)。NLR<4.0組患者的ORR顯著高于NLR≥4.0組患者(41.5%vs17.9%,P=0.016)。NLR<4.0組患者的DCR顯著優于NLR≥4.0組(52.8%vs28.2%;P=0.018)。
2.3 近期生存
中位隨訪時間為14.5個月(范圍為6.3~20.6個月)。在隨訪期間,所有患者均發生疾病進展。中位PFS為3.9個月(95%置信區間為3.1~4.7個月),中位ITPFS為5.4個月(95%置信區間為4.7~6.1個月)。單獨針對肝內病灶進行療效評估,NLR<4.0組的中位PFS(月)較NLR≥4.0組更長(6.1vs4.1,P=0.013)。針對全身腫瘤病灶進行療效評估,NLR<4.0組和NLR≥4.0組之間的中位PFS(月)也有顯著差異(4.3vs3.1,P=0.022)。
2.4 多因素Cox分析
將影響HAIC術后HCC近期療效的危險因素[NLR≥4.0、AFP≥400 ng/mL、腫瘤直徑>5 cm、肝硬化病史、HBsAg陽性、血管侵犯及遠處轉移]列入多因素Cox風險回歸模型,結果顯示術前高NLR是預測HAIC術后近期療效的獨立不良影響因子[OR(95CI%)=2.448(1.138~5.265),P=0.031]。見表3。
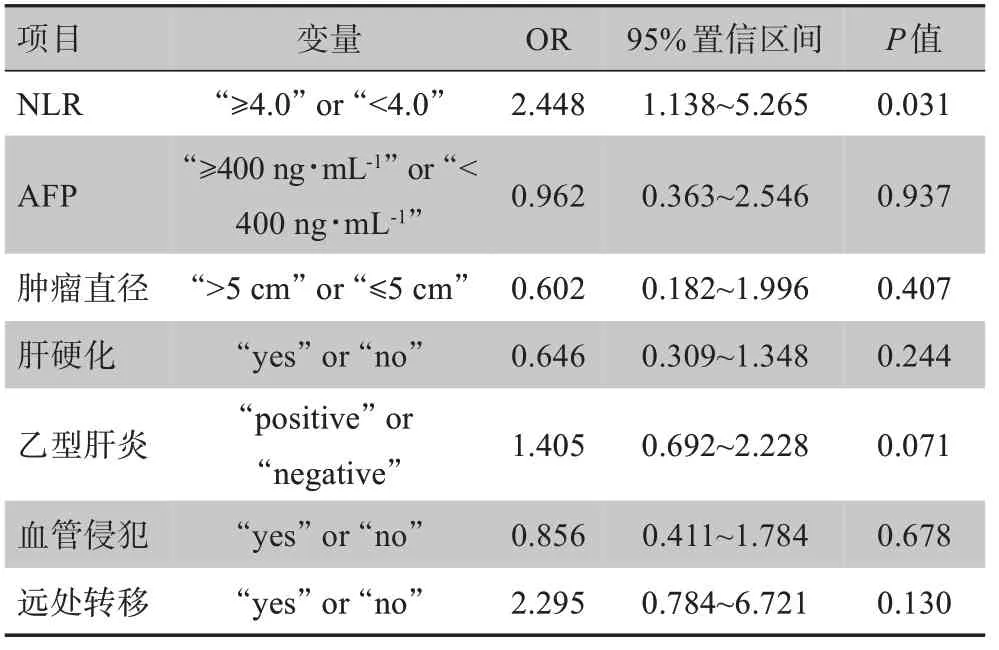
表3 HCC患者HAIC術后影響PFS的多因素Cox風險回歸模型分析Tab.3 Multivariate Cox risk regression model analysis of factors affecting postoperative progression free survival in HCC patients receiving hepatic arterial infusion chemotherapy
3 討論
慢性炎性改變在腫瘤發生、發展中的作用已經被廣泛研究[10]。實體腫瘤自身可誘導周圍炎性微環境,NLR作為檢測指標反映身體對腫瘤的炎性反應。腫瘤微環境中含有多種細胞因子或趨化因子,可促進腫瘤生長并抑制白細胞對腫瘤細胞的攻擊[11]。中性粒細胞在腫瘤微環境中可在TGFβ作用下獲得非炎癥表型,從N1型(促炎癥)變為N2型(抗炎癥),使腫瘤得以生長而不受任何免疫干擾,增強腫瘤細胞侵襲、轉移能力并逃避機體免疫系統監視[12]。淋巴細胞在腫瘤或病毒感染的先天性或適應性免疫反應中起重要作用,通過抑制腫瘤細胞增殖及轉移的能力,維持癌細胞免疫平衡起到抑制腫瘤進展作用[13-14]。因此,NLR作為一種反映機體炎癥反應及免疫應答狀態的良好標記物,可用于預測腫瘤患者的治療反應及預后。
近年來,晚期HCC患者一線治療的局限性一直備受關注,如何提高晚期HCC患者長期生存已是目前臨床研究的熱點。多種免疫檢查點抑制劑被推薦用于晚期HCC聯合或二線治療,然而晚期HCC患者總體5年生存率仍然<12%。因此臨床上亟需新的補救治療方法或替代治療。基于FOLFOX方案HAIC治療晚期HCC已被既往研究證實可顯著提高患者的生存期,且具有可接受的毒性作用。本研究回顧性分析92例接受HAIC治療的晚期HCC患者,ORR和DCR分別是31.5%和42.4%,與Lyu等[4]研究結果相似。這提示雖然HAIC對晚期HCC有良好的治療效果,但較低的ORR極大地限制晚期HCC的預后,特別是對于伴有靜脈侵犯的病人,如何在術前高效地評估晚期HCC患者的治療反應及預后是臨床上亟需解決的問題。
根據國內外多個研究發現,NLR可能是HCC或肝病研究領域的一個獨立預后指標[15-16]。NLR作為一種無需繁雜檢測、價格低廉的臨床參數,擁有良好的臨床應用前景。本研究中,我們分別評估了高NLR組及低NLR組患者治療反應情況,發現NLR<4.0組患者的ORR、DCR顯著比NLR≥4.0組患者高,尤其對于肝內病灶的療效評估中,該差異更為顯著;在生存獲益方面,NLR<4.0組的中位PFS較NLR≥4.0組更長,雖然有肝外轉移患者的PFS較短[4],但肝內病灶進展是引起肝功能衰竭死亡的主要原因[17],肝內病灶的有效控制有利于提高患者遠期生存期。Bruix等[18]研究發現病灶無肝外擴散、丙型肝炎病毒患者、NLR≤3.1的肝癌患者使用索拉菲尼治療療效更佳。此外,有研究報道認為索拉菲尼聯合FOLFOX方案的HAIC治療對伴有門靜脈侵犯的晚期HCC患者總生存率高于索拉菲尼,且具有較高的安全性[19]。由此可見,FOLFOX方案HAIC可能是晚期HCC患者一項有效的替代治療,而NLR作為一個療效及預后的預測指標,能夠有效幫助臨床醫師提早識別出可能對HAIC治療反應不佳的患者,制定更有效的替代治療方案,極大地改善晚期HCC患者的預后,可為晚期HCC患者的治療提供新思路。

