外周血單個核細胞miR-150表達對STEMI患者PCI術后發生左心室重構的預測價值
高紅霞,楊彩霞,任剛
(鐵嶺市中心醫院 心內科,遼寧 鐵嶺 112000)
盡管經皮冠狀動脈介入(percutaneous coronary intervention,PCI)可迅速恢復心肌灌注,但仍有部分患者會出現左室功能障礙,從而導致不利的心肌重塑[1]。左心室重構(left ventricular remodeling,LVR)過程大大增加了嚴重心血管不良事件包括死亡的風險[2]。因此對LVR進行早期危險分層有助于對高危患者進行密切觀察和更積極的治療。微小RNA(miRNAs)的發現為識別生物標志物和開發新的治療工具提供了新的機會。最近有學者發現miR-150對于大鼠成纖維細胞增殖活性具有負性調節作用[3],其在心肌梗死邊緣區表達下降,且可通過靶基因c-Myb改善心肌纖維化[4];此外羅穆玲等[5]也證實老年慢性心衰患者血清miR-150表達與心室重構有關。在本研究中,我們旨在探討ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者PCI術后外周血單個核細胞(peripheral blood mononuclear cells,PBMCs)中miR-150表達與LVR發生的潛在關系。
1 對象與方法
1.1 研究對象
2018年3月至2019年1月在我院接受急診PCI術的165例STEMI患者完成本隊列研究,患者以典型急性胸痛和持續性ST段抬高為特征[≥30 min,以V2~V3導聯ST段抬高(在J點處)≥0.2 mV(男性)或ST段抬高≥0.15 mV(女性)為基礎表現,完成心梗4項檢查],發病24 h內行急診PCI術。如果PCI術失敗(病變部位殘留狹窄>30%)、預計生存時間<12個月、合并肝硬化或其他嚴重心臟病變(心瓣膜病、心肌病或心包膜疾病)、有腎臟病史、已知的惡性腫瘤、炎癥或嚴重感染性疾病者,則被排除在本研究之外。在1年的隨訪期間,所有患者服用阿司匹林100 mg·d-1和氯吡格雷75 mg·d-1,并在1年后進行超聲心動圖評估。本研究方案得到了我院倫理委員會的批準,所有患者都簽署了書面的知情同意書。
1.2 超聲心動圖檢查
所有患者PCI術后7 d和隨訪1年后接受經胸超聲心動圖檢查(飛利浦iE33型超聲心動圖儀)。靜脈注射0.5 ml造影劑SonoVue,保存心尖部四腔心切面和心尖部二腔心切面的視圖,通過雙平面法測量左室舒張末期容積(left ventricular end-diastolic volume,LVEDV)、收縮末期容積(left ventricular end-systolic volume,LVESV)和左室射血分數(left ventricular ejection fraction,LVEF)。術后1年復查超聲心動圖時,若LVEDV比出院時增加≥20%則定義為LVR[6]。超聲心動圖的檢查由2位經驗豐富的技師完成,并對獲得的數據進行離線處理。根據復查時是否發生LVR,將患者分為LVR組和非LVR組。
1.3 實時熒光定量PCR法檢測PBMCs中miR-150表達
所有患者PCI術后7 d采集外周血樣本,儲存在經EDTA-2K處理過的試管里。采血時間點與第1次超聲心動圖檢查時間一致。然后,采用試劑盒(美國cedarlane公司)用淋巴溶解液分離PBMCs。在提取RNA之前,PBMCs在無菌PBS中洗滌2次。用Trizol從PBMCs樣本中提取總RNA。用NanoDrop 2000分光光度計檢測光密度(optical density,OD)260/OD280和OD260/OD230,測定RNA的濃度和質量。應用All-in-OneTMmiRNA qRT-PCR檢測試劑盒(美國Gene Copoeia公司)對總miRNAs進行逆轉錄,轉化為cDNA。將cDNA樣本保存在-20 ℃冰箱中。采用SYBR Green miRNA分析試劑盒(AceQTMqPCR Kit,中國Vazyme Biotech公司)配制20 μl PCR反應體系,包含1.0 μl cDNA模板和各0.5 μl上下游引物。miR-150引物:正向5′-CTGTGTCCTGCCAGTGGTTTT-3′,反向5′-CGGTATCCTGTCCGTGGTTCT-3′;內源性對照小分子U6 mRNA引物:正向5′-CGCGTTCGGCCACATAC-3′,反向5′-CAGGCCATGCTCTAATCTT-3′。PCR參數:95 ℃單循環5 min,95 ℃ 10 s和65 ℃ 40 s循環40次。PCR在ABI ViiA7實時PCR系統(美國Applied Biosystems公司)上完成。用2-ΔΔCt法測定miR-150表達量,并以小分子U6 mRNA作為內控。
1.4 其他實驗室指標檢測
PCI術后7 d檢測各項實驗室指標,取血樣置于真空管中,立即轉移到中心實驗室,分別檢測血漿N端腦鈉肽前體(N-terminal pro-brain natriuretic peptide,NT-proBNP)、心肌肌鈣蛋白I(cardiac troponin I,cTnI)、肌酸激酶同工酶MB(creatine kinase MB type,CK-MB)、C反應蛋白(C-reactive protein,CRP)。用電化學發光免疫分析法(Roche Elecsys E170電化學發光儀)檢測血漿NT-proBNP水平,采用雙抗體夾心法(Roche Elecsys 2010 電化學發光免疫分析儀)檢測血漿cTnT、CK-MB水平,用膠乳增強免疫透射比濁法(Roche Cobas 8000自動化學分析儀)檢測血漿CRP水平。
1.5 雙熒光素酶報告基因分析
用含有10%胎牛血清、1%L-谷氨酰胺和1%青霉素-鏈霉素的DMEM培養基培養人HEK293T細胞,用于熒光素酶活性測定。用Lipofectamine 2000(美國Invitrogen公司)和10 ng報告質粒共轉染細胞,報告質粒包含熒光素酶報告基因下游插入CRP的3′非翻譯區(3′UTR)和30 nmol·L-1miR-150模擬物或陰性對照作為miR-150 mimics組和miR-NC組。分別與CRP 3′UTR野生型序列或突變型序列轉染24 h后用雙發光試劑盒(美國Genecopoeia公司)測定熒光素酶活性。
1.6 統計學處理
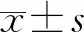
2 結 果
2.1 兩組一般資料比較
隨訪1年,35例患者發生LVR,LVR發生率為21.21%。所有患者PCI術后都達到TIMI3級血流。LVR組和非LVR組STEMI患者的年齡、性別、體重指數、吸煙史、既往疾病史、罪犯血管類型、冠脈病變支數、支架選擇及PCI術后用藥情況比較,差異均無統計學意義(均P>0.05,表1)。
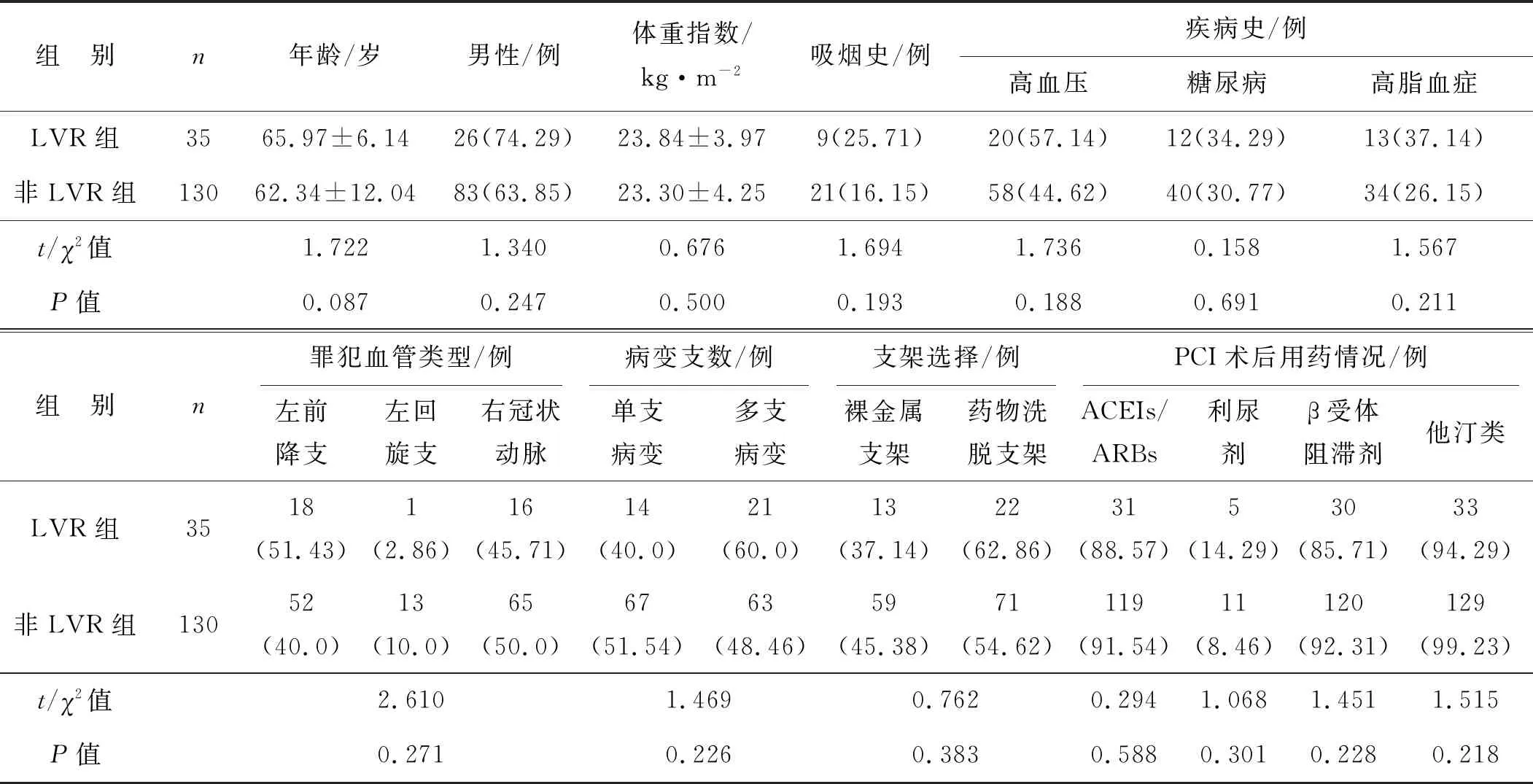
表1 兩組STEMI患者一般資料的比較
2.2 兩組術后7 d各項實驗室指標的差異
與非LVR組相比,LVR組患者血漿NT-proBNP、cTnI、CK-MB、CRP水平升高,同時PBMCs中miR-150相對表達量降低,差異均有統計學意義(均P<0.05,表2)。
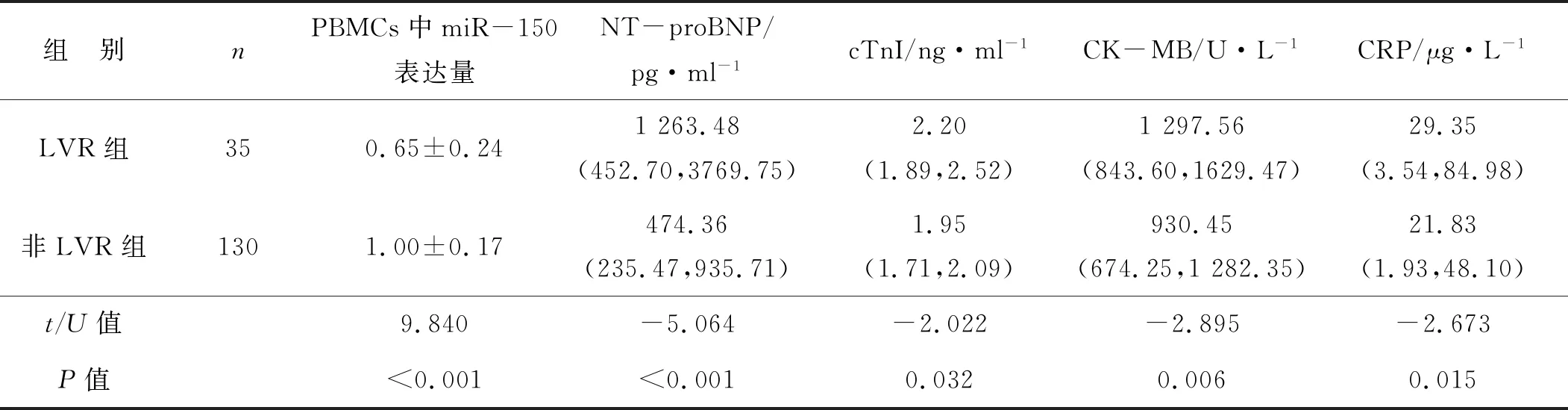
表2 兩組STEMI患者PCI術后7 d PBMCs中miR-150表達量及血漿NT-proBNP、cTnT、CK-MB、CRP水平的比較
2.3 影響STEMI患者PCI術后發生LVR的危險因素
經多因素Logistic回歸分析,STEMI患者PCI術后7 d時PBMCs中miR-150表達量、血漿CK-MB水平以及LVEF都是STEMI患者PCI術后發生LVR的獨立預測因素(P<0.05,表3)。
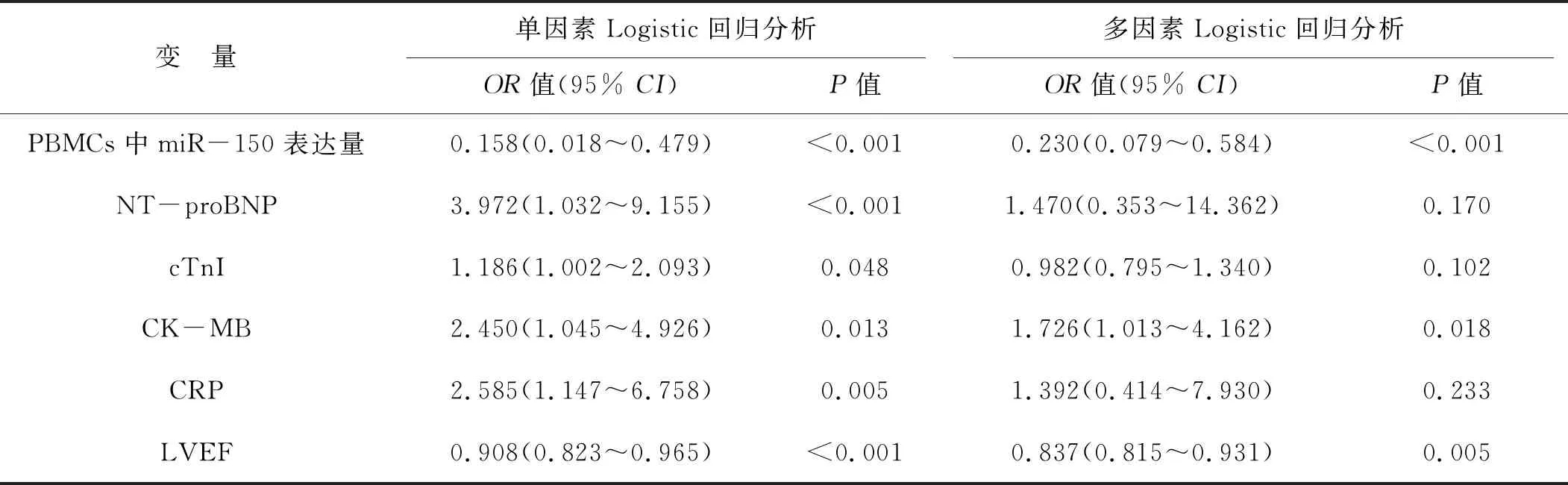
表3 單因素和多因素Logistic回歸分析影響STEMI患者PCI術后發生LVR的臨床因素
2.4 PCI術后7 d時PBMCs中miR-150表達量、血漿CK-MB水平以及LVEF對LVR發生的預測價值
ROC曲線分析顯示,PCI術后7 d PBMCs中miR-150表達量和聯合指標預測LVR的曲線下面積(area under curve,AUC)大于單獨使用LVEF的AUC,差異有統計學意義(Z=-3.327、3.458,均P<0.05)(表4)。
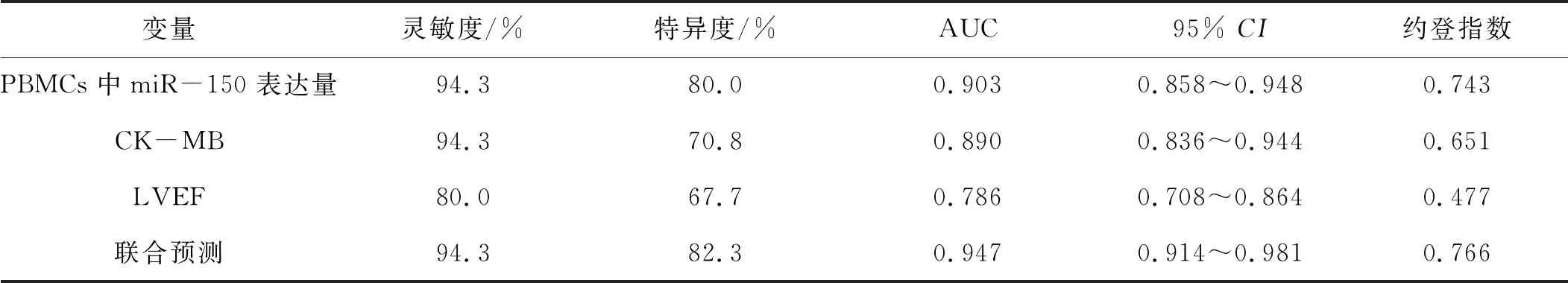
表4 ROC曲線分析PCI術后7 d時PBMCs中miR-150表達量、血漿CK-MB水平以及LVEF對LVR的預測價值
2.5 雙熒光素酶報告基因分析miR-150和CRP的關系
生物信息學分析顯示,miR-150和CRP之間存在互補堿基對。熒光素酶報告基因分析顯示,miR-150模擬物抑制了CRP-3′UTR-WT的熒光素酶活性(P<0.05,圖1)。
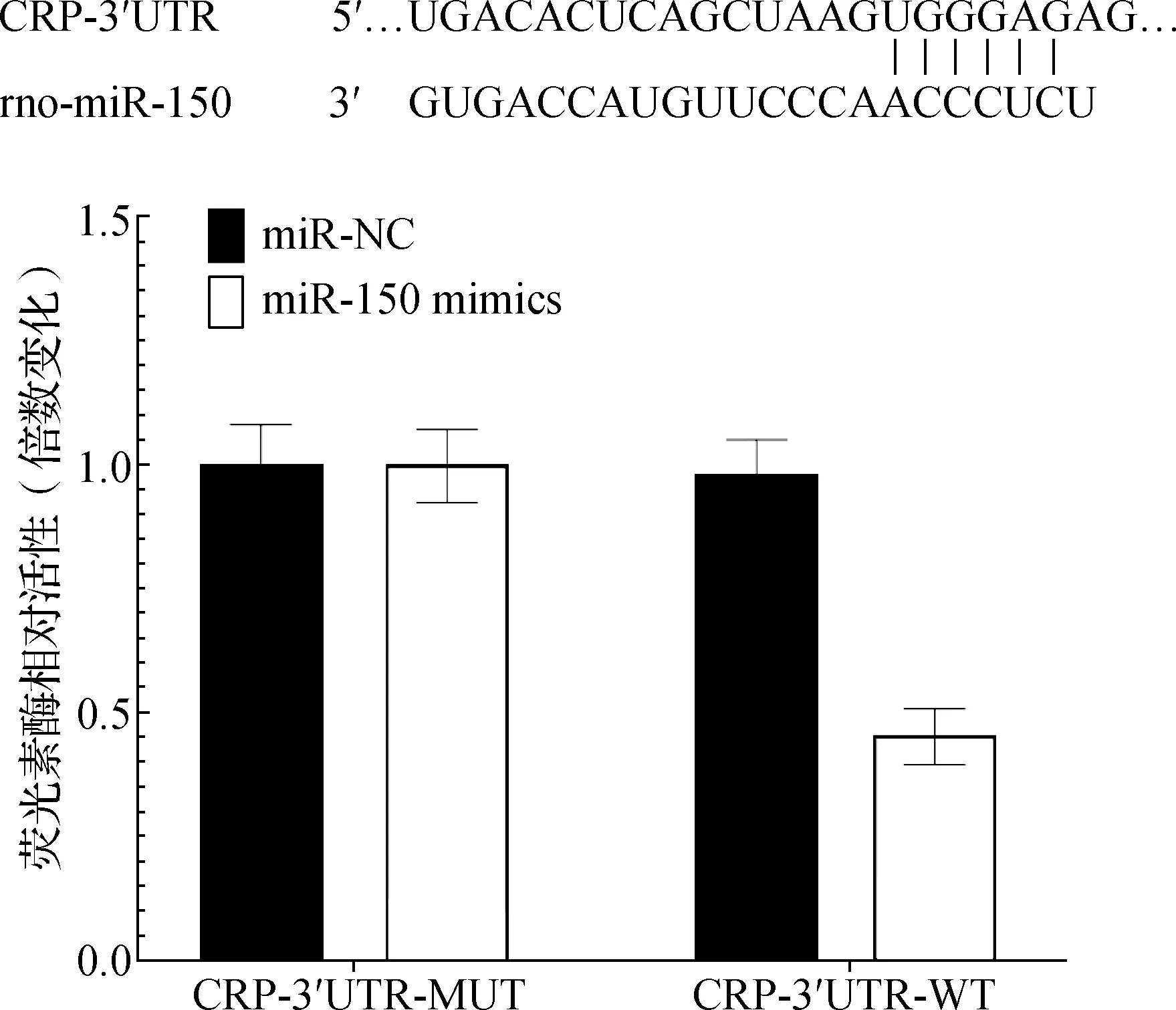
圖1 雙熒光素酶報告基因法測定CRP mRNA和miR-150的靶向調控關系
3 討 論
對于STEMI患者PCI術后發生LVR,是導致死亡的重要危險因素之一[7]。因此,在分子水平上尋求對生物學途徑的更深入了解,以及尋找可能預測LVR的潛在指標具有重要的臨床價值。在本研究中,我們測定了STEMI患者PCI術后7 d時PBMCs中miR-150以及血漿cTnI、CK-MB、NT-proBNP的濃度,并評價LVEF,以確定這些生物標志物是否能在1年內預測LVR的發生。與未發生LVR的患者相比,LVR組患者PCI術后7 d時血漿NT-proBNP、cTnI、CK-MB水平升高,同時PBMCs中miR-150相對表達量降低;此外LVEF降低也是影響LVR發生的獨立危險因素之一。雖然既往有報道指出,急性期cTnI和NT-proBNP濃度可以預測LVR,但是STEMI患者PCI術后影響這兩項指標的客觀因素太多,因此他們對于LVR的預測能力較差。我們發現PCI術后7 d時PBMCs中miR-150表達、血漿CK-MB水平以及LVEF可以預測PCI術后1內發生LVR的風險。
心肌梗死后LVR的機制是多因素的。心肌細胞壞死觸發的細胞內信號調節擴張、肥大和膠原瘢痕的形成過程[8]。在心肌梗死早期,心室擴張和室壁變薄主要是由梗死區擴張引起的。隨著時間的推移,血管壁張力增加,微循環功能障礙和炎癥介質進一步推動腎素-血管緊張素-醛固酮系統和擬交感神經系統,導致心肌細胞肥大和代償性左心室擴張[9]。以往的研究表明,心肌損傷程度與LVR相關[10]。本研究中我們也發現LVR組和非LVR組患者在PCI術后7 d時血漿NT-proBNP、CK-MB水平差異有統計學意義,而且血漿CK-MB水平和LVEF是1年內發生LVR的獨立預測指標。其可能的解釋為,在心肌梗死后早期,大面積梗死區擴大后,可能通過非梗死性心肌肥大和球形左室重塑進行更大程度的后期重塑,作為全面心肌功能減退的代償機制(Frank-Starling效應)[11]。
miRNAs是以細胞和組織特異性方式表達的短寡核苷酸,具有調節基因表達和器官(包括心肌)功能的作用。由于在人類外周血液中發現了它們的存在,并具有穩定性,miRNAs已經顯示出作為心血管疾病循環生物標志物的潛力[12]。一些研究已經報道了miRNAs表達失調在心臟衰竭或心肌肥厚中的功能性作用。Ma等[13]報道急性心肌梗死患者入院時血液循環miR-1是6個月內發生心室重塑的獨立預測指標,而且與之前的臨床測量結果相比顯示出更高的預測效能。在本研究中,我們則發現PCI術后7 d PBMCs中miR-150表達水平降低可以預測STEMI患者PCI術后1年內LVR的發生風險。雖然miR-150的預后價值已經在膿毒癥[14]、急性白血病[15]患者中被報道過,但是與心肌梗死后LVR的關系尚未見明確的臨床報道。在一些基礎研究和其他疾病研究中,miR-150被證實是與炎癥有關的調節基因,而且主要表達于單個核細胞中。由于炎癥是心肌梗死后LVR發展的關鍵機制,未來的研究需要確定 miR-150在這種重塑中的作用。Luo等[16]通過對ApoE-/-小鼠模型注射miR-150 mimics,發現可以通過干擾PTX3、NF-κB1和RELA表達促進內皮細胞增殖、遷移,抑制血管重構。Devaux等[3]通過冠狀動脈結扎構建心肌梗死小鼠模型,誘導心肌梗死15 d后,小鼠左心室擴張,心肌梗死區可見明顯的膠原沉積;并且與假手術小鼠心肌組織及心肌遠緣區和邊緣區相比,心肌梗死區miR-150的表達降低。我們的研究結果與之一致。在本研究中,我們通過生物信息預測miR-150可以調節相關下游基因,其中miR-150和CRP之間存在互補堿基對。而且經過雙熒光素酶報告基因分析,miR-150 mimics可以抑制CRP-3′UTR-WT的熒光素酶活性。然而由于CRP屬于急性期炎癥相關蛋白,有研究顯示,在PCI術后48 h內測定CRP對臨床結果有顯著的預測價值,雖然CRP升高可持續1周,卻易受到多種合并癥、手術操作、心理應激等外源性因素的干擾,因此在本研究中,雖然LVR組患者血漿CRP水平高于非LVR組患者,但是多因素Logistic回歸分析中,CRP并不是LVR發生的獨立預測指標。miR-150主要由循環單個核細胞分泌,轉移到內皮細胞,并以旁分泌的方式調節其遷移[17]。本研究結果進一步支持了PBMCs中miR-150的相對表達量降低與左心室不利重塑有關。
綜上所述,我們發現PCI術后7 d PBMCs中miR-150表達、血漿CK-MB水平和LVEF是1年內發生LVR的獨立預測因子。尤其是PBMCs中miR-150表達降低對1年內LVR發生風險的預測價值較高,這可能與其誘導CRP表達上調有關。因此,PBMCs中miR-150有望成為預測LVR發生的新的生物標志物。

