pH/鹽雙敏感型聚離子液體凝膠的制備及對環丙沙星的控制釋放*
趙亞梅,劉星悅,李澤城,曹婷婷,楊 靖,丁思奇
(1. 西安工程大學 環境與化學工程學院,西安 710600;2. 西安工程大學 城市規劃與工程學院, 西安 710600)
0 引 言
人體組織器官中的pH、離子強度、磁場等差異大,藥物分子在人體的釋放與輸送過程中會遇到許多障礙,這極大地降低了治療效果[1-2]。與現有的顆粒載體[3]、聚合物凝膠[4]和脂質[5]等藥物載體相比,智能響應凝膠能對pH值、光、溫度等周圍環境的細微改變做出相應響應[6-10],具有獨特的理化性質,如優異的生物相容性,高吸水性,可調節的孔隙率[11-13],對藥物的釋放速度和釋放位置有一定調控能力,有望成為良好的藥物受控釋放基質。pH/鹽雙敏感型聚離子液體凝膠兼具聚離子液體和智能響應凝膠特征,如具有帶正電荷的化學基團[14-16],對微生物具有良好的抗菌性[17-18],能根據體內各個器官所處環境的酸堿性和離子強度差異來調節藥物的釋放,使藥物在特定時間和部位釋放[19-21],減少不良反應并增加藥物的預期效果。因此,pH/鹽雙敏感型聚離子液體凝膠在高性能藥物輸送系統中有潛在的應用價值。
本文基于離子液體型單體結構設計,制備了系列pH/鹽雙敏新型聚咪唑類離子液體凝膠PCnvimBr,探討離子液體型單體的側鏈鏈長微增長對PCnvimBr凝膠的溶脹性能、pH、鹽刺激響應行為影響,在此基礎上,研究了pH/鹽雙敏型PCnvimBr凝膠對腸道抗菌藥物的控制釋放行為。
1 實驗部分
1.1 材料與儀器
N-乙烯基咪唑,溴乙烷,溴丁烷,溴己烷,對苯二酚,偶氮二異丁腈(AIBN),乙腈,乙酸乙酯,N,N’-亞甲基雙丙烯酰胺(MBA),無水甲醇與無水乙醇均為分析純,在所有實驗中均使用超純水。
DZF-6020AB真空干燥箱,DF101S集熱式恒溫加熱磁力攪拌器,SH2-88A恒溫振蕩器,FD-1冷凍干燥機,FlexSEM1000掃描電鏡,Nicolet 5700傅立葉變換紅外光譜儀(KBr壓片),XRD-MiniFlex600X-射線衍射儀,TGA/SD TA85型熱重分析儀,日本島津UV2450紫外-可見分光光度計。
1.2 PCnvimBr凝膠的合成
稱取一定量N-乙烯基咪唑于三口燒瓶中,氮氣保護條件下,加入不同烷基鏈長的溴化物,再加0.1 g對苯二酚阻聚劑,70 ℃回流攪拌20 h,得到三種咪唑類離子液體,產物經乙腈和乙酸乙酯溶解沉淀后,60 ℃真空干燥12 h。然后,稱取一定量中間產物離子液體單體和交聯劑N,N-亞甲基雙丙烯酰胺,溶于甲醇和乙醇各2.5 mL的混合溶劑中,攪拌均勻,再加偶氮二異丁腈使其溶解,通N210 min后密封體系,70 ℃恒溫油浴反應4 h,得到聚咪唑類離子液體凝膠(PCnvimBr,n=2,4,6)。產物浸入乙醇并定時換至溶液澄清后,再浸入超純水以除去未反應的單體及剩余的交聯劑和引發劑。
1.3 PCnvimBr凝膠溶脹性能的測定
取一定量干凝膠置于超純水中,隔一段時間后,測試凝膠的質量。將浸泡前后凝膠的質量代入公式,計算其溶脹率(SR)。溶脹率計算公式如(1)式:
溶脹率=(mt-md)/md×100%
(1)
式中,mt表示t時刻濕凝膠的質量,md表示干凝膠的質量。
1.4 PCnvimBr凝膠的pH、鹽敏感性以及溶脹可逆行為
將干凝膠切片后稱重,分別置于不同pH值的溶液中(pH=3,4,5,6,6.8,7,7.4,8,9,10),每隔一定時間取出稱重,直到溶脹平衡,計算其平衡溶脹率來研究凝膠的pH敏感性。
常溫下,將一定質量干凝膠分別浸入不同濃度NaCl溶液中(0.3,0.6,0.9,1.2,1.5 mol/L),每隔一定時間取出稱重,直到凝膠溶脹平衡,通過計算其溶脹率來研究鹽敏感性。
常溫下,將一定質量干凝膠交替浸入超純水和0.15 mol/L NaCl溶液中,每隔一定時間取出稱重,計算凝膠在不同時刻的溶脹率,研究凝膠在超純水-鹽溶液循環體系中的溶脹-收縮可逆行為。
1.5 PCnvimBr凝膠對環丙沙星的體外釋放實驗
采用擴散法將環丙沙星負載到PCnvimBr凝膠上,冷凍干燥備用。稱3份載藥干凝膠放入錐形瓶中,加入模擬人體腸胃pH環境的緩沖溶液(pH=1.2,6.8,7.4),水浴恒溫振蕩測試。隔一定時間取樣,再補充同體積模擬液,用紫外-可見光分光光度計在277 nm波長下檢測并記錄。根據標準曲線計算濃度,按(2)式計算環丙沙星累積釋放率:

(2)
式中,Ve是取出的釋放液體積,V0是釋放介質的總體積,Cn是第n次取出的釋放液中的環丙沙星的濃度,m是載藥凝膠中環丙沙星的含量。
2 結果與討論
2.1 PCnvimBr凝膠制備條件的優化
采用自由基聚合技術合成了PCnvimBr凝膠。改變交聯劑和引發劑用量,所制備的PCnvimBr凝膠性能會發生改變,因此設計實驗來確定凝膠制備的最優條件(表1)。
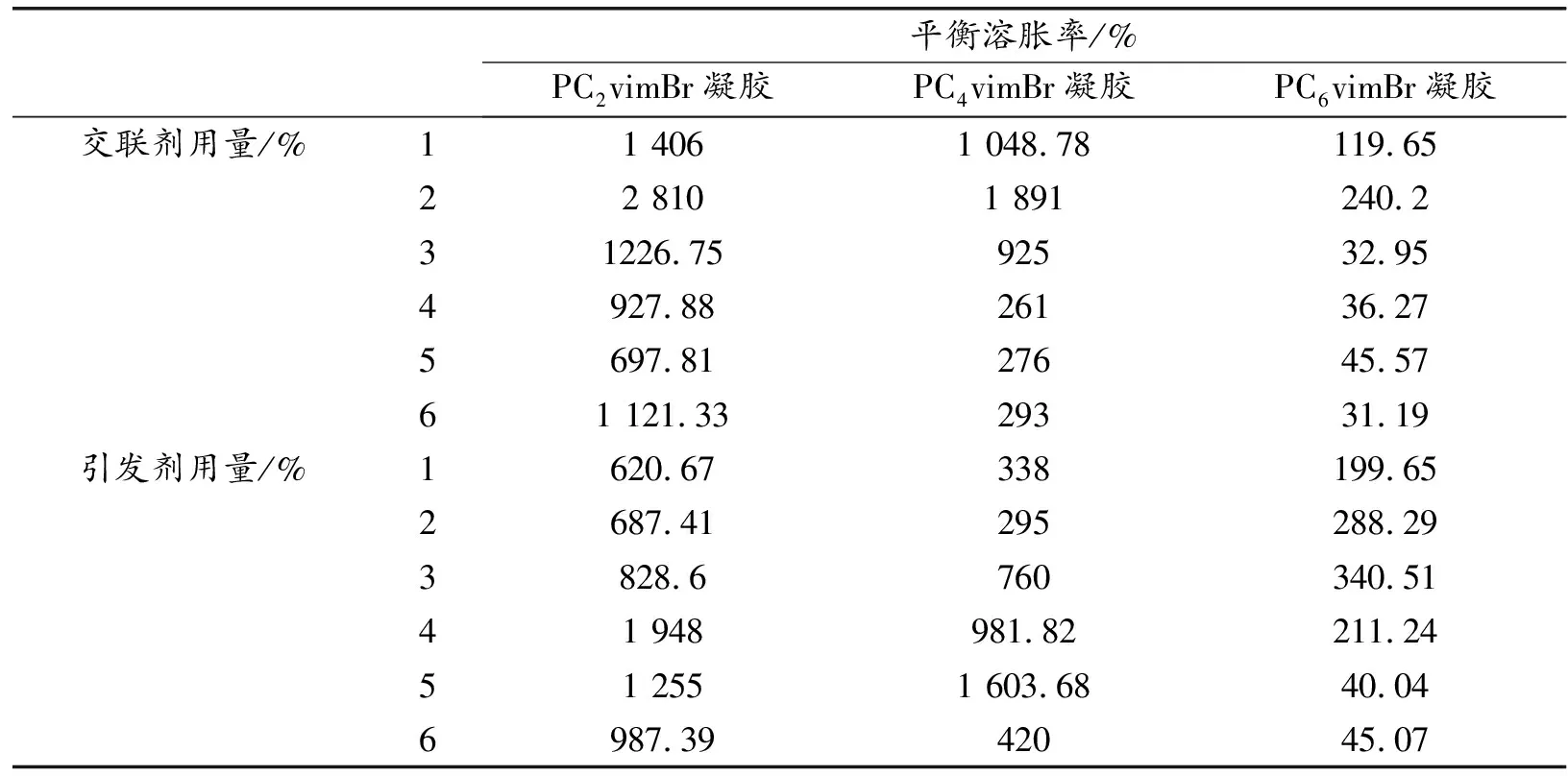
表1 PCnvimBr凝膠的合成及平衡溶脹率
PCnvimBr(n=2,4,6)凝膠的最佳交聯劑用量均為離子液體單體質量的2%,最佳引發劑用量分別為離子液體單體質量的4%,5%和3%。當引發劑用量一定時,隨著交聯劑用量的增加,凝膠容易形成三維網絡結構,平衡溶脹率升高;繼續增加交聯劑用量,交聯密度過大,水很難進入凝膠內部,平衡溶脹率降低。此外,當交聯劑用量一定時,增加引發劑用量,引發活性中心增多,溶脹能力提高;若繼續增加引發劑用量,鏈終止反應加劇,單體間發生均聚反應的程度加大,導致平衡溶脹率降低。從表中也可以看出,隨著PCnvimBr凝膠中烷基鏈增長,平衡溶脹率降低,是因為凝膠的溶脹能力與物質的結構及聚集狀態有關,長烷基鏈可能會影響離子液體的雙親性和有序聚集狀態,使形成凝膠的網絡更緊實,分子難以進入凝膠內部。
2.2 PCnvimBr凝膠表征
2.2.1 FTIR光譜
將干凝膠樣品研磨至粉末,KBr壓片制樣,用FTIR光譜儀進行表征。PCnvimBr凝膠的FTIR譜圖見圖1(a),1 645 cm-1處出現N,N-亞甲基雙丙烯酰胺上的C=O特征吸收峰,1 458 cm-1處是咪唑環C=N伸縮振動。與圖1(b)離子液體型單體的FTIR譜圖相比,圖1(a)中1 650 cm-1處未出現碳碳雙鍵C=C彎曲振動吸收峰,說明離子液體型單體發生了聚合。

圖1 (a)PCnvimBr凝膠和(b)離子液體的紅外光譜圖Fig 1 Infrared spectrum of PCnvimBr gels and ionic liquids
2.2.2 熱重分析
PCnvimBr凝膠的TG-DTG曲線見圖2,從圖中可得出,失重過程具有50~195 ℃和275~400 ℃兩個失重區域。50至195 ℃低溫失重是因為凝膠網絡吸附水的損失;275至400 ℃高溫失重率較明顯,約為85%,可能是由于離子液體碳鏈斷裂、側鏈咪唑環的分解以及交聯劑降解引起的。PCnvimBr(n=2,4,6)最大失重溫度分別為327.167,315.833和305.5 ℃(圖2b),具有良好的熱穩定性,說明該類凝膠能在較寬的溫度范圍內使用。

圖2 PCnvimBr凝膠的TG-DTG曲線Fig 2 TG-DTG curve of PCnvimBr gels
2.2.3 SEM表征
掃描電鏡顯微分析(SEM)是對交聯凝膠表面拓撲和內部形態非常重要的表征技術。圖3(a、b和c)分別為PCnvimBr(n=2,4,6)凝膠的三維結構,內部為深淺不一的交聯網狀孔洞結構,對載藥及吸水溶脹釋放藥物起著重要作用。相比之下,PC2vimBr凝膠中相互連接的孔更多且密集,因為烷基側鏈微增長對凝膠結構具有較強的調控作用,這與其溶脹性能的研究結果一致,即PC2vimBr凝膠更有利于藥物的包覆與釋放。

圖3 PCnvimBr凝膠的掃描電鏡圖 (a) PC2vimBr, (b) PC4vimBr和(c) PC6vimBrFig 3 SEM image of PCnvimBr gels: (a) PC2vimBr; (b) PC4vimBr; (c) PC6vimBr
2.2.4 XRD分析
PCnvimBr凝膠的XRD分析譜圖見圖4,掃描范圍3~90°,掃描速率8 °/min。PCnvimBr(n=2,4,6)凝膠的XRD譜圖中均未出現強的衍射峰,而分別在2θ=23.46,24.02,23.94°出現了寬特征峰,表明該類凝膠屬于無定型結構,其結晶性很弱,利于藥物分子在凝膠內部穿梭。

圖4 PCnvimBr凝膠的XRD譜圖Fig 4 XRD spectrum of PCnvimBr gels
2.3 PCnvimBr凝膠的pH敏感性
pH敏感型凝膠通過體內各個器官環境存在的酸堿差異調節藥物的釋放,使藥物在特定時間和部位釋放。因此研究凝膠在不同pH值溶液中的溶脹性質尤為重要。
由圖5可知,3種聚離子液體均具有良好的pH敏感性,相比之下,PC2vimBr凝膠的pH響應性最為敏感,與溶脹性和SEM測試結果一致。PCnvimBr凝膠在弱堿性介質中的平衡溶脹率高于酸性介質,且在pH=7.4條件下,凝膠平衡溶脹率最高,分別為1 422.3%,1 233.8%,257.9%。這是由于親水基團質子化行為的影響。在酸性介質中,親水基團質子化阻止了氫鍵的形成,凝膠處于收縮狀態,平衡溶脹率低。隨著pH值增加,親水基團保持自由,凝膠開始溶脹,溶脹率升高。同時,高離子強度也會在一定程度上削弱氫鍵,降低凝膠網絡內外滲透壓差,即在pH=7.4的弱堿性環境下,PCnvimBr凝膠的刺激響應性最強,有望成為人體弱堿性器官藥物遞送的載體。
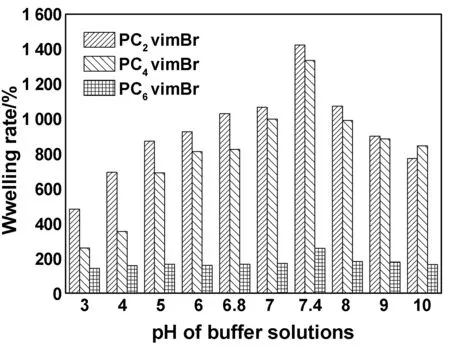
圖5 PCnvimBr凝膠的平衡溶脹率與pH的關系Fig 5 The relationship between the equilibrium swelling rate of PCnvimBr gels and pH
2.4 PCnvimBr凝膠的鹽敏感性
聚離子液體凝膠作為一種聚電解質,其溶脹性能不僅隨外界pH的變化而變化,同時也受鹽溶液濃度(離子強度)的影響。眾所周知,人體的胃液和腸液中含有大量離子,因此研究凝膠在不同濃度鹽溶液中的溶脹特性對于探討其在藥物遞送系統領域的應用具有十分重要的意義。
PCnvimBr凝膠在不同濃度NaCl溶液(pH=7.4)中的平衡溶脹率如圖6所示。與在超純水中相比,凝膠在鹽溶液中的平衡溶脹率降低。這是由于鹽溶液中的離子強度比水中的高,凝膠內外滲透壓差減小,使平衡溶脹率降低。鹽溶液濃度由0.03 mol/L升高到0.15 mol/L,PCnvimBr(n=2,4,6)凝膠的平衡溶脹率分別降低了828.61%,711.961%,363.1%,可以看出三種凝膠均具有較強的鹽敏感性,相比而言,PC2vimBr凝膠的鹽收縮性最明顯。這是因為鹽溶液濃度升高后,抗衡陽離子與咪唑環之間的靜電排斥作用占主導地位,且烷基側鏈越長,靜電排斥作用力越強,導致凝膠網絡結構收縮,溶脹率降低。

圖6 PCnvimBr凝膠的鹽刺激響應曲線Fig 6 The salt stimulation response curve of PCnvimBr gels
2.5 PCnvimBr凝膠在水-鹽循環體系中的溶脹可逆性
PCnvimBr凝膠不僅有良好的鹽敏感性,而且在水-鹽循環體系中的溶脹-收縮行為還具有可逆性。從圖7可以看出,在超純水和0.15 mol/L NaCl溶液循環體系中,PCnvimBr凝膠均具有良好的溶脹可逆性,且烷基側鏈微增長對溶脹可逆性影響不大。PC2vimBr凝膠在超純水中達到較高的平衡溶脹率,將其轉移到0.15 mol/L NaCl的鹽溶液中時,由于凝膠內的離子強度遠遠小于外部溶液離子強度,凝膠內外的滲透壓差使其迅速收縮失水,溶脹率呈直線下降趨勢,其失水量在1 h內降到37%。完成一個溶脹循環過程需要290 min,在兩個溶脹循環后,凝膠仍然顯示出對水-鹽溶液體系交替變化的良好響應性,這表明溶脹過程沒有破壞凝膠的內部網絡,其三維的網狀孔洞結構非常穩定。

圖7 PCnvimBr凝膠在超純水和鹽溶液循環體系下的可逆溶脹-收縮曲線Fig 7 The reversible swelling-shrinkage curve of PCnvimBr under the circulation system of ultrapure water and salt solution
2.6 環丙沙星的體外控制釋放研究
基于PCnvimBr凝膠載體在弱堿性條件下具有強pH刺激響應性,選擇腸道殺菌藥物環丙沙星(CIP)作為體外釋藥的模型藥物,在不同人體模擬液下CIP的控制釋放結果見圖8。研究表明,在模擬腸液(pH=7.4)中,PCnvimBr(n=2,4,6)10 h的釋放量分別為67.78%,47.882%和20.06%,可見PC2vimBr的緩釋效果更好,因為長烷基鏈使交聯緊密,分子難以進出凝膠內部,緩釋效果變差。圖8(c)表示PCnvimBr凝膠在模擬胃液(pH=1.2)中釋放藥物量整體較低,1 h內由于表面藥物的釋放,釋藥率約5%,因為在模擬胃液中的溶脹率較低,使釋藥非常緩慢。相比而言,PCnvimBr載藥凝膠在pH=7.4的模擬腸液中累積釋放率更高,表明凝膠中包覆的藥物可以在弱堿性的大腸、結腸和直腸粘膜的基本環境中選擇性釋放。
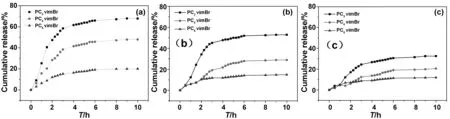
圖8 不同pH條件下環丙沙星的體外釋放曲線 (a) pH=7.4; (b) pH=6.8和(c) pH=1.2Fig 8 In vitro release curves of ciprofloxacin under different pH conditions (a) pH=7.4; (b) pH=6.8; (c) pH=1.2
3 結 論
通過自由基聚合法成功制備了3種聚咪唑類離子液體凝膠(PCnvimBr,n=2,4,6)。PCnvimBr凝膠具有良好的pH/鹽刺激雙敏感性以及溶脹可逆性,相比之下,PC2vimBr凝膠在pH=7.4弱堿性條件下的刺激響應性最為明顯。在體外控制釋藥實驗中,PCnvimBr凝膠對環丙沙星表現出良好的緩釋效果,此類凝膠有望作為一種新型的腸道殺菌類藥物控制釋放載體。

