血小板內皮聚集受體1基因多態性與阿司匹林抵抗及心血管事件發生相關性研究
劉 巖, 李麗瓊, 曲 穎, 劉艷霞
1.國家老年疾病臨床研究中心 北部戰區總醫院 老年醫學中心 干二科,遼寧 沈陽 110016; 2.武漢友芝友醫療科技股份有限公司,湖北 武漢 430000
抗血小板聚集是臨床防治缺血性心血管事件的主要方法,小劑量阿司匹林是經典的抗血小板藥物,長期服用小劑量阿司匹林有助于減少心肌梗死的發生[1]。有研究報道,服用阿司匹林過程中部分患者達不到預期抑制血小板聚集的作用,血小板聚集能力不被抑制或輕度抑制,仍會出現缺血性心血管事件,即存在阿司匹林抵抗(aspirin resistance,AR),發生率約為5%~45%[2]。AR會大大增加缺血性心血管事件的發生風險[3-4]。目前,關于AR尚無統一的標準[5],一是實驗室AR,檢測服用阿司匹林者血樣,發現血小板聚集抑制率不足;二是臨床AR,長期規律服用治療劑量阿司匹林,仍有血栓事件發生。目前,AR的發生機制尚不明確,可能與年齡、性別、吸煙、依從性、藥物劑量、基因多態性、藥物相互作用等因素有關,其中,基因多態性的關注度較高[6]。血小板內皮聚集受體1(platelet endothelial aggregation receptor 1,PEAR1)是一種血小板跨膜蛋白,可促進血小板的粘附和聚集,參與血栓形成、維持血小板聚集穩態[7]。有研究發現,該基因位點與激動劑誘導的血小板聚集活性顯著相關[8],可影響血小板對各種生理激動劑的反應性[9]。本研究旨在探討PEAR1基因位點多態性與AR的關聯性,分析該基因位點多態性對AR的影響,指導患者及早采取有效措施,減少AR的發生,提高臨床療效。現報道如下。
1 對象與方法
1.1 研究對象 選取自2018年1月至2019年12月于北部戰區總醫院就診的340例缺血性心血管疾病患者為研究對象。納入標準:(1)缺血性心血管疾病(冠心病、不穩定心絞痛、心肌梗死等);(2)服用阿司匹林100 mg/d,至少7d。排除標準:(1)前1個月服用阿司匹林劑量>100 mg/d;(2)聯用其他抗血小板聚集藥物或非甾體抗炎藥物、華法林、肝素等抗凝藥物;(3)血小板計數<100×109個/L或>400×109個/L,血紅蛋白<90 g/L或>169 g/L;(4)近期有外科手術史、活動性出血;(5)心房顫動;(6)心源性腦梗死;(7)嚴重消化性潰瘍或其他消化系統疾病;(8)嚴重肝、腎功能損害,惡性腫瘤,血液病,惡性高血壓,嚴重感染及免疫系統疾病。本研究經醫院倫理委員會批準。患者均知情同意。
1.2 研究方法 采用熒光定量聚合酶鏈式反應(polymerase chain reaction,PCR)平臺的擴增阻礙突變系統引物與多重Taqman-MGB探針組合技術檢測PEAR1基因的rs12041331位點多態性,并將其分為野生型(GG組)、突變雜合型(GA組)及突變純合型(AA組)。檢測3組的基線情況、花生四烯酸誘導的血小板聚集率。所有患者口服阿司匹林100 mg/d。門診或電話隨訪1年,復測血小板聚集率,記錄心血管事件(缺血性心血管病包括心絞痛發作、心肌梗死等)的發生情況。觀察期間發生如下情況7 d不恢復者退出研究:(1)天門冬氨酸氨基轉移酶和/或丙氨酸氨基轉移酶>正常值1.5倍;(2)肌酐清除率<30 ml/min;(3)血白細胞計數<3.0×109個/L或中性粒細胞絕對值<1.5×109個/L;(4)血小板計數<80×109個/L;(5)血紅蛋白<80 g/L;(6)輕微出血(少量牙齦出血、鼻出血、皮膚少量出血點等)。顱內出血、消化道出血、肉眼血尿、嚴重咯血、大血腫或急診手術等需停用阿司匹林立即終止研究。

2 結果
2.1 PEAR1基因位點多態性 Hardy-Weinberg平衡檢驗對340例患者進行PEAR1基因rs12041331位點檢測,其中,GG型(GG組)127例(37.4%),GA型(GA組)146例(42.9%),AA型(AA組)67例(19.7%)。A等位基因頻率為 41.2%。該基因位點等位基因頻率符合Hardy-Weinberg平衡(P=0.364),所選樣本具有群體代表性。
2.2 各組研究對象一般資料比較 各組患者的性別、年齡、體質量指數、膽固醇、甘油三酯、低密度脂蛋白、肌酐清除率、伴發病、合并用藥、吸煙情況比較,差異均無統計學意義(P>0.05)。見表1。
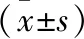
表1 各組研究對象一般資料比較
2.3 治療前后血小板聚集率比較 治療前,GG組、GA組、AA組的血小板聚集率分別為(61.34%±21.30%)、(57.82%±21.39%)、(57.81%±23.80%),治療后分別為(50.51%±11.25%)、(50.58%±9.77%)、(54.26%±11.38%)。治療前,3組血小板聚集率比較,差異均無統計學意義(P>0.05)。治療后,GG組與GA組血小板聚集率比較,差異無統計學意義(P>0.05);GG組、GA組血小板聚集率明顯低于AA組,組間比較,差異均有統計學意義(P<0.05)。治療后,GG組、GA組的血小板聚集率均低于治療前,差異有統計學意義(P<0.05);AA組治療前后比較,差異無統計學意義(P>0.05)。
2.4 心血管事件發生率比較 隨訪1年,GG組、GA組、AA組的心血管事件發生率分別為18.1%(23/127)、26.0%(38/146)、37.3%(25/67)。GG組心血管事件發生率低于GA組、AA組,組間比較,差異均有統計學意義(P<0.05);GA組心血管事件發生率低于AA組,組間比較,差異有統計學意義(P<0.05)。
3 討論
服用阿司匹林者發生血栓大多是因為血小板聚集不能被抑制,稱為AR。血小板凝聚相關基因的多態性是發生AR的一個重要影響因素[10]。基于Taqman-PCR技術的基因檢測方法具有自動化閉管檢測的優勢,是目前研究的熱點。本研究應用的基因檢測技術是基于熒光定量PCR平臺的擴增阻礙突變系統引物+多重Taqman-MGB探針組合技術,可以實現同一反應管檢測同一基因兩種不同多態性,能準確區分單核苷酸多態性位點的3種基因型,結果準確可靠,操作簡單,可作為一種常規方法應用于臨床檢測。
PEAR1基因在血小板和內皮細胞均有表達。有研究發現,PEAR1基因的rs12041331攜帶A等位基因的血小板聚集活性增強[11]。該基因位點多態性與阿司匹林或雙聯抗血小板治療的反應顯著相關,白種人中攜帶A等位基因者比G/G型的支架手術后心血管事件發生率高2.62倍,阿司匹林治療的攜帶A等位基因者比G/G型發生心肌梗死風險更高[12]。本研究PEAR1基因在rs1204133位點存在單核苷酸多態性,分別是野生型(GG)、突變雜合型(GA)、突變純合型(AA)3種基因型,與以往研究結果一致[13]。有研究發現,阿司匹林在治療缺血性心血管疾病中,常出現較高的血小板聚集率或較低的血小板抑制率,出現AR,不利于預后[14-15]。本研究結果發現,與治療前相比,治療后GG組和GA組血小板聚集率均明顯降低(P<0.05);而AA組血小板聚集率治療前后比較,差異無統計學意義(P>0.05);且治療后,GG組與GA組血小板聚集率明顯低于AA組,差異有統計學意義(P<0.05),提示該基因位點GG型和GA型對血小板功能影響大,抑制血小板活化和聚集,該基因位點AA型存在較明顯的AR,嚴重影響預后。隨訪1年,GG組心血管事件發生率低于GA組、AA組,GA組低于AA組,差異均有統計學意義(P<0.05),表明阿司匹林治療后心血管事件發生率與PEAR1基因rs12041331位點攜帶A等位基因相關。
綜上所述,PEAR1基因的rs12041331位點多態性與應用阿司匹林后血小板聚集率和心血管事件發生率有關。阿司匹林治療中,PEAR1基因的rs12041331位點GG型對阿司匹林的應答性最好,GA型應答性一般,AA型存在AR,影響預后。PEAR1基因rs12041331位點基因的檢測對輔助臨床更準確地把握影響阿司匹林療效的因素、判斷發生AR的風險、及時采取相應措施減少AR發生、實現個體化抗血小板治療具有重要臨床意義。本研究入選患者數有限,仍存在許多局限性,尚需進一步的大樣本多中心檢測。

