離子交換雙膜原電池裝置的制作與教學思考
杜愛萍

摘要:以PP塑料板作為裝置的腔體,以硅膠墊片來密封,自制耐溫、耐壓、可持續使用的雙膜原電池裝置。使用電流傳感器、溫度傳感器對比測定單液銅鋅原電池與自制雙膜銅鋅原電池的電流、溫度,發現自制雙膜原電池具有更高的能量轉化率。使用氯離子檢測儀、鉀離子檢測儀檢測鹽橋中的離子移動方向,使學生能直觀地感受到鹽橋中離子移動的方向。
關鍵詞:雙膜原電池;離子交換膜;實驗探究;教學思考
文章編號:1005-6629(2021)04-0060-04
中圖分類號:G633.8 文獻標識碼:B
1問題提出
1.1教材引入雙液原電池的教學意圖與實際狀況的矛盾
基于核心素養培育的實驗教學,目標指向對真實環境下的實驗事實的發現和提出有探究價值的問題,并以此為基礎培養學生嚴謹求實的科學態度。2019人教版必修教材《化學》(第二冊)中從能量轉換的角度分析了單液原電池的基本概念,在2019人教版化學選擇性必修1教材中,又引入了雙液原電池的概念。單液原電池到雙液原電池的轉變,意在解決兩個問題:
第一,為了克服單液原電池的電流不穩定、放電時間偏短、實驗現象不明顯等問題,同時也是為了更直觀地表達化學電源的真實狀況;第二,為了凸顯能量轉化的教學目標指向。化學能轉化為電能的能量轉換效率是研究原電池的實際意義所在,由單液原電池改為雙液原電池,是希望讓學生感悟到提高能量轉換效率的意義。
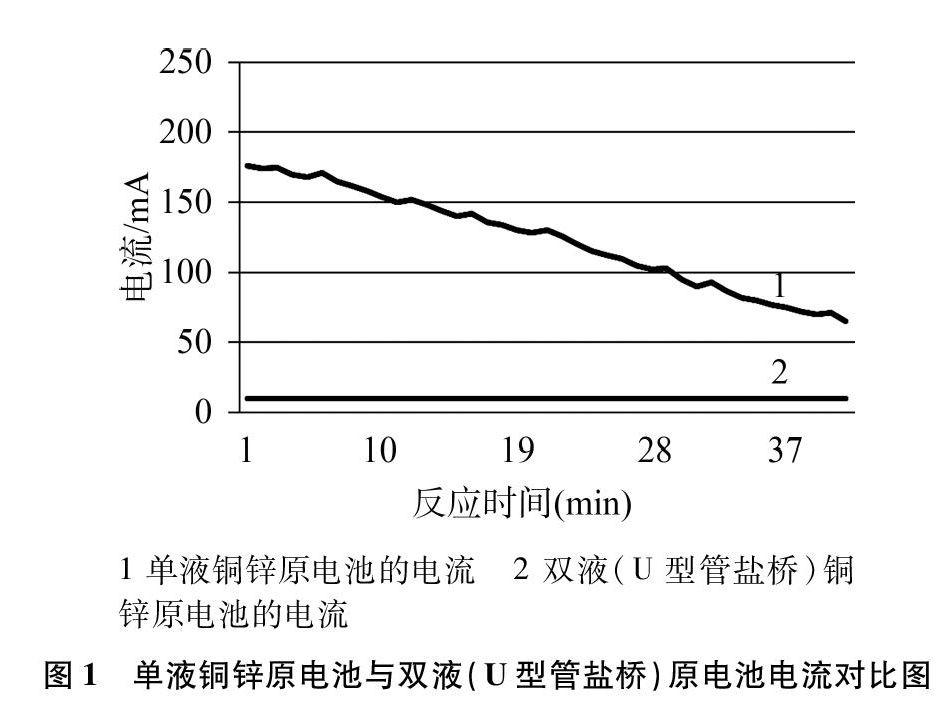
然而,實際教學中的實驗現象與我們期待的問題解決并不完全一致。筆者以化學選擇性必修l教材提供的相關試劑與器材[銅片(3cm×6cm)、鋅片(3cm×6cm)、1mol·L-1的CuSO4溶液、1mol·L-1的ZnSO4溶液],采用朗威8.0電流傳感器進行數據采集,同時進行單液原電池與雙液原電池(U型管瓊脂KCl作為鹽橋)反應,所得實驗數據如圖1所示。
反應10分鐘,雙液原電池的電流一直穩定在10mA,而單液原電池的電流從174mA逐漸衰減至154mA。對比電流的變化情況,學生可以觀察到雙液原電池可以獲得平穩的電流,而單液原電池產生的電流在逐漸衰減。因此,這個實驗很好地解決了第一個教學問題,即雙液原電池能獲取平穩的電流。
而針對問題二,由于雙液原電池的電流強度(10mA)遠小于單液原電池的初始電流強度(174mA),能量轉換率無法從單、雙液原電池的電流強度對比上得以說明(見圖1)。這一實際情況與教材的出發點背道而馳,也形成了教學上的困惑。
由于問題二的存在,致使我們在教學中只能強調引人雙液原電池的目的是為了獲取平穩電流而弱化能量轉換的概念。由此帶來一個值得思考的實驗改進問題:如何在相同條件下,使雙液原電池獲得比單液原電池強度更高的穩定電流。
1.2關于原電池教學中內外電路帶電粒子移動的可視化問題亟待解決
原電池概念教學過程中,無法回避的另一個問題是關于原電池放電過程中的帶電粒子的移動。實驗中,我們可以通過電流表直觀地表現原電池外電路帶電粒子——電子的移動;然而,對于內電路的帶電粒子——離子的定向移動,只有理論表述,可視化程度不高,與現代學科背景下的教學要求相距甚遠,缺失微觀探析所需要的“證據推理”,由此成為學生從微觀層面理解原電池原理的障礙,不利于學生對原電池工作原理的“模型建構”。
2實驗改進比較分析:
2.1雙液原電池的改進
U型管鹽橋雙液原電池之所以測定的電流(10mA)遠小于單液原電池的電流(174~154mA),是因為U型管鹽橋的接觸面積小,路徑細又長,導致電池內阻增加較多,使得作為能量表征手段之一的電流強度遠低于單液原電池的電流強度。
基于此,筆者采用離子交換膜作為隔膜分開正負兩極,減小內阻,替代傳統U型管鹽橋進行雙液原電池的實驗改進。采用溫度傳感器與電流傳感器從能量轉換的兩個方面來體現雙液原電池具有更高的能量轉換率。
2.2以手持技術實現內電路離子移動的可視化
在實際教學中,原電池中陰、陽離子的定向移動缺失微觀探析的直觀表象,因此決定使用手持技術這種宏觀、直顯的表現形式將其外顯,希望通過構建陰、陽離子交換膜雙膜原電池,并使用氯離子、鉀離子檢測儀來檢測溶液中Cl-、K+的移動方向,讓學生直觀地感受原電池內電路中陰、陽離子的移動方向。
3實驗改進方案
3.1陰、陽離子雙膜原電池裝置的制作
離子交換膜裝置制作過程中存在的最大問題是密封性問題。采用熱熔膠方式進行裝置的密封雖比較常見,但在使用時,溶液長時間浸泡離子交換膜,會導致交換膜溶脹變形而漏水。
基于密封性考慮,筆者選用PP塑料板作為裝置的腔體材料,腔體與離子交換膜之間通過硅膠墊片來密封。腔體的切割面光滑整齊,便于硅膠墊片的密封;腔體與墊片有一定的軟度,便于鋼板螺絲所產生的外力夾緊密封整個裝置。
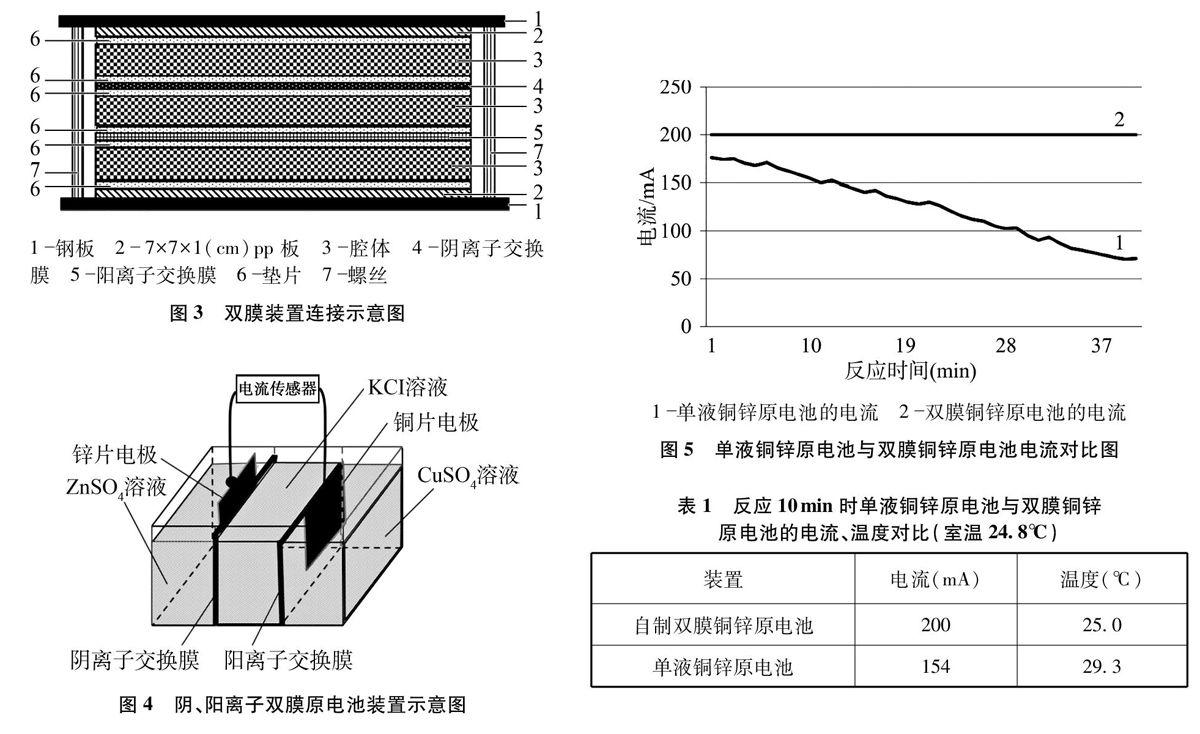
如圖2所示。圖2(a)為裝置的腔體,圖2(b)為裝置所用的墊片,中間鏤空便于溶液中的離子通過交換膜。圖3為雙膜裝置連接示意圖。該裝置耐溫、耐壓,密封性良好。使用一段時間后,如果離子交換膜破損,可以將螺絲擰開重新換上新的離子交換膜持續使用。
采用該設計思路,教師可以設計任意的離子交換膜裝置。根據離子交換膜的個數來選擇腔體的個數,從而根據實際需要來設計裝置。如果把腔體→墊片→交換膜→墊片看做一個整體,記為A,則單膜裝置的連接順序為A→腔體;雙膜裝置的連接順序為A→A→腔體;三膜裝置則為A→A→A→腔體。裝置搭建好后,最末端的腔體用7 cru×7cm的墊片、7cm×7 cm×1cm的pp板連接,然后再用鋼板以及螺絲將整個裝置固定(如圖3所示)。
圖4為筆者設計的雙膜裝置示意圖,盛有硫酸鋅溶液的腔體構成負極區域,盛有KCl溶液的腔體構成鹽橋區域,盛有硫酸銅溶液的腔體構成正極區域。陰離子交換膜分開負極區域與鹽橋區域,而陽離子交換膜分開正極區域與鹽橋區域。
3.2實驗步驟與結果分析
實驗儀器:電腦、朗威8.0數據采集器、電流傳感器(2個)、溫度傳感器(2個)、數據采集器、氯離子檢測儀、鉀離子檢測儀、自制的陰陽離子交換膜雙膜原電池裝置
實驗藥品:銅片(3cm×6cm)、鋅片(3cm×6cm)、1mol·L-1的CuSO4溶液、1mol·L-1的ZnSO4溶液、飽和KCl溶液、0.5mol·L-1的BaCl,溶液、0.5 lnol·L-1的NaOH溶液
3.2.1實驗一的步驟與結果
(1)實驗步驟:將銅片、鋅片分別放入雙膜原電池裝置的硫酸銅溶液、硫酸鋅溶液中,組成雙膜原電池。同時將銅片、鋅片都放人硫酸銅溶液中,組成單液銅鋅原電池。將單液、雙膜銅鋅原電池同時連接電流傳感器。測得電流隨時間變化的對比圖,如圖5所示。
反應10分鐘后,將溫度傳感器分別放人雙膜原電池、單液原電池鋅片附近,同時進行溫度、電流的測定,測得的結果如表1所示。
(2)實驗結果:反應10分鐘后,雙膜原電池的電流一直穩定在200mA,而單液原電池的電流在154mA上下浮動。
對比電流的變化情況,學生可以觀察到雙膜原電池可以獲得平穩的電流,而單液原電池產生的電流不穩定。雙膜原電池很好地解決了第一個教學問題,即雙膜原電池能獲取平穩電流。
改進后的雙膜原電池的電流強度(20HDmA)遠大于單液原電池的電流強度(從174mA逐漸下降),從電流強度的數據可以看出,雙膜原電池中的化學能轉換成電能的效率遠高于單液原電池,有較高的能量轉換率。
反應10分鐘后,雙膜原電池的溫度為25.0℃,單液原電池的溫度為29.3℃。可以看出,雙膜原電池中化學能轉換成熱能的部分遠小于單液原電池。從能量的角度再一次說明雙膜原電池較單液原電池具有更高的能量轉換率。
(3)改進優點:第一,改進實驗很好地解決了單液原電池到雙液原電池轉換過程中存在的問題:即獲取平穩電流和較高的能量轉換率。第二,自制雙膜原電池裝置的創新,潛移默化中培養了學生實驗探究與創新意識的能力。第三,手持技術的應用,將抽象的能量轉換效率問題以電流、溫度數據變化的形式直觀地顯現出來,體現了化學核心素養中宏觀辨識與微觀探析的有效結合。
3.2.2實驗二的步驟與結果
(1)反應一段時間后,將氯離子檢測儀分別放入硫酸銅區域、硫酸鋅區域。由圖6隨反應時間的增加負極區(ZnSO4溶液)中c(Cl-)在逐漸增加,說明中間鹽橋區域的Cl經過陰離子交換膜移動到負極區;而正極區(CuSO4溶液)c(Cl-)濃度為0,而且隨時間的增長是一條直線,說明Cl-沒有移動到正極區。
(2)將鉀離子檢測儀分別放人硫酸銅區域、硫酸鋅區域。由圖7可以看出隨反應時間的增加,負極區(ZnSO4溶液)中c(K+)濃度為0,而且隨時間的增長是一條直線,說明K+沒有移動到負極區。而正極區(CuSO4溶液)中K+濃度在逐漸增大,說明中間鹽橋區域的K+經過陽離子交換膜移動到正極區。
(3)取出少許(鹽橋)KCl區域溶液,分別滴加BaCl2、NaOH溶液。
實驗現象:溶液仍然澄清。
(4)實驗優點:第一,該實驗操作直觀、簡單、方便,重現性強,在實際教學中能很好地激發學生的學習興趣。第二,采用鉀離子傳感器和氯離子傳感器手持技術,使學生直觀地感受到鹽橋中鉀離子、氯離子的移動方向。將抽象的理論知識以直顯的形式呈現給學生,降低了學習難度,同時為電解池中陰陽離子交換膜的使用奠定了基礎。第三,手持技術的應用提高了學生證據推理能力,同時建立了原電池溶液中離子定向移動的認識模型。第四,離子檢測儀測定結果與定性的離子檢測結果完全吻合,體現了現代化學研究的一個發展方向,即定量或半定量的化學研究將逐步取代傳統的定性研究。
4結語
以化學課堂為載體,培養學生實驗探究與創新能力是提升學生的化學學科核心素養的關鍵。手持技術的應用是對高中典型實驗的創新,雙膜原電池的設計與制作,以及在實際教學中所呈現的宏觀現象、曲線表征等就是對微觀探析的有力支撐,充分體現了化學學科特有的宏觀辨識、微觀探析、曲線(符號)三重表征的學習特點。
在教學過程中,充分利用現代實驗手段(如手持技術),以定量的曲線表征增加宏觀體驗,這不僅僅是提高微觀表征的可視化,以易于理解的方式傳授給學生,更是體現了現代化學研究從“定性解釋轉向定量解釋”,從“描述化學轉入到理論化學,并建立理論模型”的發展方向,讓高中化學課堂真正成為提升學生學科素養的場所。

