青魚和鰱魚肌球蛋白熱誘導凝膠特性的比較
高 宇,畢保良,賈 丹,胡 青,王曉雯
(云南農業大學動物科學技術學院,云南省教育廳高原漁業資源保護 與可持續利用重點實驗室,云南昆明 650201)
青魚(Mylopharyngodonpiceus)和鰱魚(Hypophthalmichthysmolitrix),作為我國傳統的“四大家魚”,養殖歷史十分悠久,其產量一直位居前列。到2018年我國青魚和鰱魚年產量已分別達69.1和385.9萬噸[1]。鰱魚產量雖大,但其凝膠特性較差。目前,關于鰱魚肌球蛋白熱誘導凝膠的形成機制及其高值化利用已有較多報道[2-6]。
青魚具有生產快、采肉率高、凝膠特性好等特點,在我國常被用于加工成魚糜制品。目前國內學者已對青魚等大宗淡水魚的原料基本特性和凝膠特性進行了比較[7]、對魚皮膠原特性[8]以及貯藏中品質變化等開展了研究[9],也有學者對不同養殖模式下青魚肌肉的質構特性[10]和營養品質[11]進行了比較分析。低溫貯藏下,青魚肉中蛋白和組織結構的變化會影響魚肉中水分的分布狀態,從而對品質造成影響[12]。張屹環等[13]比較了青魚和其他大宗淡水魚的凝膠特性差異,發現熱處理魚糜凝膠中,青魚糜凝膠的凝膠強度僅低于鯉魚,而高于魴魚、鳙魚、鰱魚、鯽魚和草魚。課題組前期研究得出MTGase催化谷氨酰胺殘基的γ-羧酰胺基和伯胺之間發生的交聯反應和二硫鍵共同導致了魚糜凝膠網絡的形成,蛋白質變性伸展,二硫鍵和疏水相互作用的增加,青魚蛋白凝膠的網絡結構進一步增強[14]。而肌球蛋白是魚糜凝膠形成最主要的蛋白質[15],但目前關于青魚肌球蛋白凝膠形成機制方面的研究幾乎空白。
魚糜的凝膠特性不僅受內源蛋白酶的降解和交聯酶類交聯作用的影響[16],而且還受構象和蛋白質熱特性的影響。構象的變化能引起蛋白質的變性,從而引起蛋白質之間的聚集,適當的聚集是凝膠網絡結構形成的提前條件[17]。蛋白質變性后,其構象、化學作用力、溶解性能、蛋白質粒徑大小均會發生變化,因此用二級結構、總游離巰基、疏水相互作用、粒徑分布可以表征蛋白質的變性和聚集[18]。可用流變儀研究其凝膠形成過程,動態流變曲線中的彈性模量G′、粘性模量G″和損耗角δ,這些參數和凝膠的結構緊密相關[19]。因此本研究以青魚和鰱魚肌球蛋白為研究對象,探討肌球蛋白在熱誘導凝膠形成過程中的構象變化,變性和聚集特性及凝膠形成的差異,旨在揭示青魚糜凝膠形成機制,為開發高品質魚糜凝膠制品提供一定的理論研究基礎。
1 材料與方法
1.1 材料與儀器
鮮活青魚和鰱魚 購于華中農業大學菜市場,總重1500 g/條左右;三磷酸腺苷二鈉(ATP-Na2)、5,5-二硫代雙(2-硝基苯甲酸)(DTNB)、疊氮鈉、乙二醇-雙-(2-氨基乙基)四乙酸(EGTA) Amresco公司;1-苯胺萘-8-萘磺酸鹽(ANS)、Tris 美國Sigma公司;β-巰基乙醇 上海化學試劑總廠;氯化鈉、氯化鎂等試劑 均為分析純,國藥集團化學試劑有限公司。
Discovery H-2動態流變儀 美國TA公司;J-8100圓二色譜 日本JASCO公司;ZEN3600馬爾文激光粒度儀 Zetasizer Nano ZS馬爾文有限公司;F-4600熒光光譜儀 日本Hitachi公司。
1.2 實驗方法
1.2.1 青魚、鰱魚前處理 將鮮活青魚和鰱魚20 min內迅速拿回實驗室,宰殺取肉在30 min內完成。
1.2.2 肌球蛋白的提取 參考Guo等[20]的方法。取尸僵前的青魚、鰱魚背脊肉分別用食品調理機破碎,向破碎后的肌肉中加入10倍體積的溶液A(pH7.5,含0.1 mol/L KCl和0.02% NaN3的20 mmol/L Tris-HCl緩沖液),并用高速分散均質機于23000 r/min的轉速下均質1 min,均質液于5 ℃下放置15 min,3836×g離心5 min,沉淀于5倍體積溶液B(pH6.8,含0.45 mol/L KCl、5 mmol/Lβ-巰基乙醇、0.2 mol/L醋酸鎂(Mg(CH3COO)2)、1 mmol/L EGTA的20 mmol/L Tris-HCl緩沖液)中懸浮,同時加入ATP-Na2使肌球蛋白與肌動蛋白解離,魚肉肌球蛋白的提取需加ATP-Na2至終濃度為5 mmol/L。于5 ℃下放置1 h后在17696×g離心10 min,上清液用5倍體積1 mmol/L KHCO3稀釋,于5 ℃下放置15 min,然后于22095×g離心10 min;沉淀重新用2.5倍體積溶液C(pH7.5,含0.5 mol/L KCl和5 mmol/Lβ-巰基乙醇的20 mmol/L Tris-HCl緩沖液)懸浮,于5 ℃下放置10 min,再用2.5倍體積的1 mmol/L KHCO3稀釋并加MgCl2至終濃度為10 mmol/L,于5 ℃下放置過夜,然后23708×g離心10 min;沉淀物用1倍體積溶液 D(pH7.0,含0.6 mol/L NaCl的20 mmol/L Tris-HCl緩沖液)溶解,即為肌球蛋白溶液,于4 ℃保存,2 d內用完。
1.2.3 肌球蛋白的測定
1.2.3.1 圓二色譜的測定 將0.05 mg/mL的肌球蛋白溶液放入10 mm光程的石英樣品池中,在遠紫外區(198~250 nm)對肌球蛋白溶液進行掃描,實驗參數:Data pitch:0.1 nm CD scale:200 mdeg/1.0 dOD;FL scale:200 mdeg/1.0 dOD;FL scale;Bandwidth:1 nm;Scanning speed:50 nm/min。平均殘基分子量為110 g/mol。研究加熱過程中肌球蛋白二級結構的變化,采用的升溫速率為2 ℃/min(10~90 ℃),各二級結構(α-螺旋、β-折疊、β-轉角和無規卷曲)所占比例用圓二色光譜儀自帶的程序進行分析。
1.2.3.2 表面疏水性的測定 將提取出的肌球蛋白用溶液D稀釋成0.001、0.005、0.01、0.04和0.06 mg/mL系列濃度,加入20 μL 8 mmol/L ANS的0.1 mol/L磷酸鹽緩沖溶液(pH7.0),于20、30、40、50、60、70、80、90 ℃加熱30 min后,在激發波長364 nm下,用熒光光譜儀測定其在發射波長534 nm下的熒光強度,表面疏水性(S0-ANS)以熒光值-蛋白質濃度曲線的斜率來表示[17]。
1.2.3.3 二硫鍵含量的測定 游離巰基(SHF),總巰基(SHT)和二硫鍵(S-S)含量的測定參考Jia等[14]的方法。取1 mg/mL的肌球蛋白溶液于20、30、40、50、60、70、80、90 ℃加熱30 min后,即得到熱誘導肌球蛋白溶液,冷卻后渦旋混勻備用。測定SHF含量時,移取200 μL Ellman試劑(5,5′-dithio-bis-2-nitrobenzoic acid(DTNB)溶解于Tris-甘氨酸緩沖液,4 mg/mL),添加到4 mL的肌球蛋白溶液中,室溫下反應1 h,于412 nm測定其吸光值。測定SHT含量時,1 mL肌球蛋白溶液中加入4 mL 20 mmol/L Tris-Gly緩沖液(pH8.0,含15 mg/mLβ-巰基乙醇,8 mol/L尿素和5 mol/L鹽酸胍)于40 ℃ 1 h,然后用12%的TCA沉淀蛋白1 h,4000×g離心10 min,收集沉淀用12%的TCA漂洗3次,沉淀用10 mL的Tris-Gly緩沖液,含8 mol/L尿素溶解。取200 μL的Ellman試劑添加到4 mL的蛋白溶液中,然后于412 nm測吸光值,SHF、SHT和S-S含量用式(1)和(2)表示:
SH(μmol·g-1protein)=73.53×A412/C
式(1)
S-S(μmol·g-1protein)=(SHT-SHF)/2
式(2)
式中,C-蛋白濃度,mg/mL;A412-412 nm處的吸光值;73.53=106/13600,13600 mol/L·cm即是摩爾消光系數。
1.2.3.4 粒徑的測定 將提取的肌球蛋白用溶液D調整到0.5 mg/mL,NaCl溶液采用高純水配制,分別于20、30、40、50、60、70、80、90 ℃加熱30 min。待冷卻后渦旋混勻后采用ZEN3600馬爾文激光粒度儀測定其粒徑。
1.2.3.5 動態流變的測定 參考Gao等[21]的方法并略作修改,采用Discovery H-2動態流變儀的平行板(直徑為4 cm,載物臺與平板間的距離為1 mm)進行測定。將濃度為10 mg/mL的肌球蛋白溶液,用液體石蠟的密封蓋封住樣品以避免水分蒸發,按照2 ℃/min從10 ℃升溫到90 ℃,采用1 Hz的振動頻率,剪切應力為1 Pa。
1.3 數據處理
所有數據采用SAS 8.0進行分析,3個或3個以上樣本的比較采用單因素方差分析(One-way ANOVA)Duncan檢驗,2個樣本的比較采用獨立樣本t檢驗(Independent-Samples T Test)。
2 結果與分析
2.1 加熱過程中肌球蛋白二級結構的變化
青魚和鰱魚肌球蛋白在加熱過程中二級結構的變化如圖1所示。青魚肌球蛋白加熱到20 ℃,二級結構沒有發生明顯的變化,α-螺旋含量隨著溫度的升高呈下降的趨勢,到溫度為80 ℃時其含量又有稍微的上升趨勢。α-螺旋含量由加熱前的69.2%(10 ℃)降至21.1%(90 ℃),即有48.1% 的α-螺旋解開,而β-折疊、β-轉角和無規卷曲的比例分別從10 ℃的0、5.2%和25.5%變化為90 ℃時18.7%、30.7%和29.6%。β-折疊和β-轉角的變化量為18.7%和25.5%,而無規卷曲的變化量僅為4.1%,說明加熱使得青魚肌球蛋白的α-螺旋大部分轉變為β-折疊和β-轉角。鰱肌球蛋白的α-螺旋含量也隨溫度的升高而降低,由加熱前的83.4%(10 ℃時)降至30.8%(90 ℃時),即肌球蛋白分子中約有52.6%的α-螺旋解開,β-折疊由0(10 ℃)變化為2.2%(90 ℃),β-轉角由0(10 ℃)變化為21.8%(90 ℃),從50 ℃開始鰱肌球蛋白才開始有β-折疊,而β-轉角的形成則是從60 ℃開始的,β-折疊和β-轉角的變化量為2.2%和21.8%。而無規卷曲的含量隨著溫度的升高呈增大趨勢,從17.7%變化到45.3%,變化量為27.6%。這說明青魚肌球蛋白在加熱過程中β-折疊增大程度明顯高于鰱魚肌球蛋白。Yongsawatdigul等[18]發現當馬鲅魚肌動球蛋白從10 ℃升溫到80 ℃時,α-螺旋含量從66%下降到24.2%,且在高于30 ℃時α-螺旋含量開始下降,這和本研究趨勢基本一致;Liu等[22]研究證明加熱過程中α-螺旋的解開和β-折疊的形成都有利于肌球蛋白的膠凝作用。
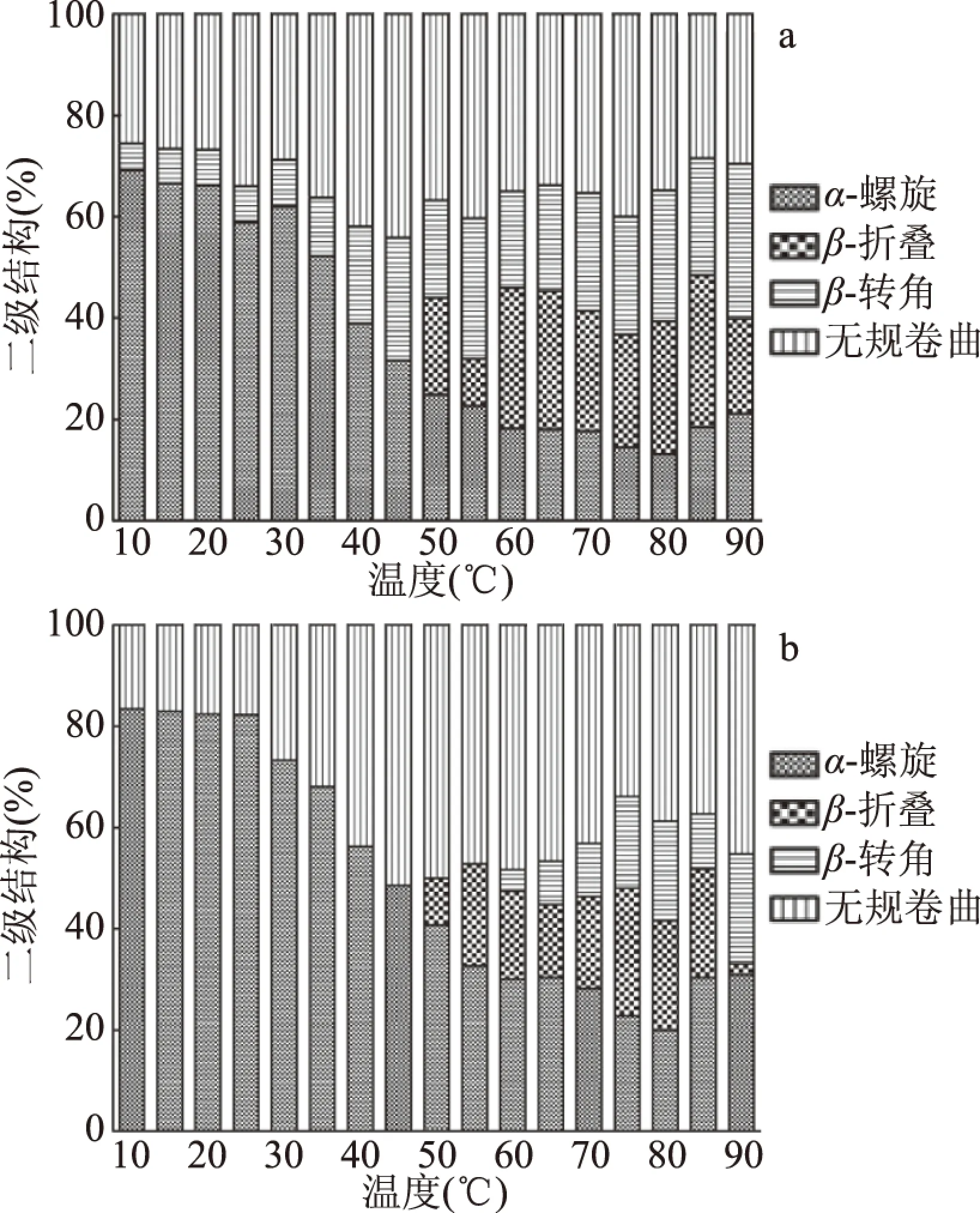
圖1 加熱溫度對肌球蛋白二級結構相對含量的影響Fig.1 Effects of heating temperatures on the relative content of secondary structures of myosin注:a:青魚;b:鰱魚。
2.2 加熱對肌球蛋白疏水性的影響
表面疏水性是蛋白表面特性的重要指標之一,S0-ANS的增加源自于蛋白的解折疊從而導致疏水性基團的暴露。暴露的疏水氨基酸殘基可以促進疏水相互作用的形成而促進蛋白的聚集[23-24]。由表1可知,隨著加熱溫度升高,青魚和鰱魚肌球蛋白的S0-ANS顯示先增加后下降的趨勢。青魚肌球蛋白的S0-ANS在70 ℃達到最大值,而鰱魚肌球蛋白的S0-ANS在60 ℃時達到最大,這說明隨著溫度的升高,肌球蛋白α-螺旋的解折疊作用使得疏水氨基酸殘基暴露,故S0-ANS增大。但隨著溫度的升高,S0-ANS的降低可能是疏水性相互作用導致的蛋白聚集體的形成,從而使疏水基團包裹在聚集體內的結果[12]。整體來看,青魚肌球蛋白的S0-ANS顯著高于鰱魚(P<0.05)。這是因為青魚肌球蛋白在熱誘導凝膠形成過程中的展開程度高于鰱魚,導致青魚肌球蛋白疏水性側鏈暴露程度高,故在升溫過程中青魚肌球蛋白疏水相互作用高于鰱魚。
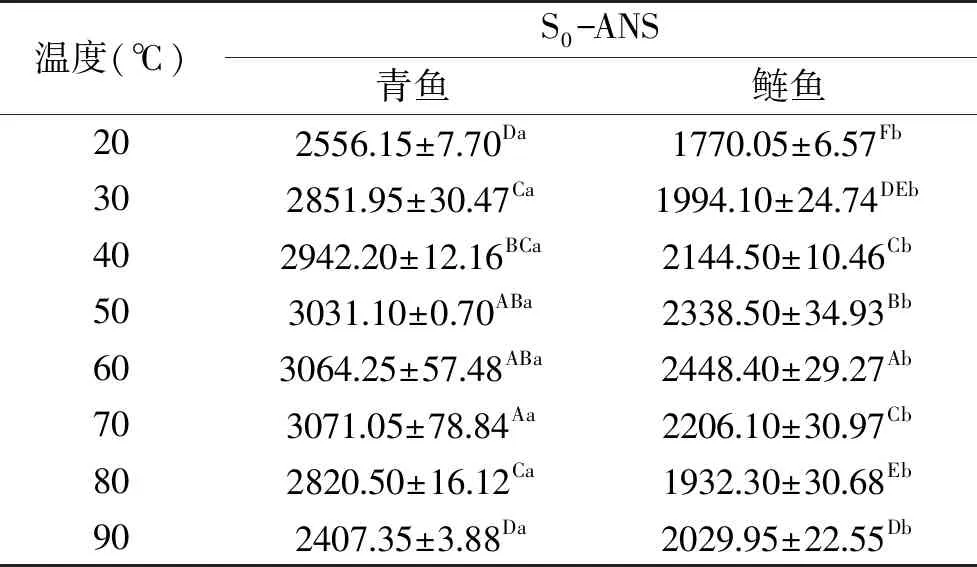
表1 加熱溫度對肌球蛋白表面疏水性的影響Table 1 Surface hydrophobicity of myosin fish under different heating temperatures
2.3 加熱對肌球蛋白二硫鍵的影響
由表2可知,青魚和鰱魚肌球蛋白的二硫鍵含量隨著溫度的升高而升高,青魚和鰱魚肌球蛋白二硫鍵含量在60~90 ℃時均無顯著性差異(P>0.05)。魚糜肌原纖維蛋白含有大量的半胱氨酸的巰基,可被氧化形成分子間或分子內的二硫鍵,從而增強魚糜凝膠的網絡結構和凝膠強度[25]。這說明在升溫過程中二者肌球蛋白部分游離巰基均被氧化成二硫鍵。且青魚肌球蛋白在熱誘導凝膠形成過程中的二硫鍵含量與鰱魚無顯著性差異(P>0.05)。
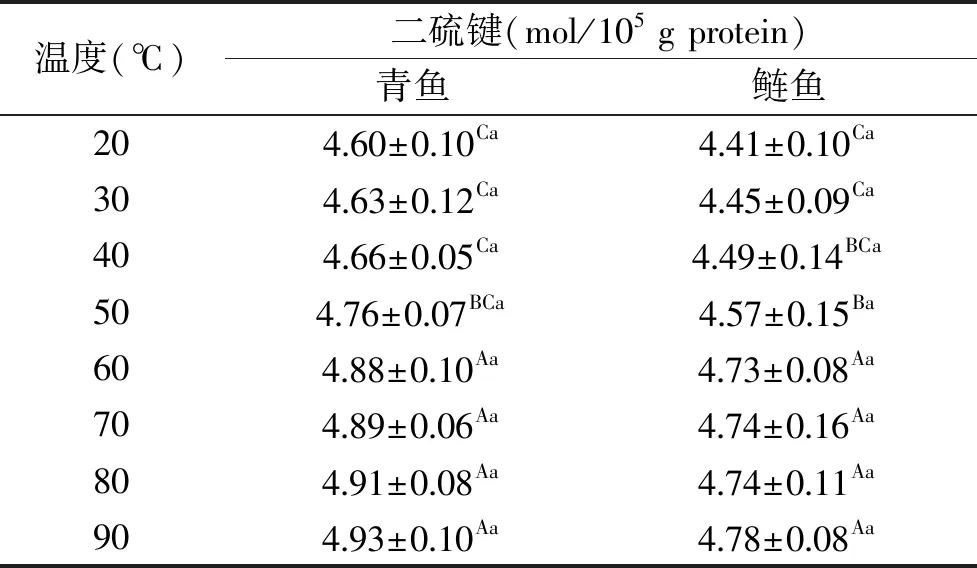
表2 加熱溫度對肌球蛋白二硫鍵的影響Table 2 S-S bonds of myosin fish under different heating temperatures
2.4 肌球蛋白溶液的平均粒徑
實驗進行粒徑分布測試時,每個樣品所得的PDI值均在0.3~0.7范圍內,說明蛋白溶液體系較均一。青魚和鰱魚肌球蛋白溶液在不同加熱溫度下的平均粒徑(dz)如表3,由表3可以看出青魚和鰱魚肌球蛋白的dz隨著溫度的升高而增加,青魚肌球蛋白的dz在90 ℃達到最高,而鰱魚肌球蛋白的dz在80 ℃達到最高。且當加熱溫度超過40 ℃后,青魚肌球蛋白的平均粒徑顯著大于鰱魚的(P<0.05)。當在50和90 ℃加熱30 min后,青魚肌球蛋白的平均粒徑分別為1303.67和4880.00 nm,而鰱魚的分別為596.46和2013.67 nm。青魚肌球蛋白的dz約為鰱魚肌球蛋白的2倍。說明在溫度高于40 ℃時,青魚肌球蛋白比鰱魚形成更大的聚集體,這可能是因為在加熱過程中,青魚肌球蛋白較鰱變性程度更高,結構更為伸展,較強的疏水相互作用使得青魚肌球蛋白更容易發生聚集。
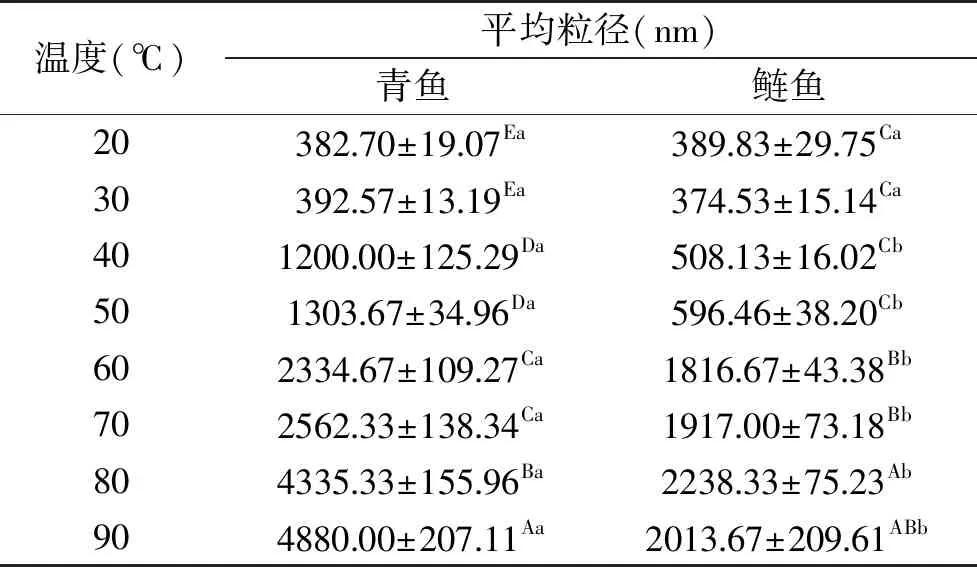
表3 加熱溫度對溶液中肌球蛋白平均粒徑(dz)的影響Table 3 Average size(dz)of myosin solutions under different heating temperatures
2.5 加熱過程中肌球蛋白的流變學特性
G′和δ可以用來表征蛋白在加熱過程中的動態流變的變化,圖2顯示青魚和鰱魚肌球蛋白熱誘導凝聚體形成過程中的流變學特性,由圖2可知,在10~37 ℃的范圍內,青魚肌球蛋白的G′略呈下降的趨勢,而鰱魚肌球蛋白在此階段的保持G′基本不變的趨勢,而兩者肌球蛋白的δ呈下降的趨勢。在37~48 ℃的范圍內,兩種肌球蛋白的G′均呈現上升,δ下降的趨勢,這是因為在低溫階段,肌球蛋白的流變學特性的變化主要是來自于蛋白質分子中熱穩定性較弱的區域的結構的改變。30~40 ℃時肌球蛋白輕鏈會發生解鏈[26],蛋白質之間發生交聯,形成不穩定的聚集體,使體系的黏度上升,從而使得G′上升,δ下降。G′達到第一個峰值及達到峰值的溫度隨著魚種、加熱速度、蛋白濃度等的不同而不同。淡水魚G′達到峰值的溫度存在差異,青魚和鰱魚肌球蛋白G′達到峰值的溫度分別為48.9和46.6 ℃。且兩者的峰值G′分別為278.48和83.95 Pa。進一步加熱,G′迅速下降,于55.02~58.80 ℃達到最小值,之后穩步上升。G′的降低可能是由于肌動球蛋白解離和肌球蛋白解折疊引起的[27],且高溫破壞了以氫鍵為主要作用力的低溫凝膠網絡結構,從而使得G′降低[28]。在48.4~58.80 ℃,δ的值是呈現先上升后下降的趨勢。繼續升高溫度,肌球蛋白G′的上升和δ下降,有可能是高溫使得二硫鍵和疏水相互作用等作用力的形成,從而促進凝膠網絡結構的形成[23,26]。青魚肌球蛋白的最終G′和δ分別為65.11 Pa和2.80 °,而鰱魚肌球蛋白的為37.67 Pa和4.23°。青魚肌球蛋白的熱誘導凝聚體形成能力高于鰱魚,其主要原因是青魚肌球蛋白分子的展開程度、疏水相互作用高于鰱魚。

圖2 肌球蛋白熱誘導凝膠形成過程中的 動態流變學性能的變化Fig.2 Changes in dynamic rheological properties of myosin during thermal gelation
2.6 肌球蛋白二級結構在熱膠凝過程中的作用
為了研究肌球蛋白的二級結構在熱凝膠形成過程中的作用,分析肌球蛋白在加熱過程中G′的變化與α-螺旋、β-折疊和β-轉角含量之間的關系。根據圖2中G′的變化可將肌球蛋白凝膠形成過程分成3個階段:10~45 ℃、45~60 ℃和60~80 ℃,對各階段G′與肌球蛋白α-螺旋、β-折疊和β-轉角含量分別用線性模型(1)、模型(2)和模型(3)進行擬合。模型如下:回歸結果見下表4。

表4 肌球蛋白的彈性模量G′與α-螺旋、β-折疊和β-轉角比例的相關性分析Table 4 Regression model for G′ of surimi on α-helical,β-sheet and β-turn contents
G′=k1A+b1
式(1)
G′=k2B+b2
式(2)
G′=k3C+b3
式(3)
由表4可知,在10~45 ℃溫度范圍內,青魚肌球蛋白的G′與α-螺旋含量呈顯著負相關(P<0.05),而鰱魚肌球蛋白的G′與α-螺旋含量呈極顯著負相關(P<0.01),青魚肌球蛋白的G′與β-折疊呈極顯著正相關(P<0.01),而鰱魚肌球蛋白與β-折疊無相關性。在45~60 ℃溫度范圍內,青魚肌球蛋白的G′與β-轉角含量無相關性,而鰱魚肌球蛋白的G′與β-轉角含量呈顯著負相關(P<0.05)。而在60~80 ℃溫度范圍內,青魚和鰱魚肌球蛋白的G′均與α-螺旋含量呈顯著負相關(P<0.05),青魚肌球蛋白的G′與β-轉角呈顯著正相關(P<0.05),鰱魚肌球蛋白的G′與β-轉角呈極顯著正相關(P<0.01)。綜合來說,青魚和鰱魚肌球蛋白分子α-螺旋向β-折疊或β-轉角轉變有利于肌球蛋白的熱凝膠作用。
3 結論
青魚和鰱魚肌球蛋白在熱誘導凝膠形成過程中,兩者二級結構存在一定的差異,青魚肌球蛋白自身的α-螺旋含量較低,β-轉角含量較高,青魚蛋白結構更為伸展,在熱誘導凝膠形成過程中,青魚肌球蛋白的展開程度高于鰱魚,青魚肌球蛋白較強的疏水相互作用使其聚集速度較快,聚集體的dz大,較高的變性和聚集程度使得蛋白凝膠形成能力強于鰱魚,且肌球蛋白分子α-螺旋向β-折疊或β-轉角轉變有利于肌球蛋白的熱凝膠作用。但二者熱誘導蛋白凝膠的嫩度、咀嚼性、保水性、顏色等最終影響產品的品質和口感等特性仍需進一步研究。

