添加叔丁醇鉀對Mg(NH2)2-2LiH體系儲氫性能的影響
馮文欽 李 超*,,2 劉凱元 蔡明源 范美強*,
(1中國計量大學材料與化學學院,杭州 310018)
(2硅材料國家重點實驗室,浙江大學材料科學與工程學院,杭州 310027)
0 引 言
氫能以其清潔高效、來源廣泛、能量密度高等諸多優點被認為是理想的二次能源。制約氫能實現大規模應用的關鍵技術壁壘是如何實現安全、高效、低成本的儲氫。與高壓氣態儲氫和液態儲氫技術相比,固態儲氫技術具備安全性好和儲氫密度高2大優勢,因此得到國內外專家的廣泛關注[1-2]。目前已開發出的高容量固態儲氫材料包括MgH2、NaAlH4、LiBH4、Mg(BH4)2、Li3N、Li2MgN2H2、NH3BH3等[3-12]。2002年,Chen等[12]發現Li3N可以可逆儲存質量分數11.4%的H2。后續諸多學者對金屬氮氫體系儲氫材料做了大量研究工作。Xiong和Luo等[13-14]通過調整Li-N-H體系中的金屬原子發現,Li2MgN2H2可以吸收并可逆儲存質量分數5.6%的H2,其吸放氫反應如方程式(1)所示:
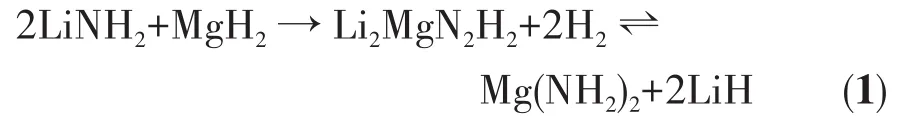
通過熱力學計算發現Mg(NH2)2-2LiH體系儲氫材料獲得105Pa平衡氫壓時所對應的反應溫度為90℃,該溫度已基本滿足車載儲氫材料的應用要求[15]。但在實際操作中,由于存在較高的動力學壁壘,Mg(NH2)2-2LiH樣品需要在130℃以上才開始放氫,200℃左右才有較高的放氫速率[16]。
為了改善該體系的吸放氫動力學性能,諸多學者在降低顆粒尺寸、納米限域、催化改性等方面做了大量的研究工作[17-35]。從該體系的放氫產物Li2MgN2H2出發,通過球磨方法調整樣品的顆粒尺寸,發現樣品顆粒尺寸的下降將顯著降低該體系吸放氫反應的動力學壁壘[17]。Xia等[19]通過模板法制備獲得了納米限域的Li2MgN2H2,碳骨架約束下的納米Li2MgN2H2在105℃的低溫條件下即可完成可逆吸放氫。在催化改性方面,目前研究發現對Mg(NH2)2-2LiH體系有催化改性效果的添加劑包括過渡金屬及其化合物、碳基材料、金屬硼氫化物、堿金屬基化合物及以上幾類物質的復合物等[20-35]。其中,堿金屬基化合物中的K基化合物對該體系的催化改性尤為明顯。Wang等[28]發現將KH部分替代LiH得到的Mg(NH2)2-1.9LiH-0.1KH可在80℃開始放氫,其放氫峰值溫度也僅為132℃,較原始樣品降低了50℃。后續研究發現,KF、KOH、K2ZnH4等K基化合物也對該體系有較好的催化改性作用[32-34]。值得注意的是,前期關于K基催化改性劑對該體系的催化改性研究集中在含鉀的無機化合物,而有機鉀鹽對該體系的催化改性研究未見報道。另外,在金屬硼氫儲氫體系中,Gu等[36]將含Ti有機化合物四乙醇鈦(Ti(OEt)4)添加至Ca(BH4)2中,實現在吸放氫過程中原位引入納米TiO2催化劑和多孔結構,從而使Ca(BH4)2的吸放氫熱力學和動力學性能得到顯著改善。考慮到K基添加劑對Mg(NH2)2-2LiH體系的催化改性作用,我們也希望通過添加有機鉀鹽,實現類似Ca(BH4)2添加四乙醇鈦后的效果。叔丁醇鉀(C4H9OK)是最常見的有機鉀鹽之一。叔丁醇根上3個甲基的誘導效應,會使其比其他醇鉀具有更強的堿性和活性,因此其作為催化劑也在化工醫藥等方面具有廣泛應用。
基于以上的文獻報道和分析,我們以含鉀有機化合物C4H9OK為添加劑,系統研究了其對Mg(NH2)2-2LiH體系儲氫性能的影響。研究發現,C4H9OK的添加顯著改善了Mg(NH2)2-2LiH體系的吸放氫性能。通過球磨制備的Mg(NH2)2-2LiH-0.08C4H9OK樣品在70℃左右開始放氫,較原始樣品降低了60℃。C4H9OK的添加降低了樣品放氫反應的表觀活化能和反應焓變,改善了放氫反應的動力學和熱力學性能。130℃完全放氫后的樣品可在50℃開始吸氫,150℃時已基本氫化完全。C4H9OK在Mg(NH2)2-2LiH體系吸放氫過程中起到了良好的催化改性作用。
1 實驗部分
1.1 實驗原材料及樣品制備
所用原材料氫化鋰(LiH,98%,Alfa Aesar)、鎂粉(Mg,99%,Sinopharm)、C4H9OK(98%,Macklin)均為商業購買并直接使用。氨基鎂(Mg(NH2)2)為實驗室自主合成,具體合成步驟:首先在氬氣氣氛手套箱中將4 g鎂粉裝入帶閥門的球磨罐中,接著向球磨罐中充入NH3并球磨72 h,然后再將球磨后的樣品置于7×105Pa氨壓條件下300℃煅燒,最終合成氨基鎂。Mg(NH2)2-2LiH-xC4H9OK(x=0、0.03、0.05、0.08、0.1,代表C4H9OK的物質的量對應數值,即0、0.03、0.05、0.08、0.1 mol)樣品通過機械球磨法制備而得,具體為將相應物質的量的Mg(NH2)2、LiH、C4H9OK置于球磨罐中并以500 r·min-1球磨24 h,為防止球磨過程中的放氫,球磨在5×106Pa氫壓條件下進行。由于實驗所需試劑會與空氣中的O2和H2O發生反應,因此實驗操作過程中的裝樣和處理等均在充滿氬氣的手套箱(MBRAUM)中進行,手套箱內部氧和水的含量(體積分數)均在10-6以下。
1.2 儲氫性能測試
采用自制的程序控溫脫附裝置(TPD)進行放氫定性測試,其中載氣為高純氬氣,氣流量為20 mL·min-1,每次測試所用的樣品量為30 mg,升溫速率為1~5 ℃·min-1。另外還有一臺質譜儀(MS,Hiden-QIC-20)與TPD相連接,可檢測脫附氣體中的組成成分。吸放氫定量測試在實驗室自制的Sieverts型氣-固反應裝置上進行,放氫測試前要對裝置進行抽真空處理,吸氫測試則在8×106Pa氫壓下進行。隨溫放氫和隨溫吸氫測試的升溫速率分別為2和1℃·min-1,等溫吸放氫測試則是以10℃·min-1的加熱速率快速升溫至預定溫度并保溫處理,吸放氫測試的樣品質量為100~120 mg。采用Netzsch DSC200F3熱分析儀對樣品進行差示掃描量熱(DSC)測試,每次測試的樣品用量約為5 mg,所用的載流氣為高純氬氣,升溫速率為2℃·min-1。
1.3 成分結構表征
材料的物相結構在X射線衍射儀(XRD,Rigaku MiniFlex 600)上進行測試分析,輻射源為Cu靶Kα射線,X射線波長為0.154 nm,功率為40 kV×40 mA,掃描的角度范圍2θ=10°~90°,步長為0.05°。為防止測試樣品與空氣接觸,測試過程中采用了自制透明密閉罩隔離空氣。FTIR測試所用儀器為Bruker Tensor 27型傅里葉變換紅外光譜儀,測試模式采用透射模式。將樣品粉末與KBr粉末以1∶30的質量比混合研磨均勻,稱取約100 mg混合粉末,用壓片機壓制成直徑為13 mm的小圓片進行測試。測試時掃描波數設置為400~4 000 cm-1,分辨率為4 cm-1,數據取16次掃描的平均值。
2 結果與討論
2.1 Mg(NH2)2-2LiH-xC4H9OK的放氫性能
為了探究不同C4H9OK添加量對Mg(NH2)2-2LiH體系放氫性能的影響,對球磨后的Mg(NH2)2-2LiH-xC4H9OK(x=0、0.03、0.05、0.08、0.1)樣品做了TPD-MS測試,結果如圖1所示,其中圖1a為H2信號,圖1b為NH3信號。H2信號顯示,原始樣品Mg(NH2)2-2LiH的放氫曲線僅有一個單峰,起始放氫溫度、放氫峰值溫度、放氫結束溫度分別為130、187、235℃,這與之前的報道一致[32]。當添加C4H9OK之后,樣品的放氫曲線明顯向低溫方向偏移且變為一條包含3個放氫峰的復雜曲線。當C4H9OK的添加量由0.03 mol逐漸增加到0.08 mol時,樣品的起始放氫溫度和最強放氫峰的峰值溫度逐漸降低到了70和145℃,較原始樣品分別降低了60和42℃;進一步增大C4H9OK的添加量到0.1 mol,樣品的起始放氫溫度不再繼續降低,最強放氫峰值溫度仍略有降低到143℃。對于放氫結束溫度,添加C4H9OK后的樣品也有明顯的降低,當添加量到0.08 mol時,放氫結束溫度降至210℃,較原始樣品降低25℃。樣品在加熱過程中的NH3釋放情況如圖1b所示,Mg(NH2)2-2LiH原始樣品加熱到150℃后可檢測出較為明顯的NH3信號,NH3釋放與H2釋放的溫度區間基本吻合。當樣品添加C4H9OK后,在整個加熱過程中已基本檢測不到NH3的信號,說明添加C4H9OK可以有效地抑制副產物NH3的釋放,這將有利于提高材料在吸放氫循環過程中的穩定性。
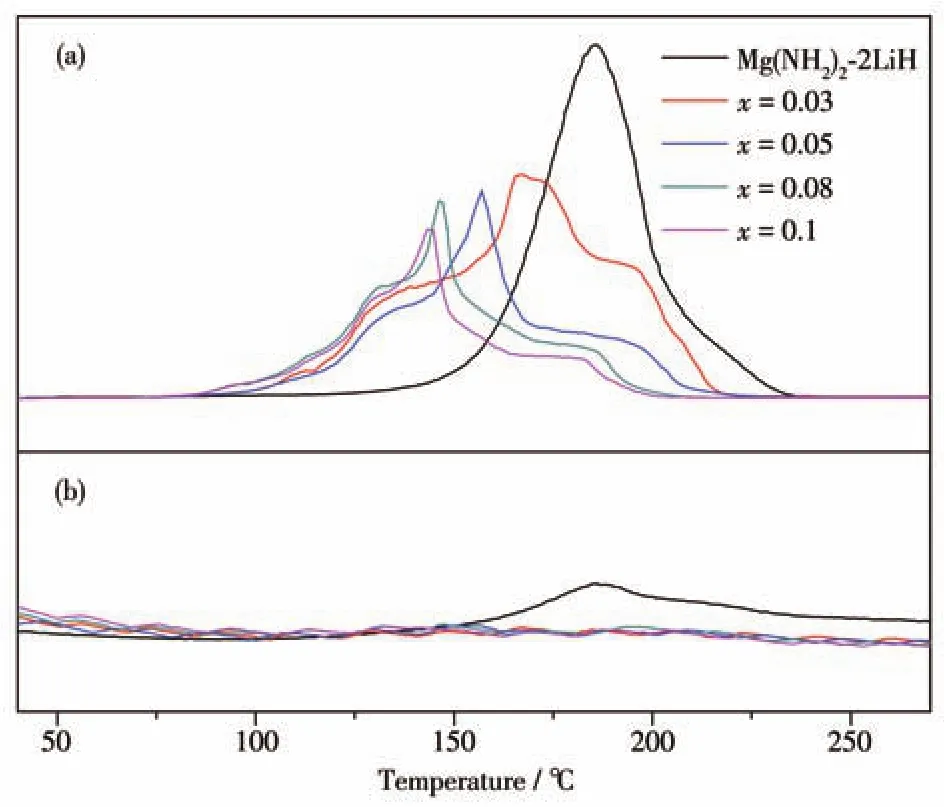
圖1 Mg(NH2)2-2LiH-xC4H9OK樣品的TPD-MS曲線:(a)H2信號;(b)NH3信號Fig.1 TPD-MS curves of Mg(NH2)2-2LiH-xC4H9OK samples:(a)H2 signal;(b)NH3 signal
圖2為Mg(NH2)2-2LiH-xC4H9OK(x=0、0.03、0.05、0.08、0.1)樣品的體積放氫曲線。Mg(NH2)2-2LiH原始樣品的起始放氫溫度為130℃,加熱至250℃的放氫容量(質量分數,下同)為5.43%。隨著C4H9OK的添加量由0.03 mol增加到0.08 mol,樣品的放氫溫度較原始樣品逐漸降低,放氫容量也逐漸降低至4.84%。Mg(NH2)2-2LiH-0.08C4H9OK樣品的起始放氫溫度僅為70℃,140℃時即可釋放2%的H2,而原始樣品釋放相同氫氣量所需溫度達185℃。繼續增加C4H9OK的添加量至0.1 mol,樣品的放氫溫度較添加0.08 mol C4H9OK的樣品無明顯降低,但放氫容量進一步降低至4.67%,較原始樣品降低約14%。5個樣品的放氫溫度規律與圖1曲線中表現出的放氫溫度規律相吻合,放氫容量隨C4H9OK添加量的增大而逐漸降低。綜合考慮樣品的放氫溫度、放氫量和抑制放氨情況可知,0.08 mol C4H9OK的添加量為最佳的添加比例。Mg(NH2)2-2LiH-0.08C4H9OK樣品的起始放氫溫度和放氫結束溫度分別低至70和210℃,放氫容量可達到4.84%。因此,后續集中對Mg(NH2)2-2LiH-0.08C4H9OK樣品進行了放氫動力學、熱力學和可逆性的研究。
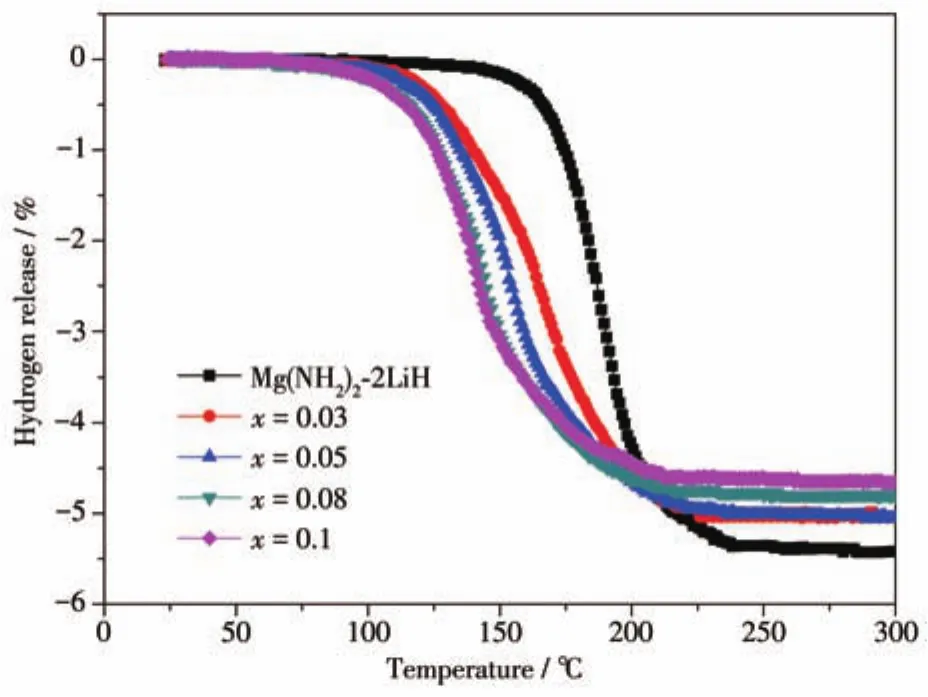
圖2 Mg(NH2)2-2LiH-xC4H9OK樣品的體積放氫曲線Fig.2 Volumetric release curves of Mg(NH2)2-2LiH-xC4H9OK samples
2.2 Mg(NH2)2-2LiH-0.08C4H9OK的放氫動力學和熱力學
為考察添加0.08 mol C4H9OK后樣品的放氫動力學性能,我們對Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品做了110~150℃的等溫放氫測試,結果如圖3所示。顯然,添加C4H9OK后,Mg(NH2)2-2LiH體系的放氫動力學性能得到顯著提高。Mg(NH2)2-2LiH-0.08C4H9OK樣品在較低溫度110℃下360 min內可以放出約2.4%的H2,而相同條件下,Mg(NH2)2-2LiH原始樣品基本無H2放出。當溫度上升至130℃時,Mg(NH2)2-2LiH-0.08C4H9OK樣品的放氫速率進一步提高,該樣品可在100 min內釋放出3.31%的H2,而原始樣品相同條件下僅釋放出0.23%的H2。當放氫溫度進一步升高至150℃時,Mg(NH2)2-2LiH-0.08C4H9OK樣品在50 min內迅速放出3.82%的H2,而原始樣品在該溫度下即使保溫360 min,放氫量也只達到3.73%。對Mg(NH2)2-2LiH-0.08C4H9OK和Mg(NH2)2-2LiH兩個樣品在150℃的放氫曲線進行放氫速率分析,即計算2條曲線初始階段的斜率發現,二者的放氫速率分別為0.134%·min-1和0.013%·min-1,添加0.08 mol C4H9OK樣品的放氫速率達到了Mg(NH2)2-2LiH原始樣品的10倍。
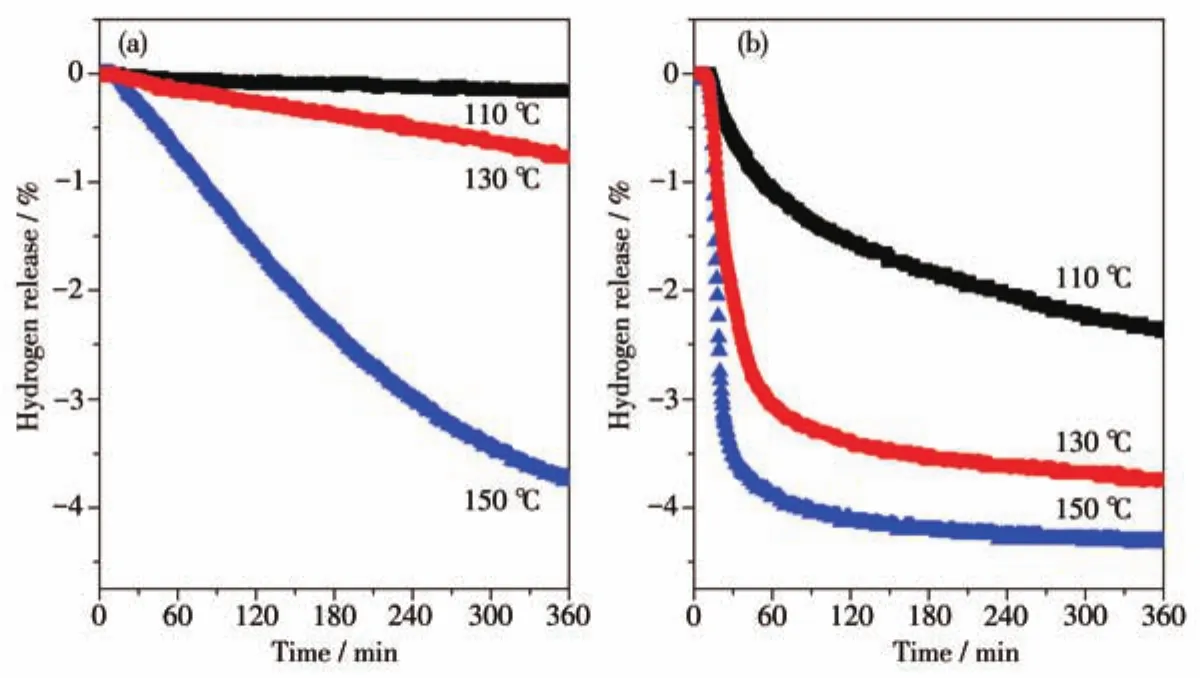
圖3 Mg(NH2)2-2LiH(a)和Mg(NH2)2-2LiH-0.08C4H9OK(b)樣品的等溫放氫曲線Fig.3 Isothermal dehydrogenation curves of Mg(NH2)2-2LiH(a)and Mg(NH2)2-2LiH-0.08C4H9OK(b)samples
一般情況下,儲氫材料操作溫度取決于其反應動力學和熱力學,二者分別可由表觀活化能(Ea)和反應焓變描述。在對Mg(NH2)2-2LiH體系的研究中,普遍采用Kissin ger法計算樣品在放氫過程中的Ea[15-16,26],具體如方程式(2)所示:
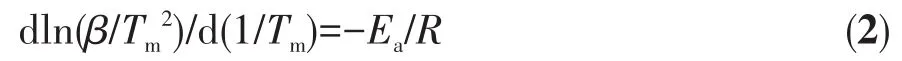
其中,β代表升溫的速率,Tm代表反應峰值溫度,R是理想氣體常數。對樣品在不同升溫速率下(1~5℃·min-1)做TPD測試,可獲得不同升溫速率下的放氫反應峰值溫度,通過數據擬合即可求得Ea的數值。圖4為Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品在不同升溫速率下的TPD曲線及其相應的Kissinger曲線。由圖可知,原始樣品的TPD曲線上顯示一個峰值溫度,經數據擬合計算得到Mg(NH2)2-2LiH樣品的Ea為112.2 kJ·mol-1。這與之前報道的結果相吻合[33]。Mg(NH2)2-2LiH-0.08C4H9OK樣品的TPD曲線與圖1所示的MS曲線相似,放氫過程包含3個放氫峰。經擬合計算,3個放氫峰對應的Ea分別為 90.6、111.4 和 92.3 kJ·mol-1。第一步和第三步反應的Ea較原始樣品分別降低了19.25%和17.74%,第二步反應的Ea較原始樣品略有降低。整體而言,Ea的降低是Mg(NH2)2-2LiH-0.08C4H9OK樣品放氫溫度得以降低、反應動力學性能提高的主要原因之一。

圖4 Mg(NH2)2-2LiH(a、b)和Mg(NH2)2-2LiH-0.08C4H9OK(c、d)樣品在不同升溫速率下的TPD曲線及其Kissinger曲線Fig.4 TPD curves and Kissinger plots of Mg(NH2)2-2LiH(a,b)and Mg(NH2)2-2LiH-0.08C4H9OK(c,d)samples
圖5為Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品的DSC曲線。與原始樣品相比,添加C4H9OK樣品的放氫過程中的吸熱曲線變為包含3個吸熱峰的較復雜曲線,說明放氫反應歷程發生了一定的變化。另外,Mg(NH2)2-2LiH-0.08C4H9OK樣品的放氫吸熱峰明顯向低溫方向偏移,進一步印證了添加C4H9OK后樣品放氫溫度的降低。Mg(NH2)2-2LiH-0.08C4H9OK樣品在190~230℃之間出現了一個較為明顯的放熱峰,該放熱峰可能是源于放氫產物Li2MgH2H2由立方相到正交相的晶型轉變,其他K基添加劑體系中也發現了相似的情況[29],該結果也會在后面的結構分析中得到進一步驗證。對Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK兩個樣品的放熱峰做積分處理,得到二者放氫過程中的熱效應分別為(1 060±10.6)和(919±9.2)J·g-1,其對應的放氫反應焓變分別為(39.3±0.4)和(38.3±0.4)kJ·molH2-1(生成1 mol H2對應的焓變)。添加0.08 mol C4H9OK樣品的放氫反應焓變較原始樣品有一定的降低,這也是Mg(NH2)2-2LiH-0.08C4H9OK樣品放氫反應溫度降低的原因之一。綜上所述,Mg(NH2)2-2LiH-0.08C4H9OK樣品的放氫反應活化能和反應焓變均有不同程度的降低,說明該體系的放氫反應動力學和熱力學性能均有一定的提高和改善,從而使該體系放氫反應溫度降低、儲氫性能得以改善。
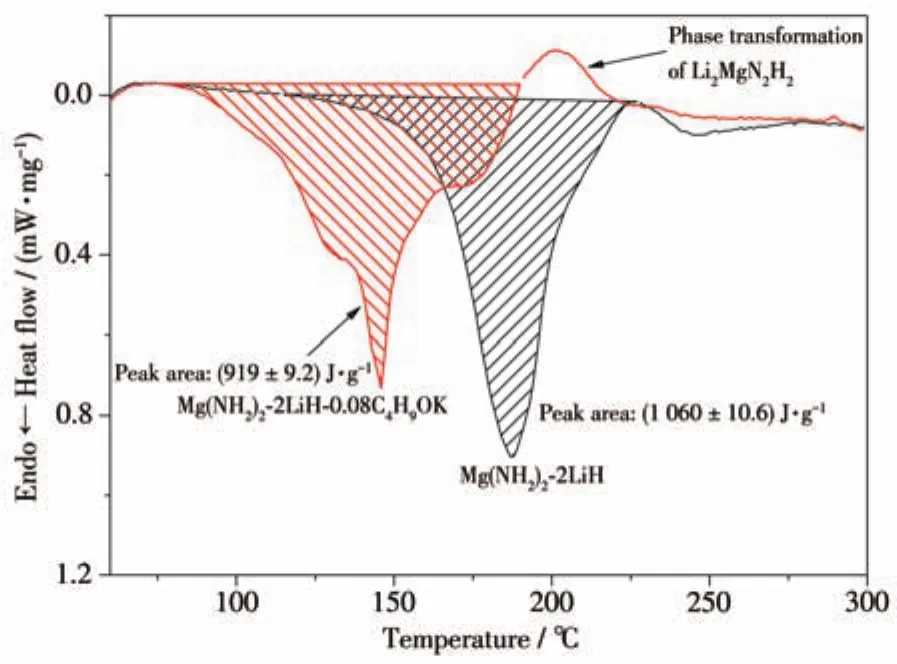
圖5 Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品的DSC曲線Fig.5 DSC curves of Mg(NH2)2-2LiH and Mg(NH2)2-2LiH-0.08C4H9OK samples
2.3 Mg(NH2)2-2LiH-0.08C4H9OK的可逆及循環儲氫性能
為了進一步研究C4H9OK的添加對該體系吸氫性能的影響,首先將Mg(NH2)2-2LiH-0.08C4H9OK樣品在130℃條件下完全放氫,然后對放氫樣品在8×106Pa氫壓下做吸氫測試。作為吸氫參比樣,Mg(NH2)2-2LiH樣品先在180℃條件下做完全放氫處理;為了避免因放氫溫度不同引起顆粒尺寸大小不同的影響,又對放氫后的Mg(NH2)2-2LiH樣品進行了24 h的高能球磨處理。圖6為Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品的200℃下的隨溫吸氫曲線和120℃下的等溫吸氫曲線。
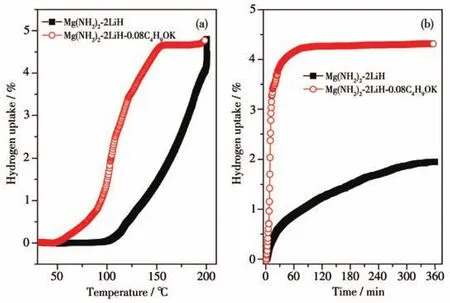
圖6 Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品的隨溫吸氫曲線(a)和120℃下的等溫吸氫曲線(b)Fig.6 Variable temperature hydrogenation(a)and isothermal hydrogenation(b)curves of Mg(NH2)2-2LiH and Mg(NH2)2-2LiH-0.08C4H9OK samples at 120℃
由圖6a可知,Mg(NH2)2-2LiH原始樣品的起始吸氫溫度約為100℃,而Mg(NH2)2-2LiH-0.08C4H9OK樣品的起始吸氫溫度僅為50℃,較原始樣大幅降低了50℃。隨著溫度逐漸升高,添加0.08 mol C4H9OK的樣品在150℃時的吸氫量(質量分數,下同)即達到接近飽和氫化的4.65%,而相同溫度條件下原始樣品的吸氫量僅為1.36%。進一步將操作溫度升高至200℃并保溫2 h,Mg(NH2)2-2LiH-0.08C4H9OK樣品的吸氫量略微增加至4.75%,Mg(NH2)2-2LiH逐漸升高至4.80%。對比圖2所示的首次放氫容量,在此條件下,Mg(NH2)2-2LiH-0.08C4H9OK已基本實現完全可逆化吸氫,而原始樣品的可逆吸氫量約為88%。由此可見,C4H9OK的添加顯著降低了樣品的氫化操作溫度,極大改善了Mg(NH2)2-2LiH體系的吸氫性能。
為了進一步探究添加C4H9OK對Mg(NH2)2-2LiH體系吸氫動力學的影響,對完全放氫后的Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK兩個樣品又分別做了120℃的等溫吸氫測試,實驗結果如圖6b所示。在8×106Pa氫壓和120℃的條件下,原始Mg(NH2)2-2LiH樣品的吸氫較為緩慢,在360 min內的吸氫量為1.95%;然而在相同的氫壓和溫度下,Mg(NH2)2-2LiH-0.08C4H9OK樣品在50 min內就可以快速吸收4.11%的H2,360 min的吸氫量為4.32%。通過分析計算Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK兩條吸氫曲線線性部分的斜率,可得2個樣品的吸氫速率分別為0.042%·min-1和0.46%·min-1,即Mg(NH2)2-2LiH-0.08C4H9OK樣品的吸氫速率約為原始樣品的11倍。C4H9OK的添加顯著提高了Mg(NH2)2-2LiH體系的吸氫動力學性能。
圖7為Mg(NH2)2-2LiH-0.08C4H9OK樣品10次吸放氫循環過程中的體積放氫曲線和循環容量圖。循環條件為170℃保溫2 h下進行放氫測試,150℃保溫2 h下進行吸氫測試。如圖所示,樣品在第一次循環時效果最好,在加熱階段即有3.83%的放氫量,保溫2 h后的最終放氫量為4.38%。第二次循環時,樣品的放氫曲線向高溫方向偏移,升溫階段的放氫量降低至1.72%,保溫后的最終放氫量為4.14%。第三次循環時放氫曲線又向高溫方向略有偏移,最終的放氫量為3.60%。后面的第四至第十個循環,樣品的放氫曲線基本重合,最終放氫容量也基本保持在質量分數3.55%左右。由此可見,Mg(NH2)2-2LiH-0.08C4H9OK樣品在該循環條件下,前3次循環過程中樣品的放氫反應溫度逐漸向高溫偏移,放氫容量也逐漸由4.38%降低至3.60%,后7個循環中樣品表現出良好的循環穩定性,儲氫容量保持在3.55%左右。前3個循環放氫性能變差的原因主要為球磨的樣品顆粒尺寸較小,樣品中的缺陷較多,在吸放氫循環反應過程中樣品顆粒尺寸會略有增大,缺陷也會逐漸減少,從而使反應動力學性能略有變差。當顆粒尺寸達到一個穩定狀態后,樣品表現出良好的循環穩定性。

圖7 Mg(NH2)2-2LiH-0.08C4H9OK樣品可逆循環過程中的體積放氫曲線和循環容量圖Fig.7 Volumetric release curves and cycling capacities for the reversible hydrogen storage of Mg(NH2)2-2LiH-0.08C4H9OK sample
2.4 C4H9OK在放氫過程中的作用機制
圖8為Mg(NH2)2-2LiH-0.08C4H9OK樣品在不同放氫階段的XRD圖和FTIR譜圖。對于球磨后的樣品,在XRD圖上2θ為38.2°、44.4°、64.6°處檢測到了LiH的衍射特征峰,FTIR譜圖上在3 272、3 328 cm-1處檢測到Mg(NH2)2的N—H鍵吸收特征峰。此外,FTIR譜圖中2 854、2 890、2 920、2 955 cm-1處也有4個明顯的FTIR吸收峰,該吸收位置屬于C—H鍵伸縮振動的吸收范圍,因此認為此處的4個FTIR吸收峰與C4H9OK相關。對C4H9OK本身做FTIR測試(圖9)發現,其在 2 854、2 890、2 920、2 955 cm-1處的FTIR吸收峰與球磨后的Mg(NH2)2-2LiH-0.08C4H9OK樣品完全一致,而Mg(NH2)2-2LiH原始樣品在這4個波數處沒有FTIR吸收。由此可知,球磨后C4H9OK本身并未發生變化。XRD圖中未檢測到Mg(NH2)2和C4H9OK的衍射特征峰,原因是Mg(NH2)2球磨后會變為無定形態,C4H9OK的添加量太少且高能球磨也會導致其非晶化。綜上可知,球磨后的Mg(NH2)2-2LiH-0.08C4H9OK樣品仍然為Mg(NH2)2、LiH和C4H9OK三相。
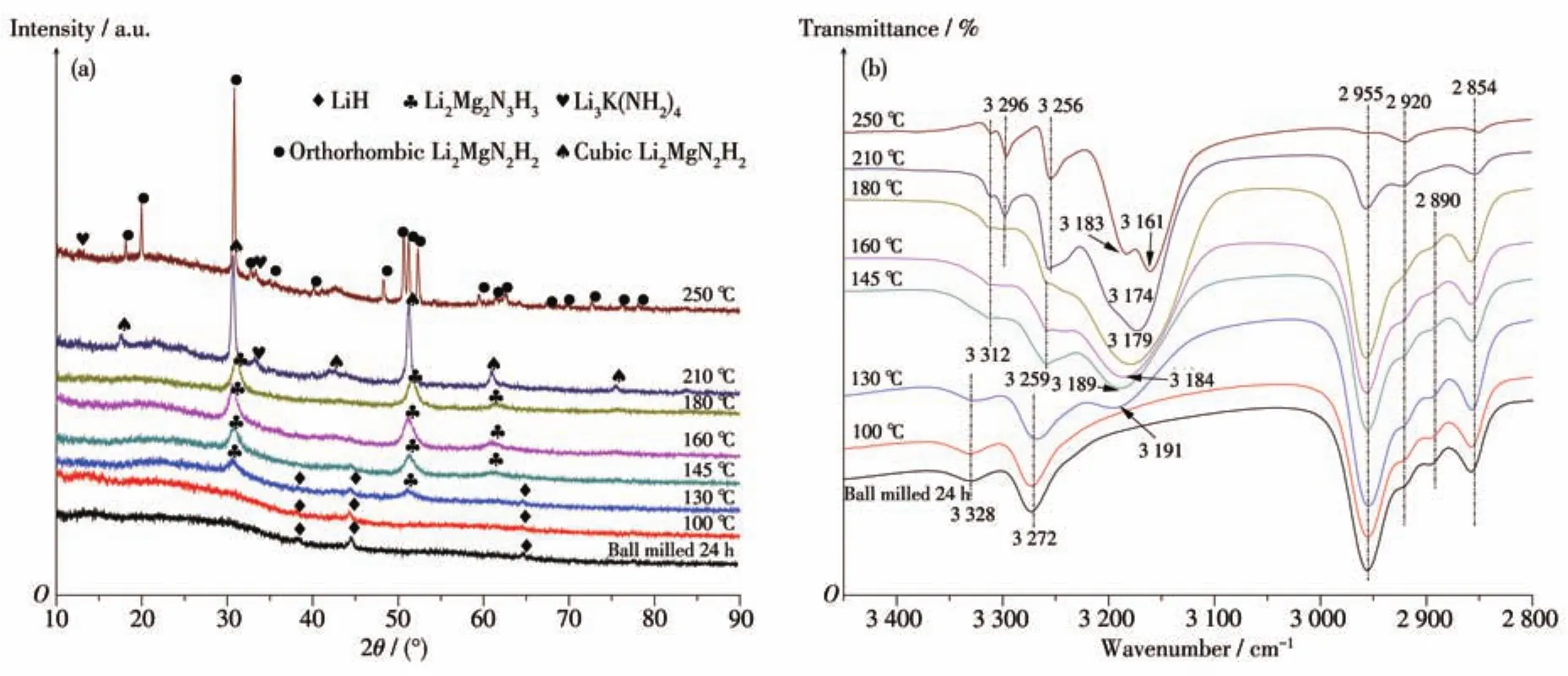
圖8 Mg(NH2)2-2LiH-0.08C4H9OK樣品在不同放氫階段的XRD圖(a)和FTIR譜圖(b)Fig.8 XRD patterns(a)and FTIR spectra(b)of dehydrogenated Mg(NH2)2-2LiH-0.08C4H9OK samples at different stages
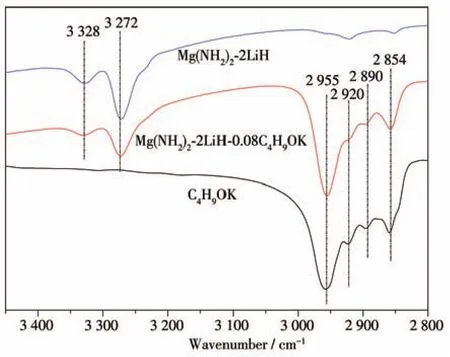
圖9 C4H9OK粉末、球磨后的Mg(NH2)2-2LiH和Mg(NH2)2-2LiH-0.08C4H9OK樣品的FTIR譜圖Fig.9 FTIR spectra of the C4H9OK,as-milled Mg(NH2)2-2LiH and Mg(NH2)2-2LiH-0.08C4H9OK samples
當溫度上升至100℃時,Mg(NH2)2-2LiH-0.08C4H9OK樣品的FTIR和XRD圖上的吸收峰和衍射峰位置與球磨后的樣品基本一致,無明顯變化。當樣品加熱至130℃時,XRD圖在30.3°和51.0°處出現了Li2Mg2N3H3的衍射特征峰,FTIR譜圖同樣在3 191 cm-1處檢測到了Li2Mg2N3H3的FTIR吸收特征峰。當升溫至145℃時,XRD圖中30.3°和51.0°處的Li2Mg2N3H3的特征峰明顯增強,同時在60.7°處出現了Li2Mg2N3H3的另一個衍射特征峰,而LiH的衍射峰消失了;FTIR譜圖上Mg(NH2)2吸收特征峰消失了,取而代之的是在3 259、3 312 cm-1處檢測到了LiNH2的FTIR特征峰,Li2Mg2N3H3的吸收特征峰偏移至 3 189 cm-1。在該過程中,2 854、2 890、2 920、2 955 cm-1處C4H9OK的FTIR特征峰并無明顯變化。因此,該階段的放氫反應如方程式(3)所示,C4H9OK起催化改性的作用。
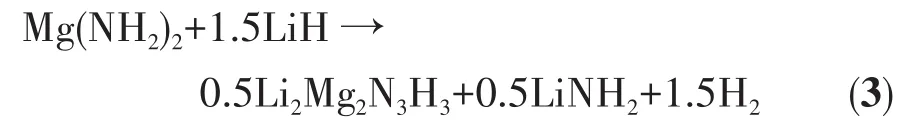
當溫度處于145~180℃之間時,XRD圖上沒有新的衍射特征峰出現,FTIR結果顯示,LiNH2在3 259、3 312 cm-1處的吸收特征峰隨溫度升高有所減弱,Li2Mg2N3H3的吸收特征峰繼續紅移至3 179 cm-1處,該FTIR吸收峰與立方相Li2MgN2H2相接近。這說明Li2Mg2N3H3與LiNH2和剩余的LiH已經開始發生反應生成Li2MgN2H2,如反應式(4)所示。值得注意的是,該階段C4H9OK對應的4個FTIR吸收峰仍無明顯變化,說明在該反應的初始階段C4H9OK仍起到催化改性作用。在180℃前的放氫階段,C4H9OK中K元素的存在可弱化氨基物/亞氨基物內部的N—H鍵和Li—N鍵,這將有利于放氫反應過程中原子/離子的重排、遷移和傳遞等,從而加快放氫反應的進行,改善材料的放氫反應動力學性能。
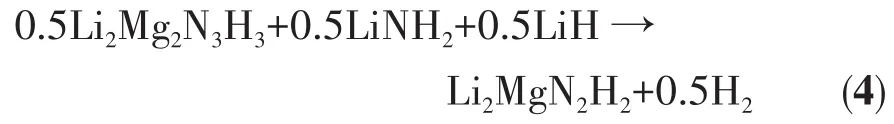
當樣品繼續升溫至210℃時,XRD圖和FTIR譜圖較180℃時的有較大區別。XRD圖上主要有17.5°、30.7°、42.6°、50.9°、61.0°、75.5°六個特征衍射峰,均屬于立方相Li2MgN2H2。此時FTIR譜圖上N—H鍵的最強峰在3 174 cm-1處,該峰為立方相的Li2MgN2H2的吸收特征峰,此結果也與XRD數據相吻合。另外,XRD圖中21.4°處有一個較為明顯的衍射特征峰,該峰為Li3K(NH2)4的最強衍射峰。FTIR譜圖上3 256、3 296、3 312 cm-1處出現了新的FTIR吸收峰,這些峰也屬于Li3K(NH2)4[32];同時,C4H9OK在2 854、2 890、2 920、2 955 cm-1處的吸收峰明顯減弱。以上情況說明,該階段C4H9OK已經開始分解,其中K元素最終以Li3K(NH2)4的形式存在。
當溫度繼續升高至250℃時,XRD圖上占主導地位的是正交相 Li2MgN2H2,同時在 12.3°和 21.4°處檢測到了Li3K(NH2)4的衍射峰。FTIR譜圖顯示,3 174 cm-1處立方相的Li2MgN2H2的FTIR吸收峰消失,在3 161、3 183 cm-1處檢測到正交相Li2MgN2H2的FTIR吸收峰,結果與XRD相符合,而C4H9OK的FTIR吸收峰已基本消失。這說明在這一階段放氫主產物Li2MgN2H2發生了由立方相向正交相的晶型轉變,該結果也與圖5中的DSC測試結果相吻合。同時,C4H9OK已基本完全分解并參與反應最終生成Li3K(NH2)4。
綜合可知,整個放氫過程的主反應為Mg(NH2)2與LiH首先反應生成Li2Mg2N3H3和LiNH2,Li2Mg2N3H3、LiNH2繼續與剩余的LiH反應生成Li2MgN2H2。在此過程中,180℃前較低溫度階段C4H9OK并未發生明顯變化,其起到了催化改性的作用,當溫度進一步升高時,C4H9OK將會分解并參與放氫反應最終生成Li3K(NH2)4。
3 結論
詳細研究了添加不同量C4H9OK對Mg(NH2)2-2LiH體系吸放氫性能的影響,其中添加量為0.08 mol時表現出最佳催化改性效果。Mg(NH2)2-2LiH-0.08C4H9OK樣品的放氫容量為4.84%,其起始放氫溫度和放氫峰值溫度分別為70和145℃,較原始樣品分別降低了60和42℃。150℃條件下,Mg(NH2)2-2LiH-0.08C4H9OK樣品在50 min內即可迅速放出質量分數3.82%的H2,表現出極好的放氫動力學性能。該體系的表觀活化能和反應焓變降低、放氫反應動力學和熱力學性能的改善是樣品放氫溫度降低的原因。對于130℃放氫后的Mg(NH2)2-2LiH-0.08C4H9OK樣品,隨溫條件下可在50℃開始吸氫,150℃時接近完全氫化;120℃等溫條件下可在50 min內快速吸收4.11%的H2,表現出良好的可逆吸氫性能。機理分析發現,180℃之前,C4H9OK對Mg(NH2)2-2LiH體系的放氫起催化改性作用,進一步升高溫度后,C4H9OK將會分解并參與放氫反應最終生成Li3K(NH2)4。
- 無機化學學報的其它文章
- Synthesis and Characterization of Palladium Nanoparticles with High Proportion of Exposed(111)Facet for Hydrogenation Performance
- Syntheses,Crystal Structures,Luminescence and Catalytic Activity of Manganese(Ⅱ)and Cadmium(Ⅱ)Coordination Polymers Based on 2,3-Dihydroxy-terephthalic Acid
- Scale-Up Strategy to Develop Highly-Effective Co-N-C@KB Composites as Sulfur Host for Lithium-Sulfur Battery
- Self-Assembled Zn2+,Co2+ and Ni2+ Complexes Based on Coumarin Schiff Base Ligands:Synthesis,Crystal Structure and Spectral Properties
- Synthesis,Characterization,and X-ray Crystal Structure Analysis of Cu(Ⅰ)/Cu(Ⅱ)Complexes of Phenanthridine and Triphenylphosphine
- 熒光猝滅型硼氟二吡咯類Cu2+探針的合成及其生物細胞成像的應用

