大腸桿菌耐藥菌的體外誘導及主動外排基因acrA表達量的變化
付賽賽,秦廣利,夏威風,劉培培
(1.商丘職業技術學院,河南 商丘 476000; 2.商丘市動物衛生監督所)
隨著抗菌藥在獸醫臨床長期應用,臨床分離菌對各種抗生素類藥物的耐藥率都在逐年升高[1]。目前研究表明,大腸埃希菌的主動外排作用是產生多重耐藥的重要原因[2-4],也是當前國內外研究的熱點之一。主動外排系指大腸桿菌細胞內膜存在的能量依賴性蛋白質外輸泵,通過主動外排作用,可將藥物從菌體內排出,使到達作用靶位點的藥量減少,不足以發揮殺菌或抑菌作用[5]。大腸桿菌是發現外輸泵最多的一種細菌,在埃希氏大腸桿菌上發現了30多種外輸泵,但一般認為AcrAB-TolC是最主要的外輸泵[6,15]。本試驗主要研究大腸桿菌的誘導不同代數耐藥性與主動外排基因acrA表達量的關系,是外輸泵介導的大腸桿菌耐藥性研究中具有重要意義的步驟。
1 材料與方法
1.1試驗菌株 試驗菌株編號分別為:1、11、88、017、035、040、045、048、94、T7等10株。其各株對環丙沙星的最低抑菌濃度值(MIC)見表1。

表1 菌株環丙沙星的MIC值(μg/mL)
1.2試驗方法
1.2.1耐藥菌的誘導 使用環丙沙星對以上10株“耐藥菌”進行誘導培養。將1/2 MIC的環丙沙星溶液作為初始誘導濃度。37℃恒溫培養18~24 h,此即為1代,連續共計傳30代,每隔5代測定MIC,并調整LB肉湯中的藥物濃度,使之始終保持1/2 MIC。并將誘導的菌液劃線于麥康凱培養基,觀察菌落形態及是否污染有雜菌。若在傳代過程中菌株生長不良,則使用上代菌株在無藥物狀態下使細菌生長,但不計代數,然后加入1/2 MIC的藥物繼續傳代。挑取每隔5代的菌株,并在每個原有菌株編號下標5、10、15、20、25、30表示誘導的代數,共得到誘導培養的菌株60株,用于下一步誘導菌株外排表達量的測定。
1.2.2總RNA抽提 利用Trizol法。
1.2.3濃度檢測 取2 μL儲存液加入另一個EP管中,再加入98 μL無RNase水,離心混勻,以無RNase水作空白對照,核酸定量檢測儀測定RNA的吸收值,根據OD260值計算RNA的濃度,以OD260/OD280的比值判斷其純度。
1.2.5cDNA的PCR擴增 以反轉錄的cDNA為模板,進行PCR擴增,按照比例配制反應體系,反應條件為:94 ℃預變性 5 min;94 ℃變性30 s、62 ℃退火30 s、72 ℃ 60 s,共30個循環;72 ℃延伸10 min。反應結束后,取5 μL PCR擴增產物,1.0%瓊脂糖凝膠進行電泳。
1.3PCR產物的純化與回收
1.3.1持家基因的擴增 將稀釋好的膠回收PCR產物作為模板進行擴增,反應體系為20 μL:SYBR real-time PCR premature 10 μL;FP、RP各0.4 μL,不同濃度稀釋的模板2 μL,超純水7.2 μL。
1.3.3實時定量PCR檢測mRNA水平 利用本研究所建立的實時定量RT-PCR的方法對樣品中持家基因gapA和大腸桿菌主動外排基因acrA進行定量檢測,得到各個檢測樣品的Ct值。利用持家基因做校正,對大腸桿菌主動外排基因mRNA相對表達水平進行分析。
1.4相對表達水平計算 采用2-△△Ct法計算各基因在不耐藥程度菌株中的相對表達水平,具體方法如下:測定各個檢測樣品的Ct值,每個樣品重復 2次,并由熔解曲線判定PCR反應的特異性,然后由測得的各菌株的主動外排基因acrA基因的Ct值,減去相同菌株的持家基因gapA的Ct值,即得校正值,記做△Ct,即△Ct目的基因=Ct目的基因-Ct持家基因,然后用臨床菌株各個基因的△Ct值,減去大腸桿菌標準菌株ATCC25922對應的△Ct值,即得△△Ct,即△△Ct=△Ct臨床株-△Ct標準菌株,各目的基因mRNA的相對表達量以2-△△Ct表示。
2 結果與分析
2.1最低抑菌濃度 各個誘導大腸桿菌的MIC值如表2所示。
從表2可以看出,不同菌株的大腸桿菌隨著在含有1/2 MIC的培養基中培養,各個大腸桿菌的最低抑菌濃度(MIC)均有所增加。菌株94、035、040、045、048培養到30代時, 最低抑菌濃度(MIC)變為原來的2倍;菌株88、017的MIC都變為原來的4倍,但是菌株88的MIC值經歷先變小后變大的過程;而菌株1的耐藥性相對比較穩定,其最低抑菌濃度一直是256 μg/mL。菌株11在用含有1/2 MIC環丙沙星的培養液培養時一直未長出菌體,1/4 MIC、1/8 MIC、2 μg/mL、1 μg/mL也未長出菌體,可能是該大腸桿菌發生變異,導致對環丙沙星的耐藥性喪失。
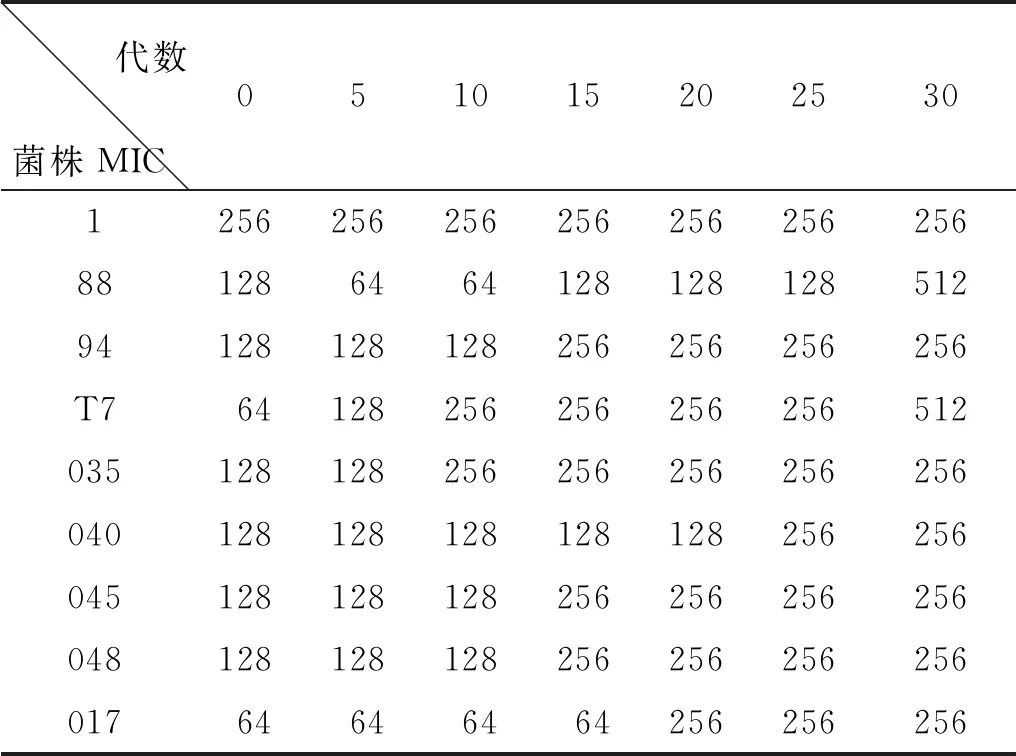
表2 環丙沙星對誘導菌株MIC值的測定結果(μg/mL)
2.2相對表達水平 采用2-△△Ct法計算不同耐藥菌株主動外排基因 acrA的相對表達量,結果見表3。

表3 不同耐藥程度臨床菌株主動外排基因acrA的相對表達量
在1/2 MIC培養基中培養菌株1,菌株1的MIC值始終沒有發生變化,但是acrA的表達量卻增加很大;菌株017的acrA表達量呈波浪式變化,總體趨勢是增加的;菌株035與94在耐藥性培養中雖然所測MIC有所增加,但其主動外排基因acrA的表達量卻呈遞減的趨勢;菌株040的acrA表達量先下降然后再急速上升;菌株T7主動外排基因acrA的表達量先減少,再增加,后又減少,變化幅度相當大;菌株048的acrA的表達量先減少后增加,菌株045的acrA基因表達量與菌株017的acrA基因表達量有點相似,也呈波浪式變化。從整體結果來看,除了菌株035和菌株94外,其它幾株菌株的acrA表達量均增加,說明大腸桿菌的耐藥性與主動外排基因acrA的表達量有相關性 。
3 討論與分析
普遍的觀點認為抗菌藥物的使用是病原菌產生耐藥性的關鍵所在。由于抗菌藥長期持續的不當使用,給細菌的生存環境造成了選擇性壓力,這種環境壓力因素可以通過多種機制導致病原菌對抗菌藥物產生耐藥性[7]。藥物外輸泵是一類位于細胞膜上的具有特殊結構的膜轉運蛋白質,其作用機理為當細胞內的藥物濃度聚集達到一定數值時,藥物外輸泵系統相關mRNA的表達增加,結果使細胞膜上外輸泵的數量增加,使細胞內的藥物被泵出,從而使細菌耐藥[10]。本試驗依據大腸桿菌的耐藥機理,將大腸桿菌在人工選擇性壓力環境下培養,以期大腸桿菌的MIC值發生變化。從實驗結果來看,除了菌株1的MIC值沒有發生變化,菌株11 對環丙沙星的耐藥性喪失,其它幾株大腸桿菌的MIC值變化2-8倍不等。MIC變化不一樣,可能不僅與藥物外輸泵有關,還與其它耐藥機制有關。
現已公認AcrAB-TolC是大腸埃希氏菌最主要的外輸泵,AcrAB-TolC包括藥物質子轉運子AcrB、周質融合蛋白AcrA和外膜通道蛋白TolC[8,11,15]。其中acrA基因的表達可造成大腸桿菌對多種藥物的耐藥性,因此,主動外排基因acrA表達量對大腸桿菌的耐藥性有著至關重要的作用。普遍認為大腸桿菌對環丙沙星的耐藥性與主動外排基因acrA的表達量呈正相關。但是此次的實驗結果卻不盡相同,菌株1的MIC值未發生變化,但acrA表達量增加了許多;菌株017和045均呈現波浪式變化,菌株035和94的MIC雖然都升高了,但acrA的表達量卻減少;其它幾株菌株的acrA表達量均增加。說明大腸桿菌acrA基因的表達量與MIC值有一定的相關性,但是也不一定呈正相關。對此種現象產生的原因,推測可能是由于不止一種外輸泵的激活,或是可能還有其他的耐藥機制的作用。因為細菌的耐藥有著多種而復雜的機制[9,13],或者外輸泵外排能力顯著提高。

