不同PPIs聯(lián)合莫沙必利、鋁碳酸鎂治療GERD合并食管裂孔疝的臨床療效觀察
李美榮,王曉偉,牛美娜,王海翠,朱雙雙
0 引言
胃食管反流病(Gastroesophageal reflux disease,GERD)是指胃內(nèi)容物反流進入食管、口腔或肺而引發(fā)的特異性癥狀和/或并發(fā)癥,為消化系統(tǒng)常見病,近年來我國患病率呈上升趨勢,部分地區(qū)已接近歐美國家[1]。GERD病因復(fù)雜,是多因素作用的結(jié)果。食管裂孔疝(Hiatal hernia,HH)是指膈肌薄弱和食管裂孔擴大而引發(fā)的腹腔內(nèi)臟器進入胸腔所致的病變。HH可減弱食管抗反流防御機制和酸清除能力,是 GERD發(fā)病及進展的重要影響因素[2]。研究表明,GERD合并HH與未合并HH的GERD相比,患者的反流、酸暴露癥狀更嚴(yán)重,發(fā)生食管狹窄、消化道潰瘍等并發(fā)癥的風(fēng)險更大[3]。質(zhì)子泵抑制劑(Proton pump inhibitors,PPIs)是治療GERD的首選藥物,2019共識意見[4]建議,對于難治性GERD,應(yīng)加大PPIs的用藥劑量,同時為了更好地控制癥狀及促進黏膜愈合,治療周期應(yīng)至少延長至8周。臨床實踐發(fā)現(xiàn),有些患者對部分PPIs的反應(yīng)性差,癥狀消除不明顯,復(fù)發(fā)率高,臨床療效不令人滿意。因此,如何選擇PPI 藥物以優(yōu)化 PPI 治療,是臨床研究的熱點之一。本研究擬通過觀察不同種類PPIs聯(lián)合胃腸動力藥莫沙必利、鋁碳酸鎂治療GERD合并HH的療效,為合理使用PPIs提供參考依據(jù)。
1 資料與方法
1.1 一般資料 選取2017年3月至 2019年8月我院120例GERD合并HH患者,所有患者均符合《新編食管病學(xué)》[5]中GERD及HH診斷標(biāo)準(zhǔn)。納入標(biāo)準(zhǔn):①24 h食管pH值監(jiān)測提示有病理性酸反流,與患者反酸、燒心等癥狀有關(guān);②高分辨率食管測壓顯示下食管括約肌壓力低于正常,抵御反流功能減弱;③胃鏡檢查發(fā)現(xiàn)HH,存在胸悶、咳嗽、哮喘等食管外癥狀;④檢查前1周內(nèi)停止使用抗酸藥及胃動力藥;⑤年齡18歲以上;⑥患者對檢查和治療的依從性高。排除標(biāo)準(zhǔn):①有嚴(yán)重心肺肝腎等疾病、消化系統(tǒng)器質(zhì)性病變、惡性腫瘤、凝血機制異常、腹部手術(shù)史;②近2周持續(xù)使用糖皮質(zhì)激素、鈣拮抗劑治療;③對所用藥物難以耐受;④妊娠期、哺乳期婦女。
將納入患者按照隨機數(shù)字表法分為研究組和對照組,各60例。研究組,男37例,女23例;年齡23~71歲,平均(46.98±17.26) 歲;病程3.5~7年,平均(6.45±1.38)年;類型包括滑動型49例、食管型7例、混合型2例、巨大型2例。對照組,男38例,女22例;年齡 22~70歲,平均(45.69±18.07)歲;病程4~8年,平均(6.27±1.29)年;類型包括滑動型51例,食管型5例,混合型3例,巨大型1例。兩組患者一般資料比較,差異無統(tǒng)計學(xué)意義(P>0.05)。
1.2 治療方法 所有患者治療期間以易消化、低刺激食物為主,適當(dāng)攝入高蛋白類食物,少食多餐,用餐后避免彎腰、平臥。對照組餐前口服蘭索拉唑腸溶片(汕頭鮀濱制藥廠,規(guī)格:15 mg/片,國藥準(zhǔn)字 H10980136),30 mg/次,1次/d;餐前口服枸櫞酸莫沙必利(商品名:瑞琪,江蘇豪森藥業(yè),規(guī)格:5 mg/片,批號:20171109) 5 mg,3次/d;同時口服鋁碳酸鎂咀嚼片(商品名:達喜,拜耳醫(yī)藥保健有限公司,規(guī)格:0.5 g/片,批號:20160310) 1 g,3次/d,餐后1 h嚼服。療程8周。研究組餐前口服埃索美拉唑鎂腸溶片(阿斯利康制藥公司,規(guī)格:20 mg/片,國藥準(zhǔn)字H20046380),40 mg/次,1次/d;同時口服枸櫞酸莫沙必利和鋁碳酸鎂。療程8周。
1.3 療效評定標(biāo)準(zhǔn) 根據(jù)內(nèi)鏡黏膜分級及臨床癥狀評分進行療效評定。內(nèi)鏡分級判斷標(biāo)準(zhǔn):黏膜正常為0 級;點條狀糜爛2 處以下為Ⅰa級;點條狀糜爛2 處或以上為Ⅰb 級;有條狀糜爛,融合率75%以下為Ⅱ級;糜爛呈全周性,融合率75%及以上為Ⅲ級[6]。根據(jù)反酸、燒心、胸痛等典型癥狀的嚴(yán)重程度及發(fā)生頻率進行臨床癥狀評分。無燒心、反酸、胸骨后不適等癥狀為0分;有輕微臨床癥狀,每月均發(fā)生為1分;有較明顯臨床癥狀,每周均發(fā)生為2分;有很明顯臨床癥狀,且每天均發(fā)生為3分[7]。臨床癥狀積分降低≥80%,內(nèi)鏡下黏膜正常或程度改善2級及以上為顯效;臨床癥狀積分降低50%~79%,內(nèi)鏡下黏膜正常或程度改善1級為有效;臨床癥狀積分降低<50%與內(nèi)鏡下黏膜均無改善甚至加重為無效[8]。
1.4 觀察指標(biāo)
1.4.1 酸反流及胃蛋白酶原Ⅰ(PepsinogenⅠ,PGⅠ) 采用pH 值監(jiān)測儀(荷蘭MMS公司)行食管24 h pH-阻抗監(jiān)測,指標(biāo)包括酸暴露時間和酸反流次數(shù)。分別于治療前后采用真空促凝管抽取患者空腹靜脈血,3 000 r/min 離心10 min,分離血清,待統(tǒng)一檢測。采用雙抗體夾心ELISA法檢測PGⅠ血清水平(試劑盒購自上海江萊生物科技有限公司)。
1.4.2 胃腸激素及一氧化氮 抽取兩組患者空腹靜脈血5 ml,離心,取上清,采用放射免疫法測定兩組治療前后胃動素(Motilin,MOT)、胃泌素(Gastrin,GAS)、血管活性腸肽(Vasoactive intestinal peptide,VIP)等胃腸激素水平,檢測試劑盒由上海史瑞可生物科技有限公司提供。血清一氧化氮(NO)水平檢測采用硝酸還原酶法,檢測試劑盒由上海彩佑實業(yè)有限公司提供。
1.4.3 藥物不良反應(yīng) 觀察記錄兩組患者治療期間不良反應(yīng)的發(fā)生情況。
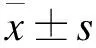
2 結(jié)果
2.1 兩組內(nèi)鏡黏膜分級比較 治療后,兩組患者內(nèi)鏡黏膜分級均有改善,研究組優(yōu)于對照組,差異有統(tǒng)計學(xué)意義(Z=4.19,P<0.05)。見表1。
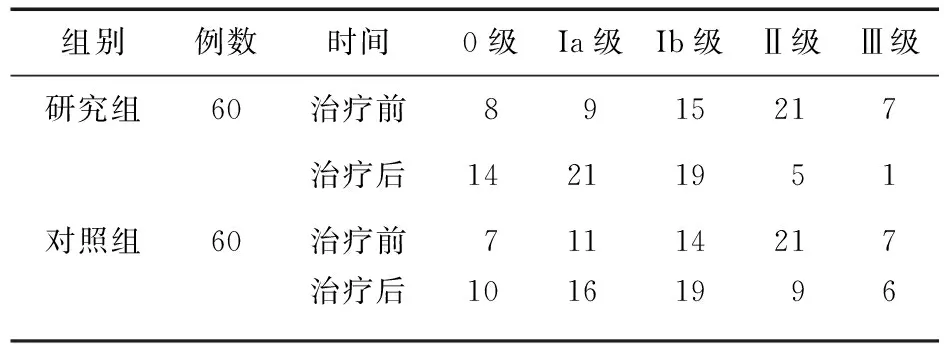
表1 兩組患者內(nèi)鏡黏膜分級比較(例)
2.2 兩組臨床癥狀評分比較 兩組治療后反酸、燒心、胸痛等評分下降(P<0.05),且研究組低于對照組(P<0.05)。見表2。
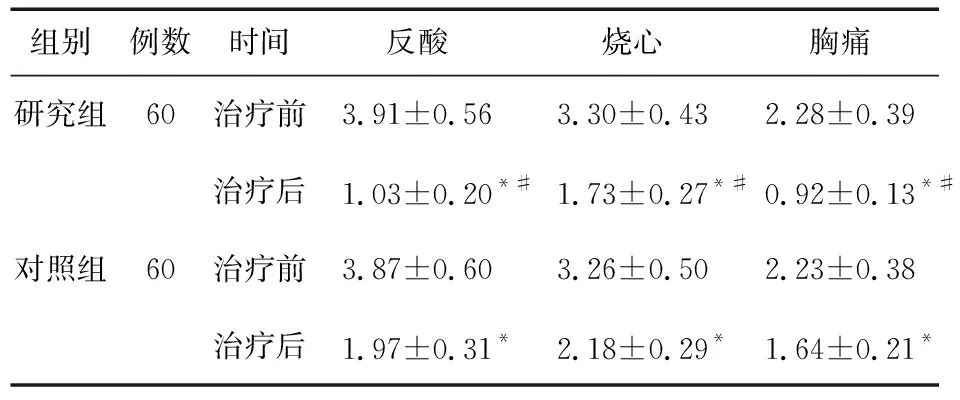
表2 兩組患者臨床癥狀評分比較(分)
2.3 兩組臨床療效比較 研究組總有效率高于對照組(91.67%vs.71.67%,P<0.05)。見表3。

表3 兩組患者臨床療效比較[例(%)]
2.4 兩組酸反流情況及PG血清濃度水平比較 治療后,兩組患者酸暴露時間、酸反流次數(shù)、PGⅠ水平均低于治療前(P<0.05),且研究組低于對照組(P<0.05)。見表4。
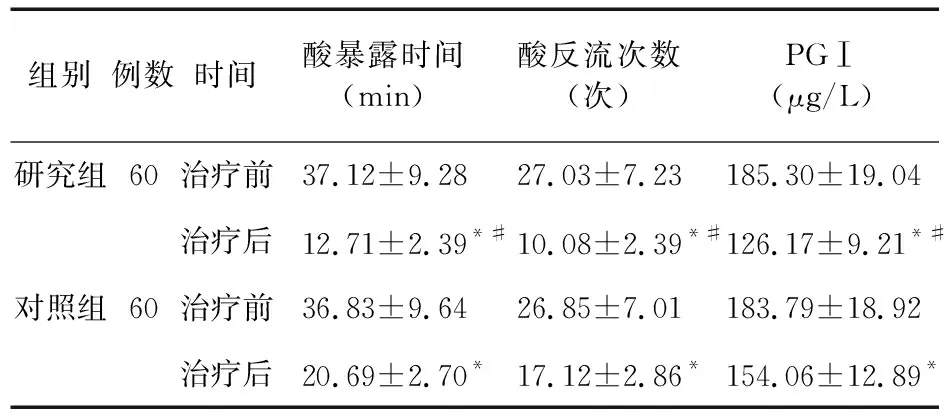
表4 兩組患者酸反流情況及PG血清濃度水平比較
2.5 兩組血清胃腸激素及NO濃度水平比較 治療后,兩組患者MOT、GAS水平增高,VIP、NO水平下降(P<0.05),且研究組MOT、GAS高于對照組(P<0.05),VIP、NO低于對照組(P<0.05)。見表5。
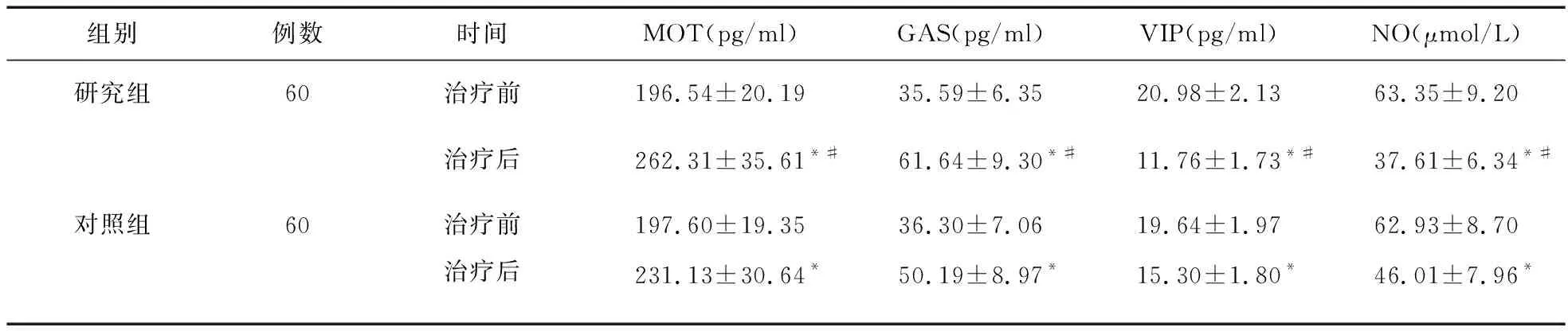
表5 兩組患者血清胃腸激素和NO水平比較
2.6 兩組藥物不良反應(yīng)比較 兩組治療期間均未出現(xiàn)嚴(yán)重不良反應(yīng),部分患者發(fā)生腹瀉、腹痛、乏力、惡心嘔吐等輕微不良反應(yīng),未影響治療。兩組不良反應(yīng)發(fā)生率差異無統(tǒng)計學(xué)意義(P>0.05)。見表6。

表6 兩組患者不良反應(yīng)比較[例(%)]
3 討論
近年來隨著工作生活壓力的增大和高脂飲食方式的改變,我國 GERD 患病率呈現(xiàn)逐年增長趨勢。抑酸分泌是治療GERD的主要方法,在食管黏膜愈合及反流癥狀控制方面,PPIs明顯優(yōu)于H2受體阻滯藥。
埃索美拉唑是近年研發(fā)的奧美拉唑的S-異構(gòu)體,其口服后1 h 即達血藥高峰,肝代謝率低,生物利用率高,對胃酸分泌的抑制作用增強。與蘭索拉唑、泮托拉唑、奧美拉唑等第一代PPIs相比,埃索美拉唑與CYP450 酶系統(tǒng)的親和力小,潛在藥物相互作用少,個體差異小。埃索美拉唑口服后,首過效應(yīng)少,生物利用度高,藥學(xué)效應(yīng)強于第一代PPIs。埃索美拉唑40 mg與奧美拉唑60~80 mg的抑酸強度相當(dāng)[9]。一項多中心隨機雙盲臨床試驗證實,埃索美拉唑?qū)p度GERD的療效與奧美拉唑相比,差異無統(tǒng)計學(xué)意義,但對于中重度GERD的療效更優(yōu)[10]。單純的抗酸療法無法顯著改善胃反流,故臨床上多以PPIs聯(lián)合促動力藥使用。促動力藥如莫沙必利能有效增加食管下括約肌壓力、加速胃排空、刺激食管蠕動以及增強食管對酸的清除力[11-12]。鋁碳酸鎂具有獨特的層狀結(jié)構(gòu),嚼服后能夠吸附于黏膜表面,直接中和胃酸,降低食管內(nèi)酸度;同時還能可逆性結(jié)合胃蛋白酶和膽汁酸,抑制卵磷脂激活,迅速緩解燒心癥狀,其抑酸作用優(yōu)于法莫替丁[13],是治療GERD的良好藥物。
HH可進一步加重GERD胃腸功能紊亂和臨床癥狀,為GERD的高危因素之一。2019版GERD外科診療共識[4]建議,對于合并HH的GERD患者,PPI劑量應(yīng)加倍。治療周期以8周為佳[14],研究顯示,療程8周可將療程4周的臨床癥狀緩解率及食管黏膜愈合率增加10%[15]。一項早期隨機雙盲臨床試驗顯示,對于1次/d、30 mg/次口服蘭索拉唑,燒心癥狀仍不能緩解的患者,改用埃索美拉唑40 mg/d口服,其燒心癥狀得到明顯改善,其臨床療效與雙倍劑量蘭索拉唑相當(dāng)[16]。本研究中,采用埃索美拉唑治療的研究組患者黏膜愈合、核心癥狀、酸反流等方面均明顯優(yōu)于對照組,分析原因可能為埃索美拉唑是近年新研發(fā)的PPIs,達血藥高峰時間更短、肝代謝率更低、生物利用率更高、抑制胃酸分泌的靶向作用更強。研究表明,埃索美拉唑單一劑量給藥即可使患者胃內(nèi)pH值大于4的時間達到12 h以上[17]。在用藥不良反應(yīng)方面,研究組不良反應(yīng)發(fā)生率略低于對照組,但差異無統(tǒng)計學(xué)意義(可能與樣本量有關(guān)),分析可能原因,埃索美拉唑作為一種新型的光學(xué)異構(gòu)體,其光學(xué)性質(zhì)更趨于穩(wěn)定[18],不良反應(yīng)更少,表明埃索美拉唑治療可使GERD合并HH患者獲益更大。一項有關(guān)PPIs在治療RE中的療效的網(wǎng)狀 Meta分析[19]結(jié)果也顯示,眾多PPIs中,埃索美拉唑與莫沙必利聯(lián)用治療RE的效果最好,尤其適宜于短期、大劑量應(yīng)用治療。
GERD是多種因子共同參與和作用的結(jié)果,在GERD的發(fā)病機制中,胃酸可促使PG轉(zhuǎn)化為胃蛋白酶,從而引發(fā)食管黏膜的病理改變,導(dǎo)致反流的相關(guān)癥狀[20-22]。PGⅠ是由胃主細胞分泌的,在提示反流癥狀方面比PGⅡ更敏感,其血清濃度能夠客觀反映患者的反流程度[23]。GAS可調(diào)節(jié)消化腺分泌、提高食管括約肌張力和增強胃腸蠕動[24-26];MOT具有促進胃蠕動和收縮食管括約肌的作用;而VIP有抑制胃蠕動、降低食管括約肌張力以及胃排空延緩的作用。NO作為一種重要的信使分子和炎癥介質(zhì),可激活鳥苷環(huán)化酶,增加環(huán)磷鳥苷生成,后者可使細胞內(nèi)鈣離子濃度降低,從而影響下食管括約肌功能;此外,NO還可與超氧化物反應(yīng)形成過氧化亞硝酸,破壞胃食管交界處上皮完整性,造成該處黏膜損傷[27]。研究證實,血清NO表達水平與GERD病情程度密切相關(guān)[28]。本研究中,兩組患者治療后MOT、GAS水平增高,PGⅠ、VIP、NO水平下降,且研究組優(yōu)于對照組,表明研究組治療方案在改善胃腸分泌、抑制胃酸、緩解炎癥等方面具有明顯優(yōu)勢,這可能是其療效增益的內(nèi)在機制之一。
綜上所述,與蘭索拉唑聯(lián)合莫沙必利、鋁碳酸鎂相比,埃索美拉唑聯(lián)合莫沙必利、鋁碳酸鎂治療GERD合并HH的療效更為顯著。

