基于影像組學與集成學習的腦膠質瘤分級預測
戴 宏, 符冉迪, 金 煒
基于影像組學與集成學習的腦膠質瘤分級預測
戴 宏, 符冉迪*, 金 煒
(寧波大學 信息科學與工程學院, 浙江 寧波 315211)
腦膠質瘤的術前分級對治療決策和預后評估至關重要. 為了提高分級精度, 提出了一種基于影像組學和集成學習的無創膠質瘤術前分級方法. 首先, 從不同序列的感興趣區域提取428個影像組學特征, 采用遞歸特征消除算法進行特征選擇, 采用6種不同的機器學習算法對腦膠質瘤進行分級, 并對各自的性能進行評估; 然后, 根據評估結果, 選取邏輯回歸、決策樹和多層感知機3種分類器作為腦膠質瘤分級預測的機器學習算法; 最后, 將3種分類器的輸出采用投票方式進行集成, 并評估硬投票機制與軟投票機制的性能. 實驗結果表明, 對于數據集BraTS2019, 基于硬投票機制的集成學習算法的性能較好, 受試者工作特性曲線下面積為0.933±0.031, 準確度為0.886±0.048, 敏感度為0.872±0.077, 特異度為0.905±0.105. 該方法不僅能增加膠質瘤分級模型的可解釋性, 而且可以提高分級精度.
腦膠質瘤分級; 影像組學; 遞歸特征消除; 集成學習
腦膠質瘤是人體腦部最為常見的一種惡性腫瘤, 約占中樞神經系統原發性腫瘤及其他腫瘤的24.7%, 占惡性腫瘤的74.6%[1]. 世界衛生組織將腦膠質瘤分為WHO-Ⅰ級至WHO-Ⅳ級, 其中WHO-Ⅰ級、WHO-Ⅱ級被稱為低級別膠質瘤(Low Grade Glioma, LGG), WHO-Ⅲ級、WHO-Ⅳ級被稱為高級別膠質瘤(High Grade Glioma, HGG)[2]. LGG生長速度較慢, 在進行手術切除后通常可以治愈; HGG生長迅速、侵襲性高、預后差, 患者在進行手術切除后仍有很高的病死率, 術后需要進行輔助化療和放療. 因此, 準確分級預測腦膠質瘤, 將有助于提供精確的治療方案, 優化患者的預后[3].
在腦膠質瘤分級預測研究中, 通常采用影像組學與機器學習方法[4]. 文獻[5]采用不同磁共振圖像(Magnetic Resonance Imaging, MRI)、不同機器學習模型來建立腦膠質瘤術前分級的影像組學模型, 比較分析了2種序列的MRI圖像在3種機器學習方法下的分級性能. 文獻[6]通過提取小波特征作為影像組學特征, 利用偏最小二乘法(Partial Least Squares, PLS)進行降維, 有效提高了腦膠質瘤的分級性能. 但這些研究中分級預測模型均采用單一序列的MRI圖像及單一的機器學習方法, 泛化性能不高, 導致膠質瘤的分級性能難以進一步提高.
本研究將集成學習思想引入腦膠質瘤術前的分級預測中, 通過提取多個序列下腦膠質瘤MRI圖像的影像組學特征, 采用遞歸特征消除(Recursive Feature Elimination, RFE)算法對多序列影像組學特征進行篩選, 選擇6種機器學習算法進行訓練和評估, 最后構建邏輯回歸(Logistic Regression, LR)、多層感知機(Multilayer Perceptron, MLP)和決策樹(Decision Trees, DT)3種分級預測算法的集成學習模型對腦膠質瘤術前進行分級預測, 以期提高腦膠質瘤的分級精度.
1 材料與方法
膠質瘤的分級主要包含: 圖像預處理、特征提取、特征選擇、模型訓練和測試4個步驟(圖1).

GLDM為灰度相關矩陣; GLCM為灰度共生矩陣; GLSZM為灰度區域大小矩陣; GLRLM為灰度游程矩陣; RFE為遞歸特征消除算法; LR為邏輯回歸; MLP為多層感知機; DT為決策樹; SVM為支持向量機; NB為樸素貝葉斯; KNN為K近鄰; AUC為受試者工作特性曲線下面積; ROC為受試者工作特性.
1.1 數據集
本研究的影像數據均來自MICCAI網站(http:// www.braintumorsegmentation.org)上BraTS2019數據集[7], 該數據集包含有334例病例, 其中高級別腦膠質瘤259例, 低級別腦膠質瘤75例. 每位患者均接受了4種MRI序列掃描, 即T1(T1 Weighted)、T1ce (T1 Weighted with Contrast Enhanced)、T2(T2 Weighted)和Flair(Fluid-Attenuated Inversion Recovery)序列, 4個序列的原始圖像和感興趣區域(Region of Interest, ROI)的圖像顯示如圖2所示.
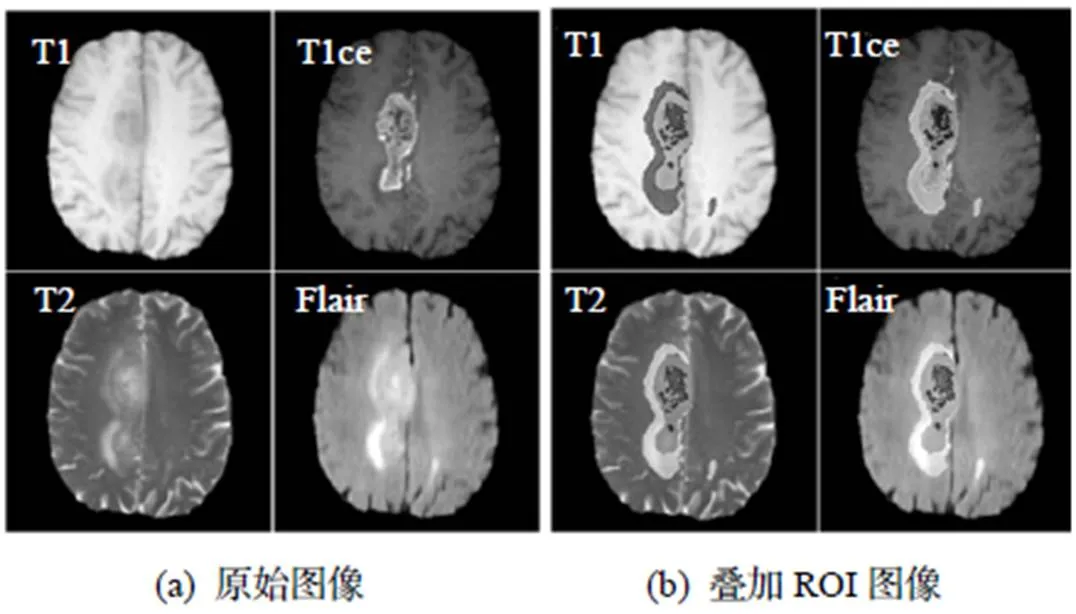
圖2 4個序列的原始圖像及疊加ROI圖像
將所有數據集內的膠質瘤圖像去除顱骨, 然后進行圖像配準, 并以1mm3的分辨率進行插值, 以確保4個序列下的圖像能嚴格匹配[8-9]. ROI由經驗豐富的神經影像科醫生手工分割而成, 包括壞死和非增強腫瘤核心(Necrosis and Non-enhancing Tumor, NCR/NET)、瘤周水腫(Peritumoral Edema, ED)、Gd增強的腫瘤部分(Gadolinium-enhancing Tumor, ET). 不同MRI序列對腦膠質瘤的表達能力有所區別. 在T2和Flair序列上, 壞死區和非增強腫瘤核心區域有高信號; 在T1ce序列, 利用一個閾值可以分割得到Gd增強的腫瘤部分; 瘤周水腫區域在T2序列能得到很好的檢測, 并在Flair序列下將其與血液部位進行區分.
1.2 影像組學特征提取
在不同MRI序列下, 高級別腦膠質瘤與低級別腦膠質瘤的影像學表現存在差異. 高級別腦膠質瘤的MRI信號明顯不均勻, 呈混雜T1/T2信號影, 周邊可見明顯的指狀水腫影, 增強掃描呈花環狀及結節樣異常強化影; 低級別腦膠質瘤的MRI信號相對均勻, 表現為長T1、長T2和Flair高信號, 一般無強化[10]. 通過多個MRI序列的影像組學特征進行腦膠質瘤分級的準確度高于單序列[11], 因此本研究提取了T1、T1ce、T2和Flair這4個序列下ROI的影像組學特征. 所有影像組學特征的提取均采用Python 3.7平臺下的Pyradiomics插件進行, 每個序列分別提取107個影像組學特征, 其中形狀特征14個、一階特征18個、灰度共生矩陣特征24個、灰度相關矩陣特征14個、灰度游程矩陣特征16個、灰度區域大小矩陣特征16個、相鄰灰度差分矩陣特征5個, 4個序列共提取了428個影像組學特征.
1.3 特征選擇
為了消除特征間數值差異過大所造成的影響, 首先對數據集進行標準化處理. 計算公式為:
由于訓練的樣本有限, 過多冗余和無關的特征會導致過擬合, 同時也降低了模型的可解釋性, 增加模型的訓練時間. 為了降低過擬合, 增加模型的可解釋性, 本研究利用RFE算法進行特征選擇. RFE是一種尋找最優特征集的貪心算法, 主要通過多輪訓練來搭建模型, 每輪訓練結束后, 消除對模型訓練結果影響小的若干特征, 再基于新的特征集進行篩選, 其代價函數為:


1.4 分類模型
對邏輯回歸、支持向量機(Support Vector Machines, SVM)、多層感知機網絡、隨機決策樹、近鄰((-nearest Neighbors, KNN)分類器和樸素貝葉斯(Naive Bayes, NB)分類器這6種常用的機器學習方法在膠質瘤分級中的性能進行比較. 將篩選后的數據集輸入不同的分類器中, 根據評估標準選出性能最好的3種分類器. 不同分類器對同一特征的敏感性不同, 充分考慮3種分類器的分類結果能夠更客觀、更穩定地反映特征性能.
基于選出的3種分類器, 提出一種基于投票機制的集成方法, 流程如圖3所示. 同時對2種不同的投票機制進行評價: 硬投票(基于多數票的投票)和軟投票(基于平均概率的投票). 將3種最佳分類器的分類結果提供給集成分類方法, 進而得到最終的分類結果.
1.4.1 機器學習方法
邏輯回歸[12]是常用的二元分類模型, 該模型通過假設輸出的因變量服從伯努利分布, 輸入自變量與輸出因變量之間存在線性關系. 利用Sigmoid函數處理非線性數據, 從而解決二分類問題.
支持向量機在醫學分類上應用廣泛. 該模型通過求解一個二次優化問題來建立數據集之間的最優分類邊界, 因此也被稱為大間距分類器[13]. 當使用不同的核函數時, 支持向量機會表現出不同的分類性能.
多層感知機是一種包含多個感知器的人工神經網絡[14], 該模型主要分為3層(輸入層、隱藏層和輸出層), 其中隱藏層的數目決定了網絡的復雜程度. 多層感知機通常應用于有監督學習算法中, 根據輸入輸出變量之間的相關性來學習模型.
隨機決策樹是一種流行的有監督算法[15], 該算法根據最大化數據分離的標準反復分割數據集, 從而形成樹狀結構. 最常用的標準是信息增益, 通過識別并選擇有助于分類的重要屬性, 最終達到分類的目的.
近鄰不同于其他分類算法, 該算法直接使用數據進行分類.近鄰中唯一可調整的參數是, 在訓練集中找到一組最接近測試樣本的個對象, 并基于該領域中特定類的流行程度來分配標簽. 為了獲得更好的性能, 需要選擇合適的值來訓練模型.

圖3 基于多數投票機制的集成方法在腦膠質瘤分級中應用流程
樸素貝葉斯是基于貝葉斯定理和最大后驗假設的分類模型. 該模型假設一個屬性對一個給定類的影響獨立于其他屬性, 被稱為“條件獨立”. 通過將最大概率分配給正確的類別, 從而達到分類的效果, 同時不需要準確的概率估計.
1.4.2 投票機制




1.5 模型評估
采用五折交叉驗證的方法進行模型訓練和測試. 根據真陽性(True Positive, TP)、真陰性(True Negative, TN)、假陽性(False Positive, FP)、假陰性(False Negative, FN)計算敏感度、特異度以及準 確度, 繪制受試者工作特性(Receiver Operating Characteristic, ROC)曲線, 并計算受試者工作特性曲線下面積(Area Under the Receiver Operating Characteristic Curve, AUC), 對不同分類器模型進行評估, 其計算公式分別為:



2 實驗結果
本研究所有方法都在Python3.7(https://www. python.org)、R3.6.0(http://www.Rproject.org)上實現. 采用Python軟件提取和篩選影像組學特征, 并建立分類模型; 采用R軟件進行統計分析. 所有實驗都在Windows10操作系統下進行(CPU為Intel Core i7-8700@3.20GHz, GPU為NVIDIA GeForce RTX 2080Ti, 內存為16GB).
2.1 特征選擇
利用遞歸特征消除算法, 從428個影像組學特征中提取15個特征, 其中包含一階特征6個、灰度相關矩陣1個、灰度區域大小矩陣6個、灰度共生矩陣2個, 具體提取特征見表1.

表1 RFE算法所選擇的特征
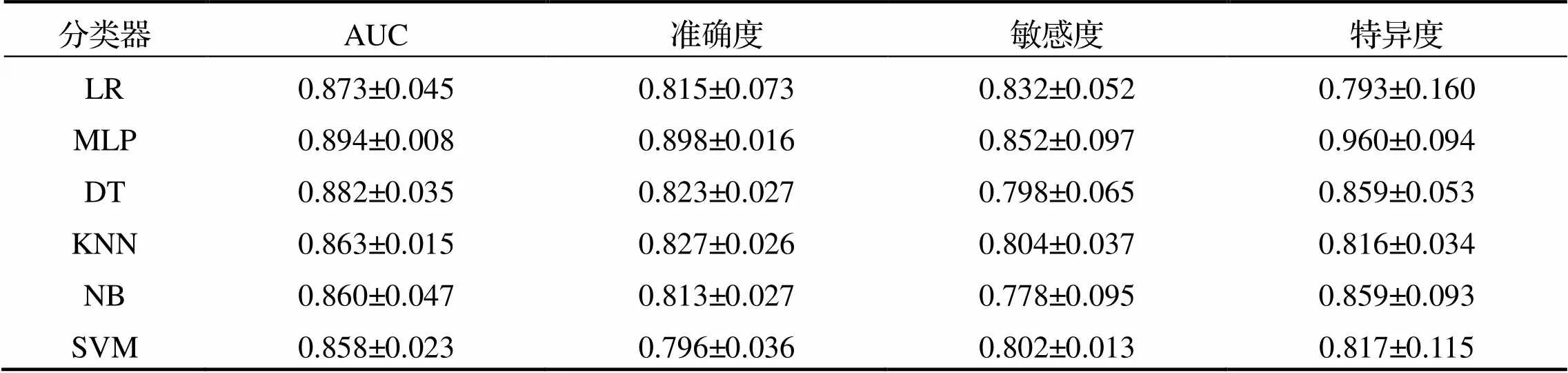
表2 各種機器學習算法的分級性能
2.2 性能比較
將篩選后的最優數據集輸入各種分類器中, 并利用五折交叉驗證的方法進行模型訓練和評估. 6種分類器的平均分級性能見表2.
從表2可以看出, MLP有著最高的分級性能, 其AUC為0.894±0.008, 精確度為0.898±0.016, 敏感度為0.852±0.097, 特異度為0.960±0.094. DT和LR的分級性能也較好, 其中DT的AUC為0.882± 0.035; 而LR的AUC為0.873±0.045. 相比之下, KNN、NB以及SVM這3種分類器的分級性能相對較低, AUC分別為0.863±0.015、0.860±0.047和0.858±0.023.
對各種分類器結果進行分析, 根據AUC選出3種最佳分類器, 即邏輯回歸、多層感知機以及決策樹, 將這3種分類器的輸出結果傳遞給不同的投票機制來預測最終的輸出(圖4). 圖4分別給出了邏輯回歸、多層感知機和決策樹在五折交叉驗證下的ROC曲線.
表3為集成學習中基于2種投票機制的結果. 從表3可知, 通過對3種分類器進行集成學習, 膠質瘤的分級性能得到了明顯提高.其中, 硬投票中基于多數的投票機制相比于其他投票機制有更好的分級性能.

圖中灰度區域為與平均ROC距離一個標準差的范圍.
表3中的性能評估都是五折交叉驗證后的結果, 基于硬投票的集成學習方法有著最高的分級性能: AUC為0.933±0.031, 精確度為0.886±0.048,敏感度為0.872±0.077, 特異度為0.905±0.105. ROC曲線如圖5所示.

表3 2種投票機制的分級性能

圖中灰度區域為與平均ROC距離一個標準差的范圍.
將本文研究方法與其他優秀預測方法進行對比, 文獻[16]建立了4個放射學特征數據集, 并采用最大熵判別決策樹模型來完成對腦膠質瘤的分級. 該方法在BraTS2017數據集上進行了驗證, 其AUC為0.818, 敏感度為0.878, 特異度為0.814. 文獻[17]提出了一個帶有門控、多模態單元融合的三維卷積神經網絡(3-Dimensional Convolutional Neural Network, 3DCNN)模型, 以融合多模態信息和決策信息, 并在BraTS2015數據集上進行了模型的驗證.本文提出的方法與文獻[16-17]提出的方法的分類性能比較結果見表4.
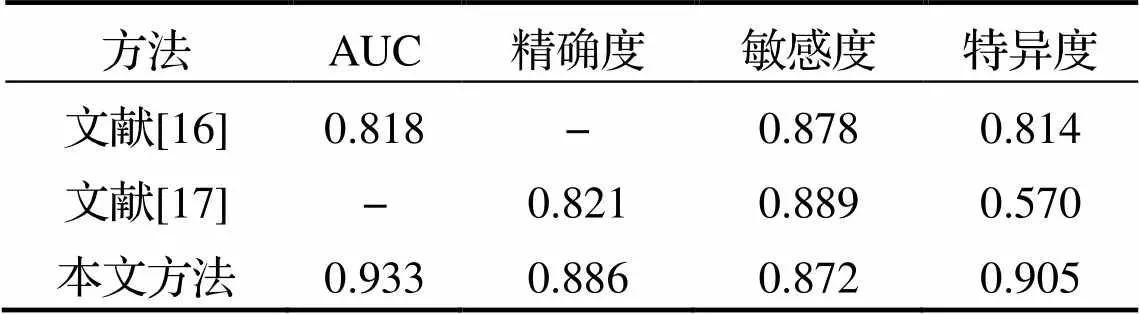
表4 本文方法與其他文獻方法性能比較
注: “-”表示文獻中未提及.
從表4可知, 本文所提出的腦膠質瘤分級預測方法的性能優于文獻[16]和文獻[17]中提出的分級方法.
3 結語
本文提出了一種新的基于影像組學與集成學習的腦膠質瘤分級方法, 通過提取4個不同序列的膠質瘤MRI圖像的影像組學特征, 利用RFE進行特征選擇, 并利用邏輯回歸、支持向量機、多層感知機、決策樹、樸素貝葉斯、近鄰分類器進行膠質瘤分級. 評估這6種分類器的不同性能指標, 即AUC、準確度、敏感度和特異度. 然后選出AUC評分最高的3種分類器, 提出一種基于投票機制的集成方法, 并評估了硬投票機制與軟投票機制的性能. 研究結果表明, 本文提出的基于多數投票機制的集成學習方法有著較高的分級性能, 其結果優于其他投票機制的集成方法, 并遠遠高于單種分類器的分級性能.
[1] Ostrom Q, Cioffi G, Gittleman H, et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016[J]. Neuro-Oncology, 2019, 21(S5):v1-v100.
[2] Wesseling P, Capper D. WHO 2016 classification of gliomas[J]. Neuropathology and Applied Neurobiology, 2018, 44(2):139-150.
[3] Zacharaki E I, Wang S M, Chawla S, et al. Classification of brain tumor type and grade using MRI texture and shape in a machine learning scheme[J]. Magnetic Resonance in Medicine, 2009, 62(6):1609-1618.
[4] 韓文靜, 胡貴祥, 胡玲靜. 影像組學在腦膠質瘤中的研究進展[J]. 國際醫學放射學雜志, 2020, 43(2):183-187.
[5] 穆建華, 張雁偉, 吳志鋼. 基于常規MRI圖像的不同影像組學模型在腦膠質瘤術前分級中的應用[J]. 磁共振成像, 2020, 11(1):55-59.
[6] Chen Q J, Wang L H, Wang L, et al. Glioma grade prediction using wavelet scattering-based radiomics[J]. IEEE Access, 2020, 8:106564-106575.
[7] Menze B H, Jakab A, Bauer S, et al. The multimodal brain tumor image segmentation benchmark (BRATS)[J]. IEEE Transactions on Medical Imaging, 2015, 34(10): 1993-2024.
[8] Bakas S, Akbari H, Sotiras A, et al. Advancing the cancer genome atlas glioma MRI collections with expert segmentation labels and radiomic features[J]. Scientific Data, 2017, 4:170117.
[9] Clark K, Vendt B, Smith K, et al. The cancer imaging archive (TCIA): Maintaining and operating a public information repository[J]. Journal of Digital Imaging, 2013, 26(6):1045-1057.
[10] 國家衛生健康委員會醫政醫管局. 腦膠質瘤診療規范(2018年版)[J]. 中華神經外科雜志, 2019, 35(3):217- 239.
[11] Qin J B, Liu Z Y, Zhang H, et al. Grading of gliomas by using radiomic features on multiple magnetic resonance imaging (MRI) sequences[J]. Medical Science Monitor, 2017, 23:2168-2178.
[12] Landwehr N, Hall M, Frank E. Logistic model trees[J]. Machine Learning, 2005, 59(1/2):161-205.
[13] Nello C. An Introduction to Support Vector Machines and Other Kernel-based Learning Methods[M]. Cambridge: Cambridge University Press, 2000.
[14] Pal S K, Mitra S. Multilayer perceptron, fuzzy sets, and classification[J]. IEEE Transactions on Neural Networks, 1992, 3(5):683-697.
[15] Leo B. Classification and Regression Trees[M]. Belmont, CA: Wadsworth Publishing Company, 1984.
[16] Wu Y P, Hao H H, Li J, et al. Four-sequence maximum entropy discrimination algorithm for glioma grading[J]. IEEE Access, 2019, 7:52246-52256.
[17] Ye F Y, Pu J, Wang J, et al. Glioma grading based on 3D multimodal convolutional neural network and privileged learning[C]//2017 IEEE International Conference on Bioinformatics and Biomedicine (BIBM), Kansas City, MO, USA, 2017:759-763.
Glioma grading prediction based on radiomics and ensemble learning
DAI Hong, FU Randi*, JIN Wei
( Faculty of Electrical Engineering and Computer Science, Ningbo University, Ningbo 315211, China )
Glioma grading before surgery is very critical for the treatment planning and prognosis. In order to improve the grading accuracy, a non-invasive method for predicting the glioma grades based on radiomics and ensemble learning is proposed. First, 428 radiomics features are obtained from the region of interest (ROI) with different sequences. Feature selection is executed using Recursive Feature Elimination (RFE) algorithm, and 6 different machine learning algorithms are used to predict the glioma grade. Then, according to the evaluation results, three best classifiers, that is, Logistic Regression (LR), Decision Tree (DT) and Multilayer Perceptron (MLP), are selected as the machine learning algorithm for Glioma grading. Finally, these three classifiers are used for ensemble classification with a voting mechanism. The performance of hard and soft voting mechanism is also evaluated. Experimental results show that on the dataset BraTS2019, the hard voting mechanism based ensemble learning algorithm achieved the best performance, with the AUC value of 0.933±0.031, the accuracy of 0.886±0.048, the sensitivity of 0.872±0.077, and the specificity of 0.905±0.105. The presented work not only increases the interpretability of glioma grading model, but also ameliorates the grading accuracy.
glioma grading; radiomics; recursive feature elimination; ensemble learning
TP391
A
1001-5132(2021)04-0028-07
2020?10?10.
寧波大學學報(理工版)網址: http://journallg.nbu.edu.cn/
浙江省自然科學基金(LY20H180003);寧波市自然科學基金(T2019A610104); 寧波市公益類科技計劃項目(202002N3104).
戴宏(1997-), 男, 江西上饒人, 在讀碩士研究生, 主要研究方向: 醫學影像. E-mail: 1356913744@qq.com
符冉迪(1971-), 男, 浙江寧波人, 副教授, 主要研究方向: 數字圖像處理. E-mail: furandi_nbu@163.com
(責任編輯 史小麗)

