1型糖尿病患者視網膜病變的危險因素分析
鄧嘉進,葉靜文
0引言
糖尿病視網膜病變(diabetic retinopathy,DR)屬于糖尿病微血管病變的一種,是1型糖尿病(type 1 diabetes mellitus,T1DM)人群視力障礙和失明的主要原因,并給患者和社會帶來沉重的經濟負擔。確定T1DM視網膜病變發展的影響因素對于降低該并發癥的發生率至關重要。其中增殖期糖尿病視網膜病變(proliferative diabetic retinopathy,PDR)更有可能導致嚴重的視力障礙[1],所以分析其發病風險因素尤為重要。目前國內關于T1DM視網膜病變的影響因素鮮有報道。本研究回顧性分析T1DM患者視網膜病變的臨床資料,對影響DR的相關危險因素進行分析。
1對象和方法
1.1對象選取2010-01/2020-10于南方醫科大學附屬南海醫院就診的T1DM患者204例。納入對象為隨機抽樣樣本,T1DM的診斷依據為1999年WHO的診斷標準。DR確診按照國際臨床分類法。如果有不對稱的視網膜病變,則使用情況較差的眼睛進行分類。排除標準:(1)晶狀體混濁無法進行眼底檢查;(2)存在非糖尿病引起的眼底病變;(3)在納入研究前的3a內沒有行眼底檢查和代謝指標評估的患者。本研究經醫學倫理委員會批準。檢查項目均經過患者同意,并簽署知情同意書。
1.2方法根據住院或門診記錄采集患者吸煙史,是否合并高血壓、高脂血癥、糖尿病腎病(diabetic nephropathy,DN)及糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)等信息。收集身高、體質量、血壓等數據;統計降壓藥、降脂藥等可能會影響糖尿病血管并發癥風險的藥物使用情況。使用全自動生化儀測定患者空腹血清總膽固醇(TC)、低密度脂蛋白(LDL)、甘油三酯(TG)、高密度脂蛋白(HDL)、肌酐(Cr)、尿酸(UA)。利用高壓液相色譜法測定糖化血紅蛋白(HbA1c)。體質量指數(BMI)=體質量(kg)/身高2(m2)。使用中國人MDRD公式:175×(SCr)-1.234×年齡-0.179×0.79(女性)估算腎小球濾過率(eGFR)。眼底檢查:所有患者均予復方托吡卡胺滴眼液散瞳,15min滴1次,共4次,經充分散瞳后行裂隙燈下眼底鏡檢查眼底。非增殖期糖尿病視網膜病變(non-proliferative diabetic retinopathy,NPDR)包括微血管瘤、硬性滲出、點片狀出血及棉絨斑;PDR包括新生血管形成、玻璃體纖維化及視網膜脫離。根據視網膜表現將所有患者分為DR組和無DR組,其中DR組包括NPDR組和PDR組。
2結果
2.1患者的一般情況納入研究的204例患者中男113例(55.4%),女91例(44.6%);發病年齡6~46(平均26±15.3)歲;病程6~27(平均17.3±7.4)a。無DR組133例(65.2%),DR組71例(34.8%);DR組包括NPDR組48例(23.5%)、PDR組23例(11.3%)。
2.2 DR/PDR影響因素的單因素分析DR組與無DR組患者相比,糖尿病發病年齡更晚,病程更長、HbA1c更高,更容易合并高血壓、高脂血癥、DN、DPN,eGFR更低(P<0.05)。在DR患者中,PDR組與NPDR組相比,糖尿病病程更長,BMI、收縮壓(SBP)更高,更容易合并高脂血癥、DN、DPN(P<0.05)。用藥情況方面,更多的DR患者需使用降壓及降脂藥物治療(P<0.05)。患者的性別、是否吸煙、舒張壓(DBP)、血脂、UA與DR無關(均P>0.05),見表1。
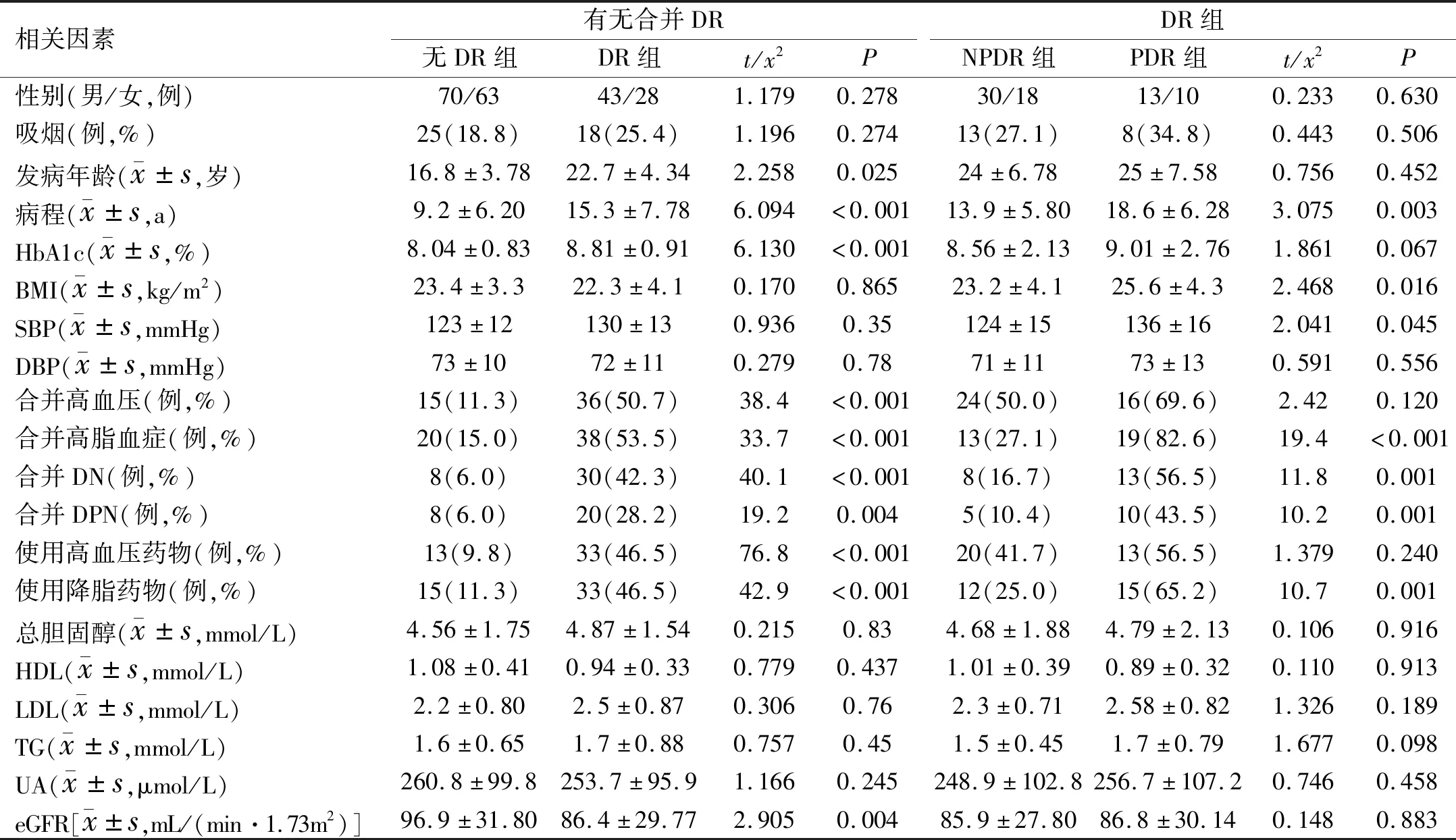
表1 單因素分析DR/PDR發生的影響因素
2.3 DR/PDR影響因素的多因素分析多因素Logistic回歸分析顯示,糖尿病病程、HbA1c是DR的危險因素(表2),糖尿病病程、DN是PDR的危險因素(表3)。

表2 Logistic回歸分析T1DM患者發生DR的危險因素

表3 Logistic回歸分析T1DM患者發生PDR的危險因素
2.4 ROC曲線的繪制病程和HbA1c在預測DR發生的AUC分別為0.720、0.727,95%CI分別為0.645~0.794,0.656~0.799。以病程取15.1a作為截斷值,預測DR的敏感性為50.7%,特異性為86.5%。以HbA1c取8.2%作為截斷值,預測DR的敏感性為76.1%,特異性為59.4%,見圖1,表4。病程在預測PDR發生的AUC為0.713,95%CI為0.581~0.844;以病程取18.5a作為截斷值,預測PDR的敏感性為73.9%,特異性為60.4%,見圖2,表5。
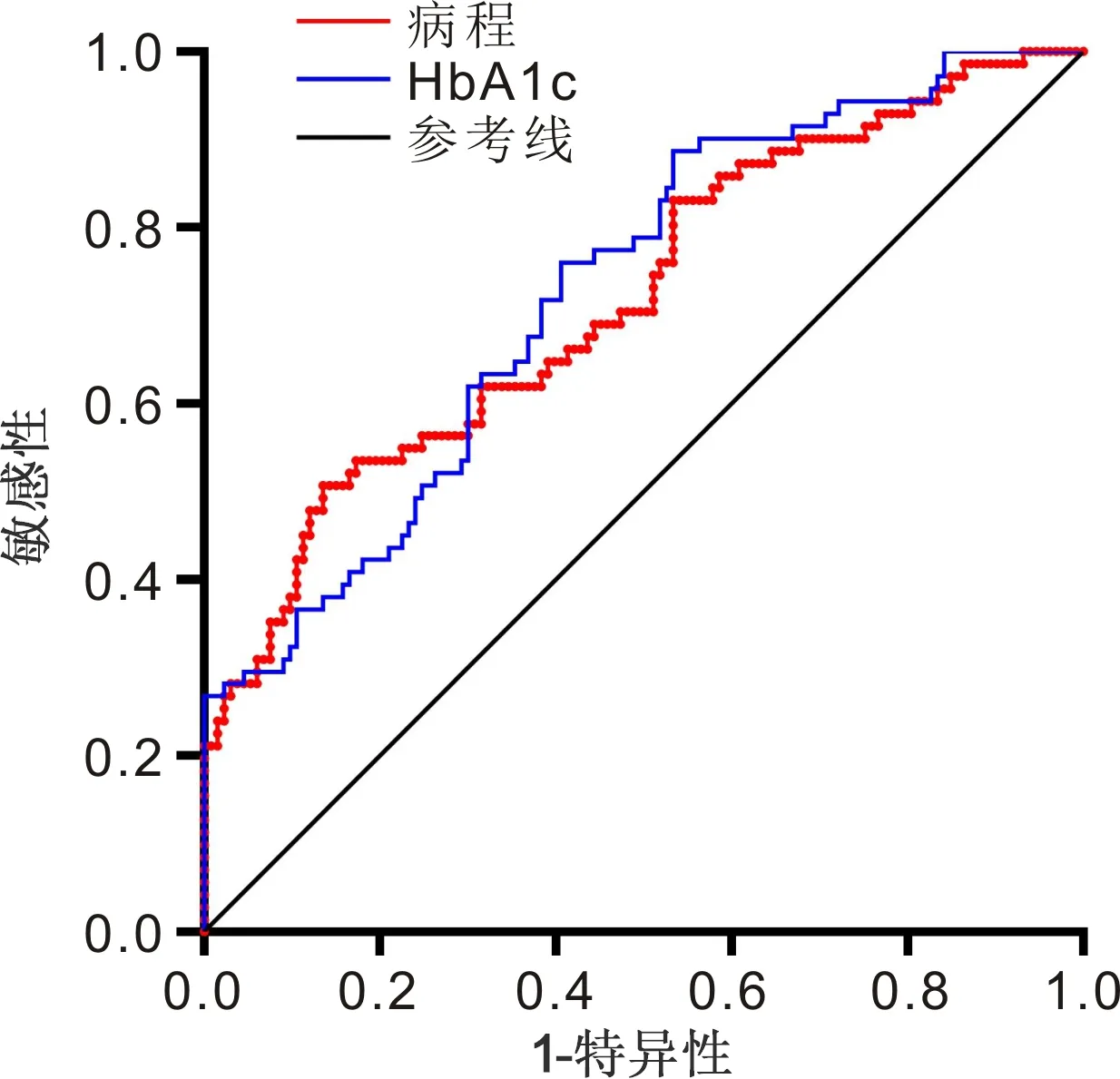
圖1 病程和HbA1c預測T1DM患者發生DR的ROC曲線。
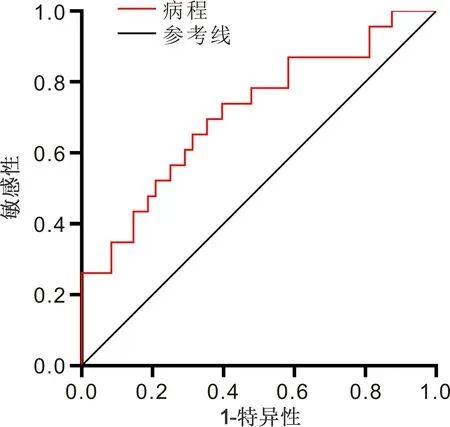
圖2 病程預測T1DM患者發生PDR的ROC曲線。
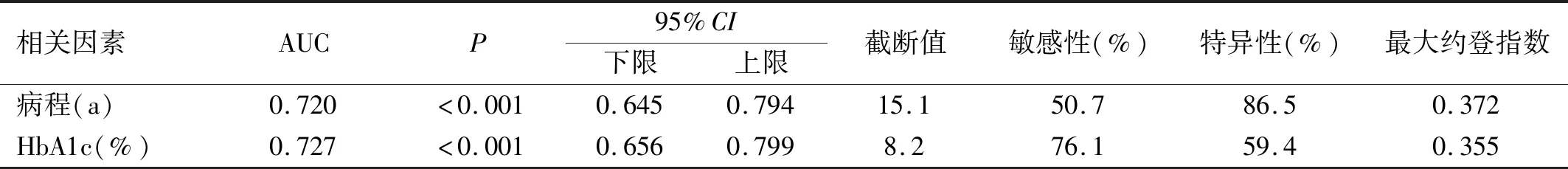
表4 病程和HbA1c預測T1DM患者發生DR的ROC曲線分析結果

表5 病程預測T1DM患者發生PDR的ROC曲線分析結果
3討論
DR是T1DM患者主要并發癥之一,它分為NPDR和PDR。NPDR代表視網膜脫離的早期階段,因血管通透性增加和毛細血管閉塞導致微動脈瘤、出血和硬性滲出。PDR是糖尿病視網膜病變的一個更晚期階段,其特征是新生血管形成。在此階段,當新的異常血管出血進入玻璃體(玻璃體出血)或出現牽引性視網膜脫離時,患者可能會出現嚴重的視力障礙[2]。發病年齡被認為是T1DM視網膜病變發展的一個重要危險因素[3-4],但不同年齡段發病與DR的關系尚有爭議。本研究提示DR患者較無DR患者T1DM的發病年齡大,相似地,Forga等[5]研究了從兒童期到中年期不同年齡段發病的T1DM患者,發現年齡較大的患者DR的發生率較高。另外有研究[3]提示,≤5歲發病的T1DM患者DR出現時間相對于其他年齡段較晚。這可能是因為“保護因子”發生在青春期開始之前[6]。
目前糖尿病病程和血糖控制為影響TIDM患者發生DR的公認因素。本研究提示糖尿病病程與DR/PDR發生呈正相關,校正了其他影響因素后,糖尿病病程仍是T1DM患者發生DR/PDR的影響因子,與既往研究結果相似[7-11]。威斯康星糖尿病視網膜病變流行病學研究(WESDR)提示DR的25a累積進展率為83%,發展為PDR的進展率為42%[7]。本研究ROC曲線分析提示病程預測DR和PDR的AUC分別為0.720、0.713,截斷值分別為15.1、18.5a,敏感性分別為50.7%、73.9%,特異性分別為86.5%、60.4%,提示病程與DR的發生及嚴重程度相關。
HbA1c反映患者近2~3mo血糖平均水平,是評價患者血糖控制的指標。多項研究[3,7,10,12]證實,HbA1c升高與T1DM患者DR發生有關。本研究提示HbA1c是DR發生的影響因子;ROC曲線分析提示HbA1c的AUC為0.727;以HbA1c 8.2%作為截斷值,預測DR的敏感性為76.1%,特異性為59.4%,提示HbA1c大于8.2%的T1DM患者可能發生DR的危險性更大。另外,有研究[13]提示,長期HbA1c低于6.5%的患者發生視網膜病變的時間明顯晚于HbA1c高于6.5%的患者。高血糖在視網膜微血管損傷的發病機制中起重要作用,包括多元醇通路、晚期糖基化終末產物堆積、蛋白激酶C(PKC)途徑和己糖胺通路等多種代謝途徑,與血管損傷有關[14]。強化降糖治療可減少T1DM患者DR的發生[15],因此近年來隨著胰島素強化降糖治療的普及,DR的發病率和進展率總體有所下降[10]。
以往的流行病學研究提示高血壓是DR的危險因素[7,10]。本研究中,合并高血壓的患者DR發病率更高,其中PDR患者SBP明顯升高。然而,目前通過治療高血壓來降低DR風險的證據不足。有研究[16]提示,強化降壓治療可在一定程度降低DR的發病率,但并不能降低DR進展的風險。
在脂代謝方面,我們的研究提示DR組與無DR組患者相比、PDR組與NPDR組相比,更容易合并高脂血癥,但因患者已使用降脂藥物,所以各組間血脂水平無明顯統計學差異。盡管在許多其他研究中,血脂與DR的關系并不一致[10,17-18],但已有研究表明,視網膜毛細血管中的低密度脂蛋白外滲及其隨后的氧化反應可能與DR的發生和發展有關[19]。既往研究[20-21]提示,視網膜硬性滲出物、DR的組成部分,以及隨后的視力惡化與總膽固醇和低密度脂蛋白膽固醇密切相關。
本研究提示,DN與DR/PDR相關,DN為PDR的影響因子,與既往研究結果相似[7,17]。有研究[10]提示,尿白蛋白排泄率增加為PDR的危險因素。我們認為DN與DR相關的原因為DN和DR同屬于糖尿病微血管病變,發病機制類似。
我們的研究提示DR組患者eGFR降低,可能與該組患者與無DR組患者相比發病年齡相對較大、糖尿病病程較長導致入組時年齡相對較大有關。另外我們的研究提示吸煙與DR無關;校正了其他影響因素后,DPN也與DR無關。
目前關于T1DM視網膜病變危險因素的研究數據主要來自于高加索人群[22],而我國尚缺乏類似研究。本研究具有一定局限性,包括:(1)樣本量較小;(2)這是一個橫斷面研究;(3)這項研究的對象為單中心的同質人群,因此不能將結果推廣到其他人群。可能需要多中心、大樣本及較長時間的隨訪研究來闡明T1DM患者發生DR的影響因素。
綜上所述,T1DM患者視網膜病變與糖尿病發病年齡較晚有關。糖尿病病程和高血糖是DR的主要影響因素。HbA1c與DR的發生相關,DN與PDR的發生相關。建議對T1DM患者進行多因素管理。

