經(jīng)皮微波消融治療中晚期肝癌的療效觀察
李廣俊 蔡 日 游 焜
原發(fā)性肝癌是臨床常見的惡性腫瘤,預后較差,目前僅有約15%的肝癌可通過肝切除、肝移植等手術(shù)方式獲得較高的生存率,多數(shù)患者無明顯手術(shù)適應證,尋找有效非手術(shù)治療方式成為臨床研究的重點及難點。目前,臨床上對于不可切除中晚期肝癌患者的治療方法有經(jīng)肝動脈化療栓塞術(shù)(transhepatic artery chemoembolization,TACE)、經(jīng)皮微波消融治療(percutaneous microwave ablation therapy,PMCT)、射頻消融、放療等。TACE曾被認為是不可切除肝癌患者最有效的姑息治療方法,但腫瘤完全壞死率不高,遠期預后仍較差。PMCT近年來被廣泛用于癌癥治療,通過微波消融引起腫瘤細胞凝固性壞死,達到治療疾病的目的,但其在腫瘤臨近肝門、膽囊等其他重要臟器的病例治療中存在較大的風險。目前,已有部分研究探討了TACE聯(lián)合PMCT治療中晚期肝癌的效果及安全性,但其對機體應激反應、肝功能的影響研究較少,且二者聯(lián)合治療對生存期的影響仍有待多個中心、更大樣本的研究來驗證。本研究以中晚期肝癌患者作為研究對象,探討TACE聯(lián)合PMCT的治療效果,為臨床制定針對性治療方案提供參考。
1 資料與方法
1.1 一般資料 選擇2016年2月至2017年12月新鄉(xiāng)醫(yī)學院第一附屬醫(yī)院收治的152例中晚期肝癌患者作為研究對象。納入標準:經(jīng)B超、CT、實驗室指標及病理檢查確診為原發(fā)性肝癌;肝內(nèi)病灶<4個,單個病灶直徑3~7 cm或多個病灶直徑總和<10 cm;Child-Pugh分級為A級、B級;臨床資料完整,對本研究知情并簽署同意書。排除標準:存在嚴重心、肺功能疾病者;術(shù)前存在未加以控制的黃疸、腹水者;有TACE、PMCT、放療禁忌證者;影像學資料提示存在門靜脈主干侵犯、肝動脈-靜脈瘺、病灶靠近膽囊及胃腸等重要組織器官者。
前瞻性研究,采用考慮患者意愿的部分隨機分組方法,將患者分為觀察組及對照組,觀察組與對照組分別有2例和1例脫失患者,不影響最終療效對比分析。觀察組及對照組分別納入74、75例。兩組患者性別、年齡、身體質(zhì)量指數(shù)(body mass index,BMI)、吸煙飲酒史、合并癥、病灶個數(shù)、病灶大小、Child-Pugh分級、巴塞羅那肝癌分期(barcelona-clinic liver cancer,BCLC)等差異均無統(tǒng)計學意義(P
>0.05)。見表1。
表1 兩組患者一般資料比較
1.2 方法 對照組單純進行TACE治療,觀察組進行TACE聯(lián)合PMCT治療,兩組患者均由同一組手術(shù)醫(yī)師進行操作,在術(shù)前DSA及CT檢查、閱片也均為同一組醫(yī)師,診斷及評估標準一致。
TACE:采用Seldinger技術(shù)進行經(jīng)皮右股動脈穿刺,DSA直視下進行腹主動脈、腸系膜動脈造影,必要情況下進行膈動脈造影、門靜脈造影;明確腫瘤供血動脈后將導管置入動脈,注入鹽酸表柔比星或吡柔比星、絲裂霉素、氟尿嘧啶注射液、超液態(tài)碘油的混合乳化物,上述化療藥物劑量的選擇根據(jù)患者年齡、BMI、心肝肺腎等器官功能、疾病進展程度等資料個體化調(diào)整,栓塞劑用量根據(jù)腫瘤大小、位置、血供及剩余肝功能情況確定;注射完畢后進行DSA造影,確定栓塞效果及肝動脈分支血流,首次栓塞效果不佳者可酌情增加治療次數(shù);術(shù)后穿刺點壓迫止血,加壓包扎;治療結(jié)束后給予止痛、止吐、保肝及營養(yǎng)支持治療。
PMCT:射頻儀采用美國Tyko公司生產(chǎn)的Radinics Cooltip TM systerm,單束或集束射頻針。觀察組在TACE術(shù)后7 d內(nèi)進行治療,以1%利多卡因局部浸潤麻醉,在CT或B超引導下將電極針插入病灶,注意避開膽囊、胃腸道、大血管等。瘤體直徑3~5 cm的病灶在瘤體中央進針,>5 cm的病灶根據(jù)形狀進行多點重疊消融,調(diào)整輸出頻率為70 W,設定消融時間,一般10~15 min。在病灶消融結(jié)束后退針到瘤體淺層進行消融治療,避免針道種植。穿刺點壓迫止血,腹部加壓包扎,術(shù)后24 h監(jiān)測患者生命體征,治療結(jié)束后,給予止吐、保肝及營養(yǎng)支持治療。
1.3 觀察指標及療效評估 生化指標:①肝功能,于術(shù)前及治療結(jié)束后1周時采集外周靜脈血,主要檢測總膽紅素(total bilirubin,TBIL)、丙氨酸氨基轉(zhuǎn)移酶(alanine aminotransferase,ALT)、天冬氨酸轉(zhuǎn)移酶(aspartate transferase,AST)水平。②應激相關指標,于術(shù)前及術(shù)后1周采集外周靜脈血,測定血清丙二醛(malondialdehyde,MDA)、還原型谷胱甘肽(reduced glutathione,GSH)、腫瘤壞死因子(tumor necrosis factor,TNF-α)、C反應蛋白(C-reactive protein,CRP)水平。③測定手術(shù)前后甲胎蛋白(alpha-fetoprotein,AFP)水平。
近期療效評價:于治療結(jié)束后1個月時采用實體瘤療效評價標準進行療效評估。完全緩解(complete remission,CR):腫瘤完全消失,消失時間持續(xù)超過1個月;部分緩解(partial remission,PR):病灶長徑總和縮小≥30%;疾病進展(progressive disease,PD):病灶長徑總和增加≥20%或出現(xiàn)新的病灶;穩(wěn)定(stable disease,SD):病灶長徑總和縮小,但不及30%或增加不及20%。有效緩解率=(CR例數(shù)+PR例數(shù))/總例數(shù)×100%。
隨訪統(tǒng)計生存情況:對患者進行術(shù)后隨訪,起點為患者首次進行TACE治療的時間,采用電話、門診復診方式進行隨訪,統(tǒng)計12、24個月的生存情況。
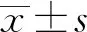
2 結(jié)果
2.1 兩組患者治療情況、療效及不良反應情況 兩組患者治療過程中均未出現(xiàn)肝衰竭、脾壞死、膽囊壞死、腹腔出血等嚴重并發(fā)癥,TACE術(shù)后常見發(fā)熱、肝區(qū)疼痛、腹脹等癥狀,經(jīng)保肝、鎮(zhèn)痛等處理均得到緩解;微波消融術(shù)后部分患者主述局部燒灼,但多數(shù)患者耐受,另外部分出現(xiàn)發(fā)熱、腹痛,在進行保肝及對癥處理后恢復正常。
觀察組及對照組總體有效率分別為71.62%、54.67%,組間比較差異有統(tǒng)計學意義(χ
=4.598,P
=0.032)。見表2。
表2 兩組患者術(shù)后1個月療效評價[例(%)]
2.2 兩組患者治療前后AFP水平變化情況比較 治療結(jié)束后1個月復查AFP并與治療前進行對比,對照組70例AFP陽性者中,治療后有29例降至正常;觀察組72例AFP陽性者中,50例降至正常范圍,觀察組AFP降至正常比例高于對照組(χ
=11.287,P
=0.001)。2.3 兩組患者治療前后肝功能變化情況比較 兩組患者治療后TBIL、DBIL、ALT、AST水平升高(P
<0.05),觀察組及對照組各時間點肝功能各指標比較,差異無統(tǒng)計學意義(P
>0.05);兩組治療前后肝功能差值比較,差異無統(tǒng)計學意義(P
>0.05)。見表3。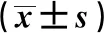
表3 兩組患者治療前后肝功能變化情況比較
2.4 兩組患者治療前后血清應激相關指標變化情況比較 治療前,兩組患者血清MDA、GSH、TNF-α、CRP水平差異無統(tǒng)計學意義(P
>0.05),術(shù)后兩組患者MDA、TNF-α、CRP等指標升高(P
<0.05),GSH降低(P
<0.05),兩組MDA、GSH、TNF-α、CRP等指標治療前后差值比較,差異無統(tǒng)計學意義(P
>0.05)。見表4。
表4 兩組患者治療前后血清應激相關指標變化情況比較

續(xù)表4
2.5 兩組患者隨訪情況 觀察組12、24個月生存率分別為93.24%(69/74)、77.03%(57/74),對照組分別為78.67%(59/75)、58.67%(44/75),觀察組12、24個月生存率均高于對照組,差異有統(tǒng)計學意義(χ
=6.537,P
=0.011;χ
=6.435,P
=0.011);Kaplan
-Meier
生存分析顯示,觀察組患者生存時間優(yōu)于對照組(Log
Rank
χ
=8.091,P
=0.004)。見圖1。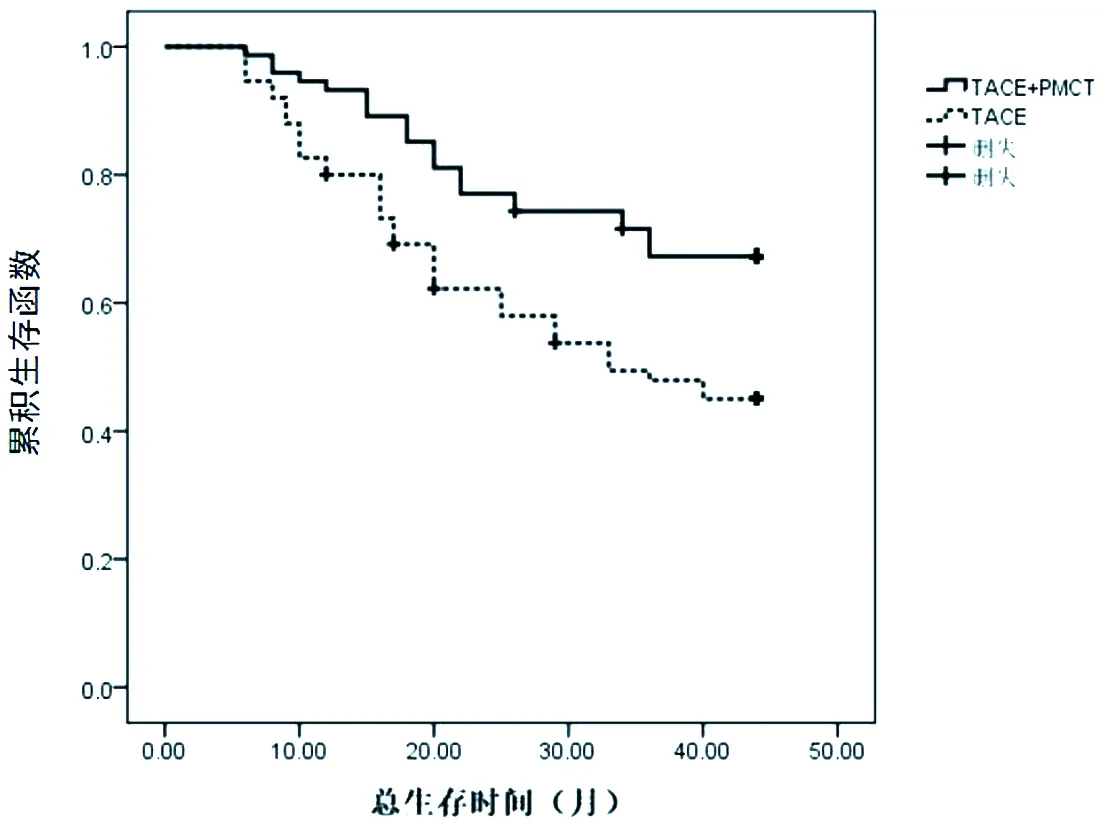
圖1 兩組患者總生存時間的Kaplan-Meier生存曲線
2.6 中晚期肝癌患者預后的影響因素分析 以肝癌患者預后作為因變量,以性別(男=1,女=2)、年齡、BMI、吸煙飲酒史(無=1,有=2)、合并癥(無=1,有=2)、病灶個數(shù)(1~2個=1,3~4個=2)、病灶直徑(0.5~4.1 cm=1,4.2~6 cm=2)、Child-Pugh分級(A級=1,B級=2)、BCLC分期(B期=1,C期=2,D期=3)、治療方式(TACE治療=1,TACE聯(lián)合PMCT=2)作為自變量,變量篩選采用條件向前法,選入P
≤0.05,剔除P
>0.10變量;COX多因素分析示,BCLC分期、腫瘤直徑、病灶數(shù)目、治療方式是影響中晚期肝癌患者生存的獨立影響因素(P
<0.05)。見表5。
表5 中晚期肝癌患者預后的影響因素分析
3 討論
目前,腫瘤介入治療方法較多,但尚未發(fā)現(xiàn)任何單一介入治療方式能達到較為滿意的治療效果。TACE通過肝動脈注射明膠海綿、碘化油等栓塞物質(zhì)阻斷腫瘤供血動脈,促使病灶缺血壞死,但單獨使用TACE難以達到完全性根除腫瘤的目的,術(shù)后極易復發(fā);而多次反復進行栓塞也有較高的不良反應。PMCT是利用微波熱效應及腫瘤對熱的敏感性進行治療的方法,可在短時間內(nèi)升高腫瘤局部溫度,促使病灶組織凝固、壞死,達到消滅控制腫瘤的目的,對于一定體積的病灶,PMCT治療有不劣于切除手術(shù)的效果;但該治療方法在體積較大的腫瘤中效果欠佳,在毗鄰重要血管及臟器的腫瘤中應用有較大的風險。因此,TACE、PMCT二者相結(jié)合或可發(fā)揮協(xié)同效應。
本研究結(jié)果顯示,與單獨使用TACE治療的患者比較,TACE聯(lián)合PMCT治療患者近期有效率更高,AFP恢復正常的比例較高,且未增加明顯不良反應,與既往多數(shù)研究報道類似。目前認為TACE治療效果不佳的原因一方面可能為TACE無法完全栓塞腫瘤血管,術(shù)后易形成側(cè)支循環(huán);另一方面可能為肝內(nèi)動靜脈瘺、血管閉塞等因素可促進化療藥物的流失,影響癌細胞的滅活,致使遠期預后不佳。PMCT治療在TACE治療7 d后,此時患者多數(shù)腫瘤血管床得到封閉,腫瘤血供明顯較少,在這一時間點進行PMCT治療,門靜脈血流可較好地吸收熱效應,降低射頻阻力,擴大消融范圍,更好地消除壞死組織;另一方面,TACE可增加肝臟局部的游離碘,增強高溫效應;此外,微波產(chǎn)生的高溫也可提高腫瘤組織對藥物的敏感度,使TACE的治療效果更好。
肝癌患者TACE治療后可出現(xiàn)急性、一過性肝功能異常,而肝功能是影響肝癌患者預后的重要因素,因此,探討治療后肝功能變化非常重要。本研究結(jié)果顯示,兩組患者術(shù)后均出現(xiàn)肝功能指標的降低,與既往研究結(jié)果相符;但兩組未見明顯差異,提示TACE聯(lián)合PMCT治療并未進一步加重肝功能異常。結(jié)合PMCT治療特點分析其對肝功能影響較小的原因,可能為PMCT具有較高的針對性,主要對瘤灶進行滅活,對于無瘤肝組織影響較小。本研究在2種方法治療結(jié)束后均進行保肝治療,也可能是控制肝臟損傷的重要因素。介入治療術(shù)后肝損傷機制復雜,既往李娟娟等開展的一項動物研究顯示,肝癌肝動脈栓塞術(shù)后存在超氧化物歧化酶等指標的降低,及過氧化物水平的升高,并推測氧化應激反應可能是導致肝細胞損傷、肝功能下降的機制之一;李屏等也研究證實,肝動脈化療栓塞術(shù)后原發(fā)性肝癌患者白細胞介素-12、IFN-γ水平顯著升高,IL-10水平明顯降低。為進一步探討2種術(shù)式對肝損傷的影響,本研究對手術(shù)前后氧化應激指標及炎癥因子指標進行比較,結(jié)果提示手術(shù)后兩組氧化應激、炎癥狀態(tài)均明顯升高,組間無差異,提示TACE及PMCT均可導致機體應激,聯(lián)合治療并不加重這種狀態(tài),與肝功能變化趨勢類似。
肝癌患者遠期預后較差,本研究中,TACE組患者12、24個月生存率為78.67%、58.67%,TACE聯(lián)合PMCT的生存率為93.24%、77.03%,提示二者聯(lián)合治療可提高中晚期肝癌的預后。目前認為肝癌患者預后可受較多因素影響,本研究采用多因素分析探討聯(lián)合治療對預后的影響,在校正BCLC分期、腫瘤直徑、病灶數(shù)目后,治療方式是影響患者預后的獨立影響因素,與張慧賢等研究結(jié)果類似。
綜上,中晚期肝癌患者應用TACE聯(lián)合PMCT治療可充分發(fā)揮協(xié)同作用,提高療效,不加重術(shù)后肝功能損傷,安全性較高,是一種較為安全、合理、有效的綜合療法。本研究存在一定局限性,本研究隨訪時間較短,且樣本量較小,未來仍有待進一步擴大樣本量進行驗證。

