黃連-葛根藥對治療2型糖尿病的網絡藥理學研究
李吉慶 林道斌 張永杰


摘要 目的:運用網絡藥理學研究方法對黃連-葛根藥對治療2型糖尿病(T2DM)的作用機制進行分析。方法:采用中藥系統藥理學分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)篩選出黃連-葛根(Coptis Chinensis-Pueraria Lobata,C-P)藥對的有效活性成分及作用靶點蛋白,再使用Unipro數據庫將篩選出的靶點蛋白轉換為基因名,通過GeneCards數據庫收集T2DM疾病基因,然后對藥物作用基因及疾病相關基因進行韋恩(Venn)分析,尋找交集靶點,用交集靶點與對應活性成分構建活性成分-靶點相互作用網絡,并對交集基因進行GO功能富集分析和KEGG通路富集分析。結果:研究得到13個作用于T2DM疾病靶點的活性成分和146個作用靶點,GO功能富集分析確定了284個條目,KEGG通路分析共發現77條作用通路。結論:本研究結果初步探討了C-P藥對治療T2MD的基本藥理作用及其機制,并為進一步的試驗研究奠定了良好的基礎。
關鍵詞 網絡藥理學;黃連;葛根;2型糖尿病;作用機制;前列腺素G/H合酶1;前列腺素G/H合酶2;PI3K-Akt信號通路
Mechanisms of the Drug Pair Coptis Chinensis-Pueraria Lobata in the Treatment of Type 2 Diabetes Mellitus Based on Network Pharmacology
LI Jiqing,LIN Daobin,ZHANG Yongjie
(Department of Endocrine,Chinese Medicine Hospital of Hainan Province,Haikou 570203,China)
Abstract Objective:To analyze the mechanism of the drug pair Coptis chinensis-Pueraria lobata in the treatment of type 2 diabetes mellitus(T2MD)by using the method of network pharmacology.Methods:The active components and target proteins of the drug pair Coptis chinensis-Pueraria lobata(C-P)were screened by Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP),and the target proteins were screened by Unipro database and converted into gene names.The disease gene of T2MD was collected through GeneCards database.Then the drug-acting genes and disease-related genes were analyzed by vnne to find the intersecting targets,with which plus their corresponding active components an active component-target interaction network was constructed.GO function enrichment analysis and KEGG pathway enrichment analysis of the intersecting genes were also carried out.Results:A total of 13 active components acting on T2MD and 146 effect targets were identified,284 items were identified by GO functional enrichment analysis,and 77 pathways were identified by KEGG pathway analysis.Conclusion:The results of this study preliminarily discussed the basic pharmacological effects and mechanisms of C-P drugs on the treatment of T2MD,and laid a good foundation for further experimental research.
Keywords Network pharmacology; Coptis chinensis; Pueraria lobata; Type 2 diabetes; Mechanism of action; Prostaglandin G / H synthase 1; Prostaglandin G / H synthase 2; PI3K Akt signaling pathway
中圖分類號:R282;R587.1文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.06.007
作為一種常見的慢性疾病,糖尿病在2015年的全球發病已經超過4.15億,預計在未來30年將達到6.42億[1]。在我國,糖尿病與心血管病以及腫瘤,已成為威脅人民健康的3大慢性病。在過去的30年里,經過7次全國性調查發現,中國內地的糖尿病患者增長了17倍,其中2型糖尿病患者占比高達90%~95%[2]。所以針對糖尿病,特別是2型糖尿病的藥物開發已經日益迫切。最近,由于同時具有安全性、低成本和有效性,中藥治療糖尿病受到了廣泛關注[3],C-P藥對就是其中的代表性藥物之一。C-P藥對是經方葛根芩連湯改善糖脂代謝的主要藥對,藥效作用等同于全方[4-5]。然而目前對于C-P藥對治療2型糖尿病(Type 2 Diabetes Mellitus,T2DM)的治療機制和多從單體成分或單個靶點展開,與中藥多成分、多靶點協同治療機制相悖,這也阻礙了該藥對的進一步開發。
近年來網絡藥理學的興起,為探索中藥治病機制提供了新的方式[6]。網絡藥理學通過分析“分子-靶點-通路-疾病”的多層次網絡的關系,能從整體上闡明中藥的作用機制,從部分到系統的解釋中藥與機體的相互作用。因此,本研究運用網絡藥理學的研究方式探討黃連治療T2DM的作用機制。
1 材料與方法
1.1 C-P藥對的活性成分及靶點挖掘
中藥系統藥理學數據庫和分析平臺(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)是由西北農林科技大學依托文獻挖掘和數據庫整合,能夠通過研究藥物靶標網絡和疾病網絡,從整體上揭示中藥的作用機制[7]。借助TCMSP在線平臺獲取C-P藥對的化學成分,根據口服生物利用度(OB)≥30%和類藥性(DL)≥0.18,篩選出符合條件的候選化合物其對應靶點,然后在Uniprot數據庫[8],將研究物種限定為“人”,再把獲取的靶點轉換成對應的基因。
1.2 T2DM相關靶點獲取及交集靶點的篩選
以“type 2 diabetes mellitus”為檢索詞,在GeneCards數據庫(https://www.genecards.org/)中搜索T2DM的相關靶點。并與1.1中獲取的藥物靶點進行Venn分析,獲取交集靶點。
1.3 “中藥化學成分-作用靶點”網絡的構建和分析
運用Cytoscape3.6.1軟件構建活性成分-靶點的相互作用網絡關系圖,再利用軟件中的“Network Analyzer”功能對各個節點進行分析,根據化合物與靶點的度值(Dgree)篩選出作用于T2DM的關鍵化合物及關鍵作用靶點。
1.4 GO功能分析和KEGG通路富集分析
再將1.2得到的交集基因導入DAVID6.8數據庫,并限定研究物種為“Homo Sapiens”,將靶基因名設置為官方名稱(Official Gene Symbol),根據錯誤發現率(FDR)<0.01,進行基因功能(Gene Ontology,GO)分析和基于京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Geomes,KEGG)通路富集分析。
2 結果
2.1 候選化合物及靶點的篩選結果
在TCMSP根據OB≥30%,DL≥0.18,得到C-P藥對有對應靶點的活性成分共15個,對應靶點經過去重后有210個。
2.2 T2DM靶點基因及交集靶點篩選結果
從GeneCards數據庫中檢索到T2DM相關靶點基因10 320個,與藥物靶點進行Venn分析后得到交集靶點146個。
2.3 網絡構建及分析結果
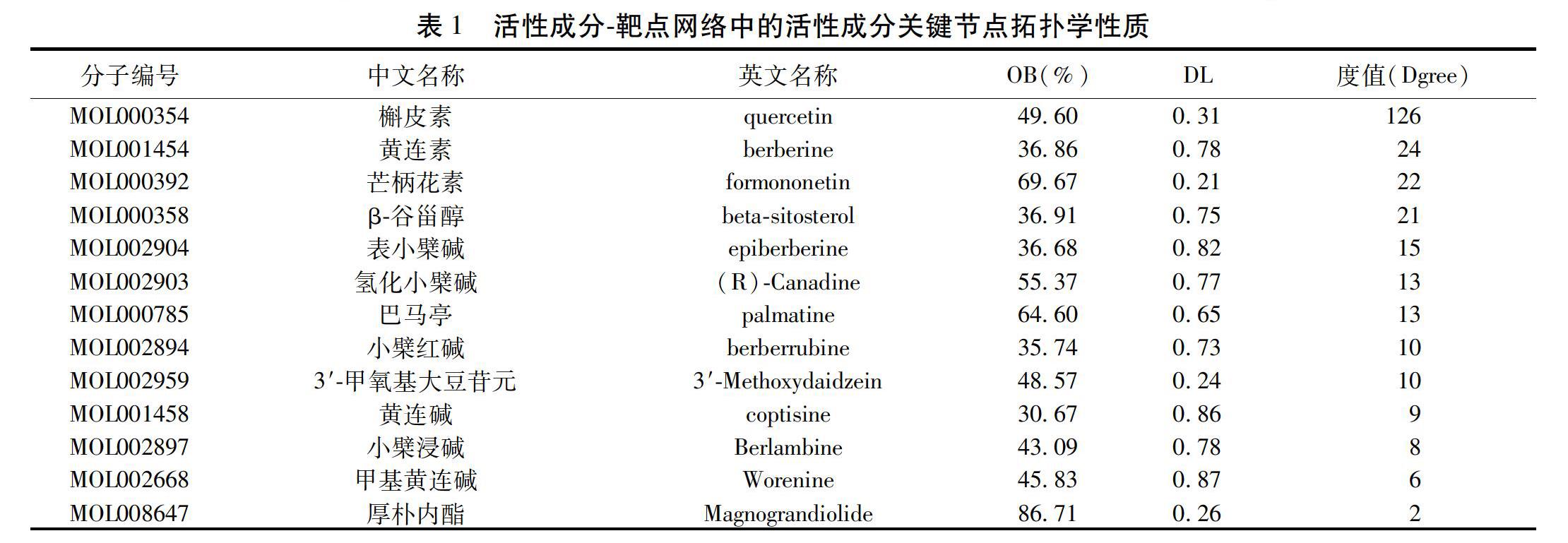
將靶點與其對應的活性成分導入Cytoscape3.6.1軟件后,建立了一個各個節點聯系密切的相互作用網絡關系圖。見圖1~2。在圖中共有159個節點,綠色的黃連活性成分節點有10個、黃色的葛根活性成分節點有3個,紅色圓形的靶點節點有146個,經過Cytoscape中的Network Analysis-Analyze Network插件對該網絡圖中的每個節點進行分析,得到網絡中各個節點的度值(Degree)。活性成分中,平均每種活性成分對應著21個靶點,度值最高的前5種活性成分分別是槲皮素(Quercetin)、黃連素(Berberine)、β-谷甾醇(Beta-sitosterol)、芒柄花素(Formononetin)、小檗浸堿(Berlambine)等。見表1。靶點方面,Degree均值約等于2,有39個靶點節點Degree高于均值。見表2。這些靶點能是黃連-葛根治療T2DM的關鍵調控靶點,Degree均值最高的5個靶點分別是前列腺素G/H合酶1(PTGS1)、前列腺素G/H合酶2(PTGS2)、過氧化物酶體增殖物激活受體γ(PPARG)、雄激素受體(AR)、一氧化氮合酶(NOS)。
2.4 GO功能注釋及KEGG通路富集分析結果
利用DAVID平臺的GO和PATHWAY富集分析功能對146個靶點進行了研究,GO富集分析中根據FDR(錯誤發現率)<0.01確定了284條GO條目,涉及生物過程的有216條,如對藥物反應、轉錄正調節、細胞老化等。涉及分子功能的有60條如酶結合、RNA聚合酶II轉錄因子活性、蛋白質活性等。涉及細胞組成的有27條,如細胞外間隙、膜筏、質膜等。同時根據FDR<0.01共找到了77條作用通路,目前有報道的有TNF信號通路、HIF-1信號通路、PI3K-Akt信號通路等。表3,表4分別列舉了FDR最小的前20條GO和KEGG通路分析結果。
3 討論
本研究共發現了黃連-葛根藥對的治療T2DM的13種主要活性成分及146個作用靶點。其中Degree值最高的5種主要成分里,槲皮素能提高抗凋亡蛋白Bcl-2的表達,降低促凋亡蛋白Bax的分泌,從而減輕氧化應激導致的胰島細胞凋亡[9],并且可以增加MAPK的表達水平與促進MAPK磷酸化,激活胰島素細胞中的FGF21/MAPK信號通路,有效減輕胰島素抵抗作用[10]。黃連素同樣具有改善胰島素抵抗作用[11],還能調節機體糖代謝紊亂[12],以及保護胰島細胞[13]。芒柄花素可以通過調控核因子-κB信號通路上游的IKKβ、IκBα,抑制二者高糖環境下的磷酸化,從而減輕由核因子-κB信號通路的活化導致的炎癥反應[14]。有研究顯示,表小檗堿能顯著降低空腹血糖值并改善糖耐量[15]。β-谷甾醇改善微循環,對糖尿病導致的腎臟損害有保護作用[16]。
靶點方面,前列腺素G/H合酶1(PTGS1)和前列腺素G/H合酶2(PTGS2)又稱環氧化酶(COX1/2)是將花生四烯酸轉化為前列腺素的關鍵性限速酶,COX1為結構型同工酶,COX2為誘導型同工酶。COX1廣泛分布于人體的組織臟器,如胃、腎、血管等。其參與合成的前列腺素對調節腎的血流量、血管舒張起著重要作用,維持著機體的正常生理過程[17]。但COX1在T2DM的疾病過程中扮演的角色目前鮮有報道,研究主要集中在另一種亞型COX2上。由其誘導合成的前列腺素類衍生物,不但會導致糖耐量降低,還會減弱胰島素敏感性[18-19]。因此抑制COX2的表達,進而減少前列腺素類物質的合成,對治療T2DM至關重要。
一項前瞻性試驗研究顯示總睪酮和游離睪酮水平較高者,糖尿病發病率較低[20]。進一步的研究則表明對雄激素低下的老年患者補充睪酮可以有效降低空腹血糖[21]。其機制在于,線粒體功能障礙會影響到機體糖代謝過程,而睪酮可以保護線粒體從而發揮調節糖代謝作用。
PPARG是一類由配體激活的轉錄因子,目前已發現有3種亞型PPARα,PPARβ,PPARγ等。其中由PPARG編碼的PPARγ大量分布于脂肪細胞和免疫細胞中,從促進白色脂肪細胞分化,提高胰島素受體數目。促進與胰島素信號傳導相關基因的轉錄,加強胰島素信號傳導。激活與代謝相關蛋白激酶,提高外周組織細胞的葡萄糖轉運,減少糖誘導的胰島素釋放等3個途徑改善胰島素抵抗。所以作用于PPARG靶點,可能對胰島素抵抗有改善作用[22]。
NOS3是APN信號傳導通路中的關鍵分子一氧化氮(NO)的重要合成酶。血管內皮細胞合成的NO不但可松弛血管平滑肌,還可通過抑制白細胞趨化、血小板黏附及低密度脂蛋白的過氧化,改善高糖環境下的血管損傷[23]。所以,活性成分作用于該靶點,可能對血管系統起著保護作用。
通路方面,前20條通路中目前報道與T2DM密切相關的有,乙肝通路、HIF-1信號通路、PI3K-Akt信號通路等。研究表明,乙肝患者發生糖尿病的風險遠高于常人,這可能與乙肝病毒損傷肝功能導致的肝臟糖代謝異常以及進而產生的胰島素抵抗有關[24-25]。缺氧誘導因子-1α(HIF-1α)是重要的轉錄調控分子,糖尿病中由其產生的級聯反應在血管生成、細胞凋亡等過程中發揮重要作用。高糖環境下HIF-1α分子表達下調,繼而導致血管內皮生長因子(VEGF)低表達[26]。這也是糖尿病壞疽的發病機制之一,因為VEGF的表達降低,會導致微循環障礙及血管重構受阻[27]。同時,HIF-1α直接轉錄調控著抗凋亡因子Bcl-2家族中的Bcl-xL、MCL-1等[28],糖尿病中HIF-1α蛋白表達下調,將直接導致上述抗凋亡分子分泌降少,最終導致胰島素B細胞凋亡,這也是糖尿病發生和進展的重要環節[29]。PI3K-Akt信號通路方面,激活后的PI3K,可介導磷脂酰肌醇一磷酸磷酸化為磷脂酰肌醇二磷酸及磷脂酰肌醇三磷酸,并進一步激活Akt。活化的Akt對調節胰島B細胞數量、大小和胞內的基因轉錄有著重要影響[30]。周琦等[31]的研究則表明葛根芩連湯可通過激活PI3K-Akt中的上游信號蛋白IRS-2,維持PI3K-Akt通路的活化,繼而產生保護胰島B細胞的作用。
綜上所述,本研究通過網絡藥理學的方法對C-P藥對治療T2DM的作用機制進行了分析,發現了13種可直接作用于T2DM靶點的活性成分以及146個潛在靶點,并通過KEGG通路富集分析確定了77條作用通路,結果與目前文獻報道基本吻合,證明了其科學性。同時上述研究成果也給我們進一步的研究指明了方向,為在動物實驗中深入探討C-P藥對治療T2DM的作用機制奠定了基礎。
參考文獻
[1]Ge Q,Chen L,Chen K.Treatment of Diabetes Mellitus Using iPS Cells and Spice Polyphenols[J].J Diabetes Res,2017,2017:5837804.
[2]Shen X,Vaidya A,Wu S,et al.THE DIABETES EPIDEMIC IN CHINA:AN INTEGRATED REVIEW OF NATIONAL SURVEYS[J].Endocr Pract,2016,22(9):1119-29.
[3]段春梅,胡永東,李娜.中藥干預糖尿病前期的研究進展[J].湖南中醫雜志,2019,35(8):161-163.
[4]汪群紅,何賢君,胡敏,等.黃連和葛根聯合抗糖尿病的藥效學研究[J].中華中醫藥學刊,2019,37(3):676-679.
[5]劉思洋,趙興冉,顧健,等.葛根黃連有效組分配伍抗2型糖尿病機制初步研究[J].中藥材,2016,39(3):641-644.
[6]王萍,唐仕歡,蘇瑾,等.基于整合藥理學的中藥現代研究進展[J].中國中藥雜志,2018,43(7):1297-1302.
[7]Yang Y,Li Y,Wang J,et al.Systematic Investigation of Ginkgo Biloba Leaves for Treating Cardio-cerebrovascular Diseases in an Animal Model[J].ACS Chem Biol,2017,12(5):1363-1372.
[8]Pundir S,Magrane M,Martin MJ,et al.Searching and Navigating UniProt Databases[J].Curr Protoc Bioinformatics,2015,50:1.27.1-1.27.10.
[9]Ran Q,Wang J,Wang L,et al.Rhizoma coptidis as a Potential Treatment Agent for Type 2 Diabetes Mellitus and the Underlying Mechanisms:A Review[J].Front Pharmacol,2019,10:805.
[10]葛凌,蔡亞軍,王章達.槲皮素對2型糖尿病大鼠胰島素抵抗的改善作用及FGF21/MAPK信號通路的影響[J].中國藥師,2019,22(3):418-421.
[11]Ma H,He K,Zhu J,et al.Corrigendum to “The anti-hyperglycemia effects of Rhizoma Coptidis alkaloids:A systematic review of modern pharmacological studies of the traditional herbal medicine”[Fitoterapia.134(2019)210-220][J].Fitoterapia,2020,141:104451.
[12]Dong Y,Chen YT,Yang YX,et al.Metabolomics Study of Type 2 Diabetes Mellitus and the AntiDiabetic Effect of Berberine in Zucker Diabetic Fatty Rats Using Uplc-ESI-Hdms[J].Phytother Res,2016,30(5):823-8.
[13]Jiang YY,Cui HM,Wang JL,et al.Protective role of berberine and Coptischinensis extract on T2MD rats and associated islet Rin-5f cells[J].Mol Med Rep,2017,16(5):6981-6991.
[14]田心,常盼,周亞光,等.刺芒柄花素對高糖誘導的小鼠系膜細胞炎癥因子調控及增殖的影響[J].中成藥,2017,39(5):1052-1056.
[15]崔學龍,王德珍,鄒宗堯,等.表小檗堿降糖作用研究[J].亞太傳統醫藥,2015,11(13):12-13.
[16]Jin JL,Lee S,Lee YY,et al.Platelet anti-aggregating triterpenoids from the leaves of Acanthopanax senticosus and the fruits of A.sessiliflorus[J].Planta Med,2004,70(6):564-566.
[17]Nrregaard R,Kwon TH,Frkiaer J.Physiology and pathophysiology of cyclooxygenase-2 and prostaglandin E2 in the kidney[J].Kidney Res Clin Pract,2015,34(4):194-200.
[18]Shanmugam N,Gaw Gonzalo IT,Natarajan R.Molecular mechanisms of high glucose-induced cyclooxygenase-2 expression in monocytes[J].Diabetes,2004,53(3):795-802.
[19]Lihong Xiao.Blood Sugar Reduction of Type 2 Diabetic Patients through a Mindfulness Intervention Program[J].NeuroQuantology,2018,16(1):57-62.
[20]Salminen M,Vahlberg T,Rih I,et al.Sex hormones and the risk of type 2 diabetes mellitus:A 9-year follow up among elderly men in Finland[J].Geriatr Gerontol Int,2015,15(5):559-564.
[21]Yassin DJ,Doros G,Hammerer PG,et al.Long-term testosterone treatment in elderly men with hypogonadism and erectile dysfunction reduces obesity parameters and improves metabolic syndrome and health-related quality of life[J].J Sex Med,2014,11(6):1567-1576.
[22]Chigurupati S,Dhanaraj SA,Balakumar P.A step ahead of PPARγ full agonists to PPARγ partial agonists:therapeutic perspectives in the management of diabetic insulin resistance[J].Eur J Pharmacol,2015,755:50-57.
[23]Fetterman JL,Holbrook M,Flint N,et al.Restoration of autophagy in endothelial cells from patients with diabetes mellitus improves nitric oxide signaling[J].Atherosclerosis,2016,247:207-217.
[24]鄧舒妮,張學思,李新玥,等.慢性丙型肝炎病毒感染患者發生2型糖尿病的流行病學調查[J].中華醫院感染學雜志,2016,26(6):1279-1280,1283.
[25]張蕙彥.慢性乙型肝炎病人2型糖尿病流行情況調查與相關因素分析[J].中國衛生產業,2014,12(33):56-57.
[26]Boodhwani M,Sodha NR,Mieno S,et al.Functional,cellular,and molecular characterization of the angiogenic response to chronic myocardial ischemia in diabetes[J].Circulation,2007,116(11):131-137.
[27]Sarkar K,Fox-Talbot K,Steenbergen C,et al.Adenoviral transfer of HIF-1alpha enhances vascular responses to critical limb ischemia in diabetic mice[J].Proc Natl Acad Sci U S A,2009,106(44):18769-18774.
[28]Chen N,Chen X,Huang R,et al.BCL-xL is a target gene regulated by hypoxia-inducible factor-1{alpha}[J].J Biol Chem,2009,284(15):10004-10012.
[29]艾麗根,劉芳.缺氧誘導因子-1α與糖尿病血管新生的研究進展[J].中國糖尿病雜志,2015,23(5):470-474.
[30]Brown KK,Toker A.The phosphoinositide 3-kinase pathway and therapy resistance in cancer[J].F1000Prime Rep,2015,7:13.
[31]周琦,朱向東,仝小林,等.葛根芩連湯對2型糖尿病模型大鼠胰島細胞IRS-2/PI3K-Akt通路的影響[J].中醫雜志,2018,59(11):973-977.
(2019-10-09收稿 責任編輯:楊覺雄)

