上海市獸藥經營企業GSP現場檢查評定結果分析
張亦菲 ,徐 汀,張浩然,黃家鶯,華賢輝,田 愷,曹 瑩
(上海市獸藥飼料檢測所,上海 201103)
《獸藥經營質量管理規范》[1]是獸藥經營企業從事獸藥經營活動的基本準則,也是規范獸藥經營環節獸藥產品質量的一項必要舉措。獸藥GSP于2010年3月1日起在全國正式施行,2017年12月農業部發布了《農業部關于修改和廢止部分規章、規范性文件的決定》(農業部令2017年第8號)[2],修改了《獸藥經營質量管理規范》等規章和規范性文件。上海市為落實農業農村部改革措施,進一步加強本市獸藥經營質量管理,根據本市實際情況修訂了《上海市獸藥經營質量管理規范實施細則》、《上海市獸藥GSP現場檢查評定標準》等配套管理制度,規范了現場檢查的程序和內容,自2018年6月1日起施行。
本文對上海市獸藥GSP現場檢查中存在的共性問題進行歸納,分析問題產生原因,為及時發現企業存在的系統性問題提供參考,為加強獸藥GSP后續工作開展提出建議。
1 基本情況
自2018年6月至2020年12月,上海市中心城區有26家獸藥經營企業提出了核發或換發獸藥經營許可證的申請,已按照獸藥GSP檢查驗收項目對企業進行現場檢查。
參考《獸藥經營質量管理規范》(以下簡稱《規范》)制定的《上海市獸藥GSP現場檢查評定標準》(以下簡稱《標準》)中檢查驗收項目共分7章90項,場所與設施章節29項,機構與人員章節11項,管理制度章節9項,采購與入庫11項,陳列與儲存14項,銷售與運輸12項,售后服務4項,其中關鍵項目(條款號前加*)14項,一般項目76項。評定結果分為三檔,完整、齊全基本符合要求的項目打“Y”,不夠完善、存在一定缺陷的項目打“Y-”,缺陷嚴重的項目打“N”。在本文的統計中不對N,Y-做出嚴格區分,未打“Y”的項目均視作有缺陷的條款。
2 評定結果及缺陷項目概況
2.1 評定結果概況 在接受現場檢查的26家獸藥經營企業中,出現關鍵項目不完善的企業24家,占檢查企業數的92.3%;只出現一般項目缺陷或不完善的企業僅2家,占檢查企業數的7.7%。現場檢查共發現45項合計142條不完善或缺陷項目。
2.2 現場檢查中涉及的缺陷條款 獸藥GSP現場檢查過程中涉及的缺陷條款共計45項,關鍵項目7項,一般項目38項。依據《標準》對條款進行匯總分類,發現每一章節均有缺陷項。按缺陷條款占比情況來看,管理制度、陳列與儲存和機構與人員三個章節中涉及的缺陷條款均超過各自條款數的一半,分別為77.8%、64.3%和54.5%。缺陷條款匯總情況詳見表1。
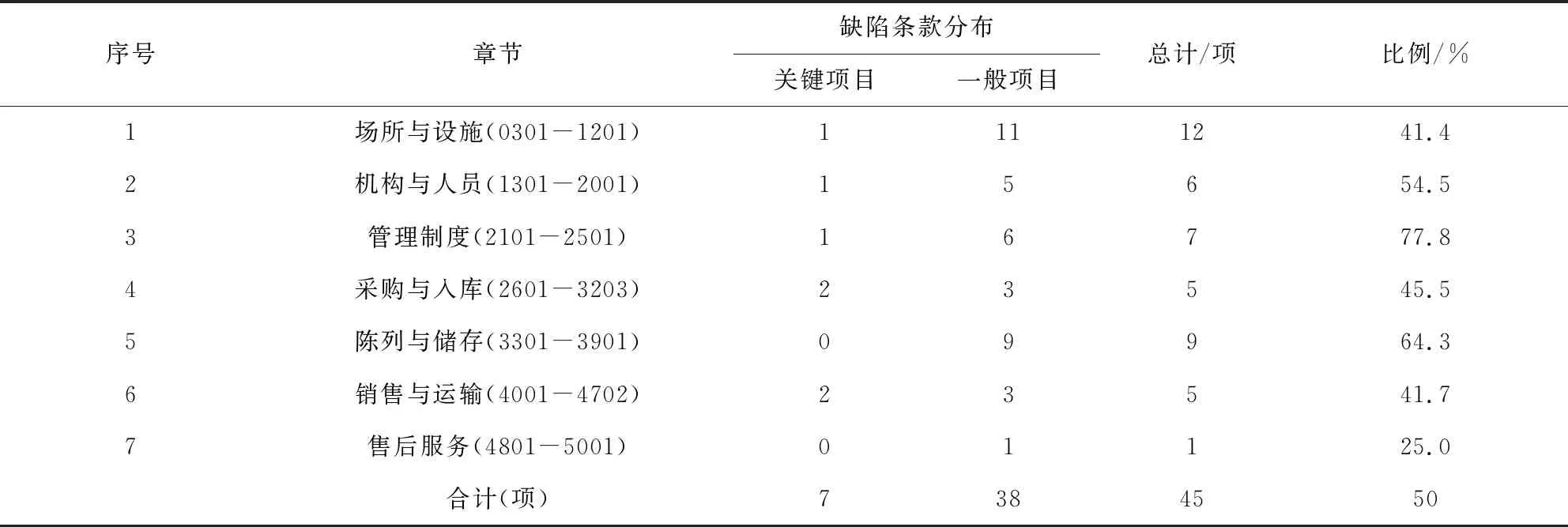
表1 現場檢查中涉及的缺陷條款匯總Tab 1 Summary of defects involved in on-site inspection
2.3 現場檢查缺陷項目分布情況 GSP現場檢查過程中涉及的缺陷項目共有142條,關鍵項目22條,一般項目120條。缺陷項分布數由大到小依次為場所與設施、管理制度、陳列與儲存、機構與人員、銷售與運輸、采購與入庫和售后服務,分別占缺陷總數的33.8%、25.4%、12.7%、12.0%、9.9%、5.6%和0.7%。缺陷項目分布具體情況詳見表2。
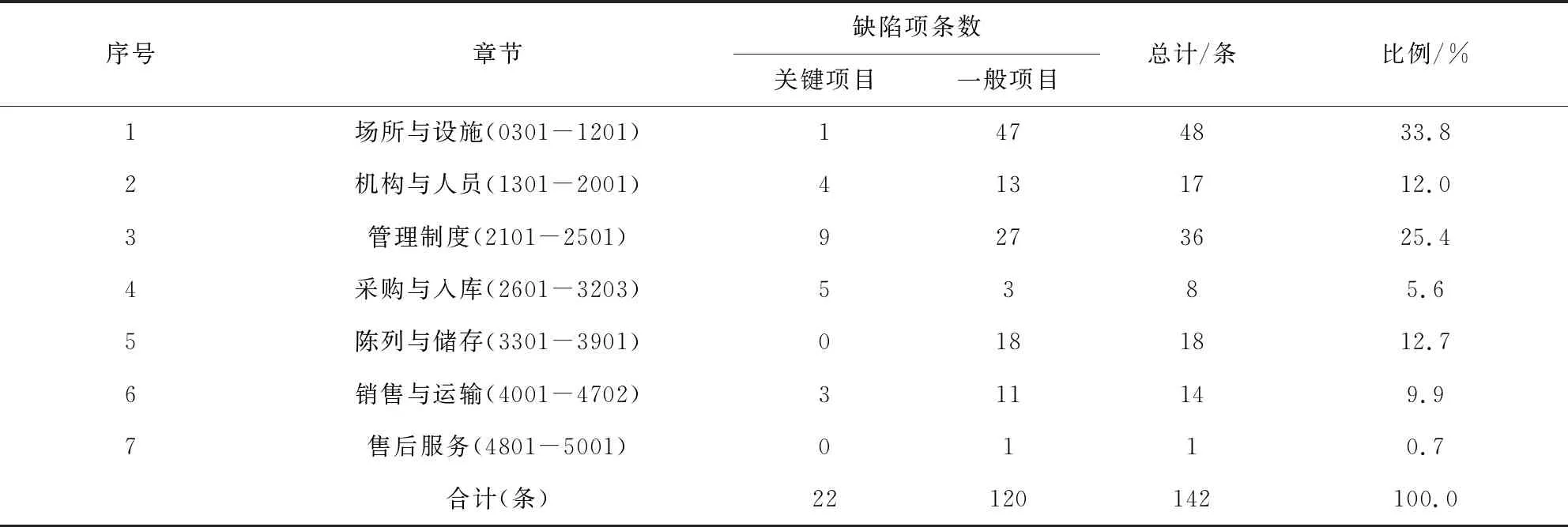
表2 現場檢查缺陷項目分布情況Tab 2 Distribution of on-site inspection defect items
2.4 高頻次缺陷條款分布情況 經現場檢查發現的142條缺陷項目中,出現5次以上的缺陷共有9項,共計74條,占總缺陷項目數的52.1%。場所與設施方面,主要體現在未按照《標準》要求布置場所環境,問題較為突出;機構與人員方面部分企業未建立培訓或考核檔案;管理制度方面問題較多,主要是管理制度文件、檔案內容不健全;陳列與儲存方面,部分批發企業未按照要求陳列經營樣品信息;包裝與運輸方面問題主要是經營生物制品的企業對有控溫需求的獸藥管理不當。高頻次缺陷條款(≥5)分布情況詳見表3。
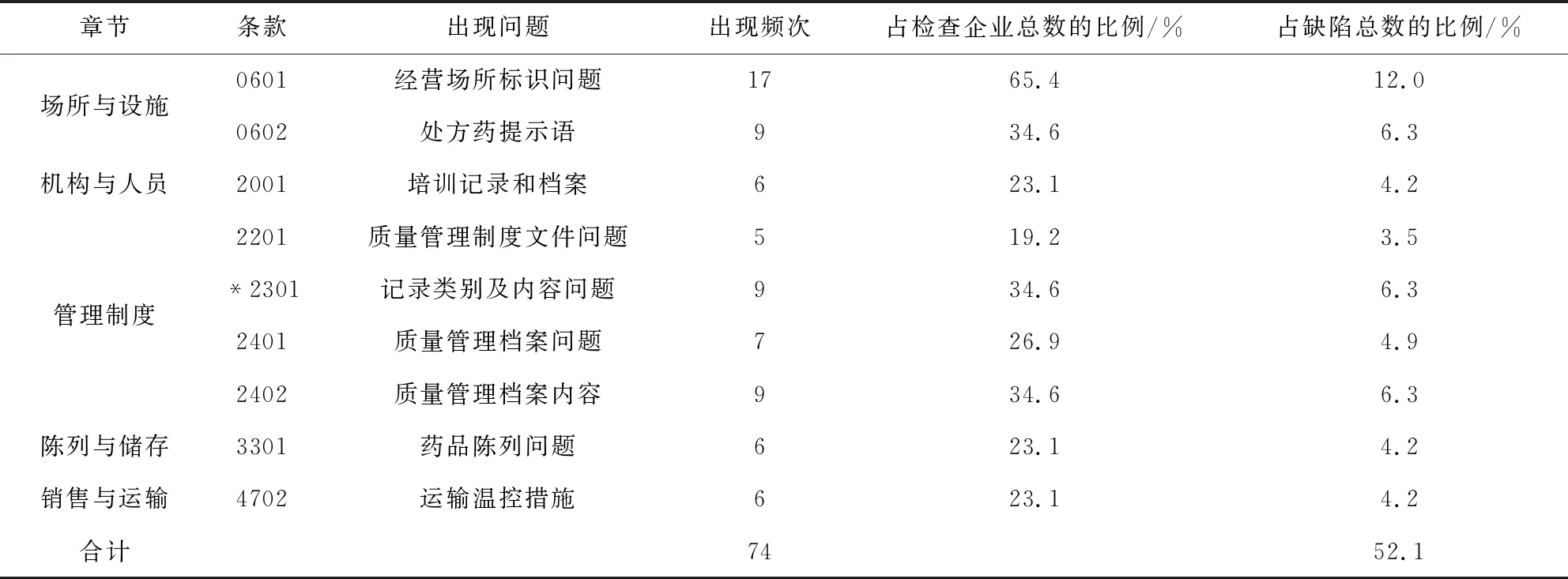
表3 高頻次缺陷條款(≥5)分布情況Tab 3 Distribution of high-frequency defect items (≥5)
3 存在的共性問題分析
通過對缺陷項目的匯總分析,從表1、表2可以看出缺陷項目在《標準》的各個章節均有涉及,反映出獸藥經營企業對GSP的理解、認識存在誤區,部分企業實施GSP的主要目的是應對驗收,缺乏長遠性考慮和自我規范意識[3],質量管理還不夠嚴謹和完善。本文在表3中整理出高頻次缺陷條款,企業可以對照自查,監督檢查人員也可以在現場評定或日常監督中更有針對性的開展檢查。
以下主要從缺陷條款較多的場所與設施、機構與人員、管理制度、采購與入庫、陳列與儲存、銷售與運輸等6個方面進行分析。
3.1 場所與設施 在檢查的26家獸藥經營企業中,24家企業在場所與設施方面有不完善或缺陷的項目,占企業總數的92.3%,該章節缺陷條款數在總缺陷數中占比33.8%,為各章節中最高,出現頻次最高的缺陷項目也屬于本章節,可以說在場所與設施方面各企業存在許多共性問題。本章節主要規定了獸藥經營企業的營業場所、倉庫、辦公用房的布局和應當具備的條件,同時規定獸藥經營企業必須配備保持所經營獸藥質量的設備和設施。檢查中出現的問題主要在經營場所和倉庫標識和環境控制方面。經營場所問題主要集中在未按照要求懸掛質量承諾或相關管理制度及服務公約、未懸掛“獸用處方藥必須憑獸醫處方購買”提示語,未根據獸藥品種、類別、用途設立醒目標志,未對獸用處方藥及非處方藥做出區分標識;倉庫的問題一方面體現在未按照分類以及貯存要求對獸藥分區陳列,如無不合格區、待驗區和退貨區;另一方面是未做好貯存環境條件的控制,如未根據經營產品的貯存要求設置陰涼庫、避光設施、配備高壓滅菌鍋、溫度控制設備,冷庫內未懸掛溫度表、未制定停電應急預案、措施等。上海近年來新增的獸藥經營企業大多為兼營企業,申請人不具備獸藥相關專業背景,從現場檢查中發現的問題也反映出管理者普遍缺乏對規范的正確認識,質量意識不足,所以未能理解各種標識在經營中的重要意義,也缺乏對獸藥儲存環境的敏感性,導致問題頻出。
3.2 機構與人員 在檢查的26家獸藥經營企業中,12家企業在場所與設施方面存在不完善或缺陷的項目,占企業總數的46.2%,該章節缺陷條款數在總缺陷數中占比12.0%。本章節主要規定了獸藥經營企業的機構設置和人員條件,問題主要集中在企業法人、經營負責人甚至是質量管理人員缺乏獸藥法律法規相關知識及人員的授權和管理方面存在缺陷。部分企業質量管理人員缺少獸用生物制品相關培訓證書;未按規定制定銷售人員委托或授權書等。機構與人員是企業GSP體系運行中至關重要的一環,人員的素質直接影響到企業整體GSP管理的運行,許多企業在實施獸藥GSP的工作中,只注重按要求配備相應條件的人員,而忽視人員的實際能力和綜合素質,能夠真正理解并熟練運用GSP管理的管理人員相對匱乏,企業人員素質偏低又是導致其他環節出現缺陷的必然因素[4]。
3.3 管理制度 在檢查的26家獸藥經營企業中,有20家企業在管理制度方面有不完善或缺陷的項目,占企業總數的76.9%,該章節缺陷條款數在總缺陷數中占比25.4%。管理制度方面共設置了9項條款,主要規定了獸藥經營企業的文件和檔案管理,要求企業制定質量管理文件并建立相應記錄,對涵蓋的內容、保存期限也提出了要求。此章節是問題高發區,在檢查中發現有77.8%的款項出現過需要整改的問題,缺陷一方面體現在管理制度不齊全,缺少如獸藥產品追溯、質量評估、獸藥陳列與儲存管理等制度,另一方面是企業建立的檔案和記錄表不齊全、記錄填寫不規范,尤其是人員培訓、考核方面的記錄出現問題較為普遍。對于剛進入獸藥行業的申請人來說,正確地借鑒別人的先進經驗和做法是必要的,但切忌不加消化、盲目學習甚至全盤照搬,如部分企業未能結合自身情況制定管理制度,導致文件、記錄表和檔案繁雜過多卻未能覆蓋整個質量控制范圍,知其然不知其所以然,填寫記錄時也不知原因和重點,達不到質量控制的目的。
3.4 采購與入庫 在檢查的26家獸藥經營企業中,6家企業在采購與入庫方面有不完善或缺陷的項目,占企業總數的23.1%,該章節缺陷條款數在總缺陷數中占比5.6%。該章節規定了獸藥經營企業應建立的獸藥采購、入庫審核檢查制度,要求建立真實完整的采購記錄。此章節缺陷率較低,但涉及到的兩條關鍵條款體現出企業未能滿足《標準》對企業在購進獸藥前對供應商及產品的資質審核和購進獸藥時的質量驗收提出的要求。獸藥GSP是確保獸藥產品從出廠后到使用前質量可靠的有效手段,采購入庫則是GSP執行時的重要環節,為了有效控制獸藥流通過程中的質量風險,防范不合格藥品進入供應鏈,企業必須應加強責任意識,做好源頭把控,對供應商和所供應藥品進行合法性和質量可靠性審核[5]。企業在選擇供應商時不能只考慮經營成本,若經營產品出現抽樣檢測不合格,不僅會受到經濟上的處罰,企業信譽也會受到影響。
3.5 陳列與儲存 在檢查的26家獸藥經營企業中,13家企業在陳列與儲存方面有不完善或缺陷的項目,占企業總數的50.0%,條款數在總缺陷數中占比12.7%。該章節主要規定了獸藥經營企業陳列、儲存獸藥應當具備的條件,問題主要表現在企業未按規定陳列經營的獸藥樣品,或陳列展示的信息不全;內用與外用獸藥未做出區分或分柜存放;未定期對獸藥的陳列、儲存條件做好檢查記錄;麻醉藥品無專賬記錄。
3.6 銷售與運輸 在檢查的26家獸藥經營企業中,10家企業在銷售與運輸方面有不完善或缺陷的項目,占企業總數的38.5%,該章節缺陷條款數在總缺陷數中占比9.9%。該章節主要規定獸藥經營企業銷售、運輸獸藥應當遵循的原則和應當具備的條件,問題較少,涉及到的兩條關鍵項問題主要是記錄內容不全,缺少生產廠家或獸藥產品批準文號等內容,一條高頻次缺陷項目是因為較多企業未對運輸時有溫度控制要求的獸藥建立詳細記錄。GSP要求獸藥的進、存、銷各個環節都應有可追溯的原始記錄,并保證真實、完整、準確、有效,能充分體現所載內容的質量責任。若因記錄問題無法有效追溯,當藥品發現質量問題便無法有效追溯其真實的產生原因,規避同類問題再次發生。
4 建議與對策
4.1 加強企業管理與人員培訓 提高企業質量管理水平,人員的素質是關鍵。“人”作為企業經營活動與質量管理中最重要及最活躍的因素,其主觀意識、經營理念、專業水平和對法律法規的熟悉程度等都直接影響企業的經營行為[6]。各環節雖然問題頻出,究其原因還是企業負責人尤其是質量管理人員缺少對實施獸藥GSP必要性的認識,尤其是“場所與設施”中經營場所和倉庫標識和環境控制方面的問題,按條款要求布置即可,不確定的可向當地獸藥行政管理部門人員咨詢。管理人員必須自我加壓,加強對相關法律法規的學習,了解條款設置背后的意義;同時重視在獸藥經營行業中具有較長經營年限的人才儲備,經驗豐富的從業人員可以引導管理制度順暢運行,有利于各項規章制度的修訂和完善。企業應根據自身經營的實際情況,細化管理制度,如定期開展有針對性的培訓,如藥品儲存方面,藥品儲存人員應加強庫房溫濕度管理、色標管理、防護管理、堆垛管理、分類存放管理、特殊管理藥品的儲存管理等方面的培訓[7],使企業內部員工更好地理解GSP管理要求,即“一切按規定辦事,一切以原始資料為依據,一切記錄在案,一切以數據說話”。
4.2 強化企業責任意識與管理水平 獸藥GSP的核心是通過嚴格的管理制度來約束獸藥經營企業的行為,對獸藥經營全過程進行質量控制,防止質量事故發生,保證經營的獸藥質量[8],將GSP以工作部署形式分解至各部門,明確各部門在質量管理工作中的職責,強化公司各部門的質量意識,專人專崗,明確授權,完善體系建設,使質量管理工作引起全員重視,做到全員參與,責任到人:質量管理人員應取得相關資格證書,提高綜合素質,有利于質量工作的規范開展;在進行文件的制定、修訂時,應充分結合企業經營實際情況,做到各環節可追溯,更好地滿足實際需求[9];采購人員應做好落實供貨單位審核、合同簽訂、質量驗收和質量清查這“四道質量關”,把假劣獸藥拒之門外[10]。藥品經營企業掌握存在的普遍問題,獸藥經營企業也可舉一反三,發揮主觀能動性,對獸藥GSP相關條款的內容,定期自查,對發現的問題整改完善,保證企業在取得獸藥經營許可證后質量管理水平不滑坡,為企業持續長遠發展提供堅實的質量保障[11]。
4.3 引導企業行業自律 “難在執行、貴在堅持”,一些企業對實施獸藥GSP不能從根本上準確把握和理解,只知道通過獸藥GSP事關企業生死,不知道實施獸藥GSP的最終目的和對企業長遠發展的重要意義。一次性的驗收達標容易,保持長久持續的符合要求則困難得多,需要引導企業在日常的經營活動中始終以質量安全為宗旨,以嚴格的制度為抓手,以規范的記錄為依據,把好獸藥經營的質量關,將GSP理念與日常經營工作扎實地結合在一起。
2020年10月起,上海開始推廣“證照分離”改革全覆蓋的舉措,獸藥經營許可證(非生物制品)的核發將改革為“告知承諾”,即一次性告知申請人申辦獸藥經營許可證應具備的條件和需要提交的材料,申請人承諾符合條件并提交材料的當場作出審批決定,現場檢查評定環節只能在事中事后監管時進行,這對經營企業的自律性有了更高的要求。為了維持獸藥市場秩序,維護公開、公平、公正的市場競爭環境,一方面要引導企業樹立“第一質量責任人”的主體意識,加強行業自律,提高企業貫徹落實獸藥GSP的自覺性和主動性[12],另一方面應逐步建立健全獸藥GSP長效監管機制及企業信用評級制度,監管部門根據企業信用情況進行定期或不定期突擊檢查,以了解企業真實情況,便于管理與監督,督促企業質量管理水平不斷提升[13],并將監督檢查情況定期向社會公開,接收社會監督,以促進企業的規范經營,使行業可以健康、快速的發展。

