2型糖尿病患者尿微量白蛋白與外周動脈疾病的相關性
謝沂均
廣州市第一人民醫院內分泌內科,廣東廣州 510080
目前全球有4.63億成年人患有糖尿病,其中1/2的糖尿病患者未被診斷[1]。2型糖尿病(type 2 diabetes mellitus,T2DM)發病的確切時間通常無法確定,在初次診斷2型糖尿病時,即可能合并糖尿病腎病(diabetic kidney disease,DKD),而也有部分糖尿病患者因無法愈合的下肢潰瘍來醫院就診,提示糖尿病合并外周動脈病變(peripheral arterial disease,PAD)。近年來,一些非傳統的危險因素,如腎功能損害成為動脈粥樣硬化臨床研究的熱點。糖尿病患者合并DKD后,心血管風險顯著升高[2]。研究表明,慢性腎臟病(chronic kidney disease,CKD)對PAD患者的發病率、病死率及醫療費用有極大影響[3]。該研究選取廣州市第一人民醫院內分泌內科2018年9月—2020年7月的T2DM患者468例,通過評估T2DM合并PAD患者糖尿病腎病進展,檢測尿微量白蛋白水平,分析尿微量白蛋白與PAD的相關性,旨在更深入地了解糖尿病患者微血管病變與大血管病變的關系,為T2DM患者早期診斷及預測PAD提供理論依據,現報道如下。
1 對象與方法
1.1 研究對象
回顧性選取于廣州市第一人民醫院內分泌內科住院治療的T2DM患者468例,其中男248例,女220例。納入標準:①年齡在18~80歲;②2型糖尿病符合《中國2型糖尿病防治指南》中的相關診斷標準;③無足潰瘍、壞疽及足部感染。排除標準:①其他類型糖尿病;②既往接受下肢手術;③有糖尿病急性并發癥;④嚴重心、腦血管疾病;⑤嚴重肝、腎功能不全。根據尿微量白蛋白排泄率分為無蛋白尿組(normal albuminuria,N組,165例)、微量白蛋白尿組(microalbuminuria,MICRO組,139例)、大量蛋白尿組(macro albuminuria,MACRO組,164例)。該研究經醫院倫理委員會審核批準,倫理號K-2020-109-01。
1.2 方法
收集患者的年齡、性別、病程、收縮壓(systolic blood pressure,SBP)、舒 張 壓(diastolic blood pressure,DBP)、合并視網膜病變(diabetic retinopathy,DR),體質量指數(body mass index,BMI)。禁食10~12 h,于次日晨空腹抽取肘靜脈血5 mL,室溫靜置約30 min,3 000 r離心10 min,提取血清,-80℃保存。采用OLYMPUS AU-5400全自動生化分析儀檢測空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(postprandial plasma glucose,PPG)、空腹C肽(C-peptide,Cpep)、餐后2 hC肽(2 hCpep)、血肌酐(creatinine,CR)、糖化血紅蛋白(glycosylated hemoglobin,HbA1c)、谷 丙 轉 氨 酶(alanine aminotransferase,ALT)、三 酰 甘 油(triglyceride,TG)、總膽固醇(total cholesterol,TC)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)、白蛋白(albumin,ALB)等,計算腎小球濾過率(estimated glomerular filtration rate,eGFR)。固定專人操作,美國GE LOGIQ E9型彩色超聲診斷儀檢查下肢血管,觀察管腔內膜中層厚度有無增厚、斑塊、狹窄形成,檢測部位為雙側股總動脈、股淺動脈、脛(前)后動脈、足背動脈。根據下肢動脈彩超進行外周動脈疾病的動脈硬化閉塞分級[4]。見表1。

表1 外周動脈硬化閉塞分級標準
1.3 統計方法
采用SPSS 26.0統計學軟件進行數據分析。正態分布計量資料以(±s)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,計數資料以[n(%)]表示,采用χ2檢驗。偏相關分析T2DM患者下肢血管病變分級與各指標的相關性。以P<0.05或P<0.01為差異有統計學意義。
2 結果
2.1 研究對象的一般資料
結果顯示,MACRO組、MICRO組與N組3組間的性 別、DBP、BMI、PPG、2 hCpep、ALT、TG、TC、LDL-C、HbA1c的差異無統計學意義(P>0.05)。與另兩組相比,MACRO組的年齡更大、糖尿病病程更長、SBP、FPG、空腹Cpep均較高,同時伴有明顯的腎臟損傷,eGFR較低,24 h尿蛋白定量及CR均較高。MACRO組的ALB均顯著低于N組及MICRO組(P<0.05),而DR率則高于N組及MICRO組。而MICRO組的年齡、糖尿病病程、SBP、FPG、空腹Cpep、24 h尿蛋白定量及CR處于中等水平,N組的則最小。患者的基本資料見表2。
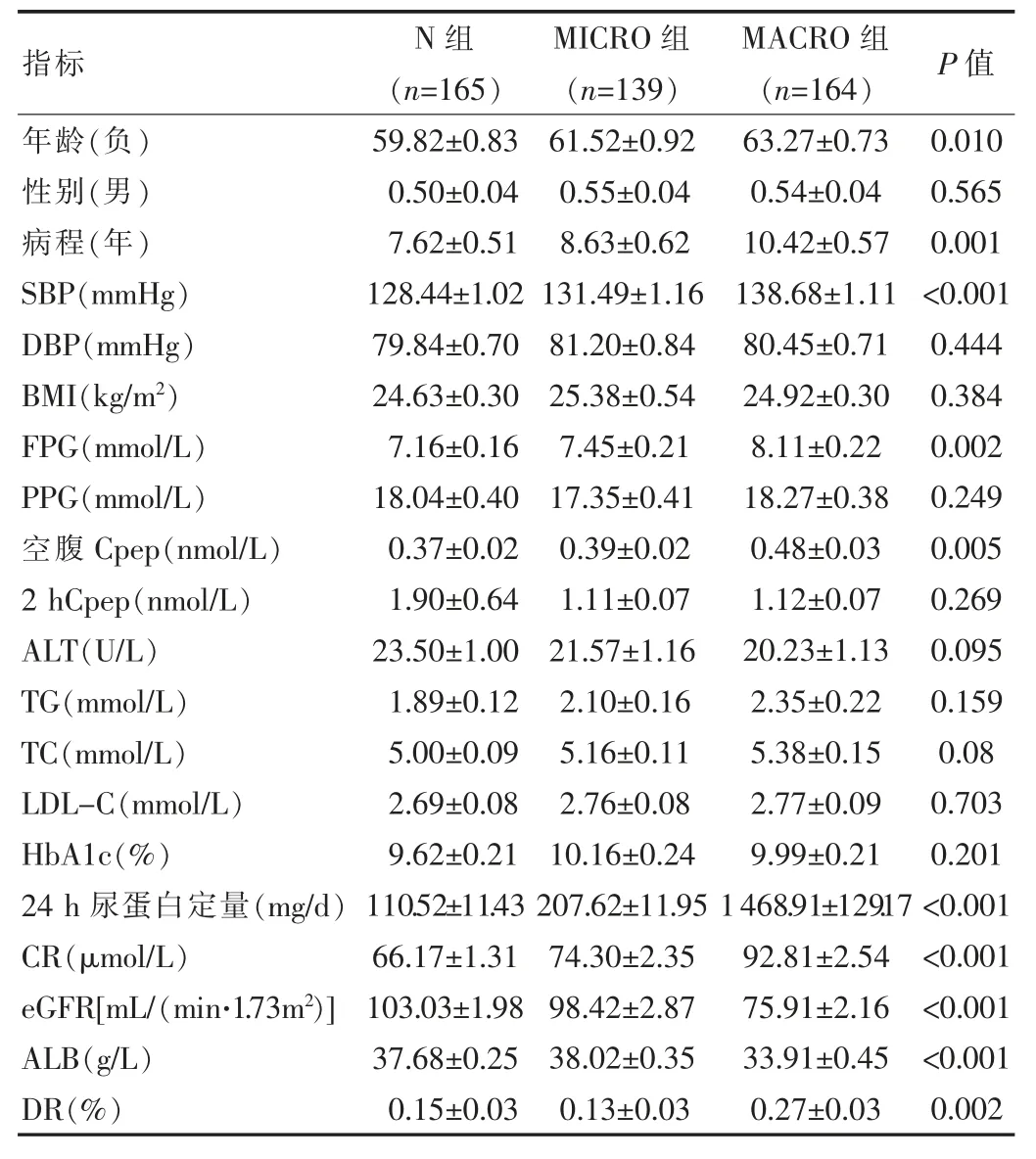
表2 研究對象的一般資料
2.2 尿微量白蛋白水平與PAD分級的關系
MACRO組的PAD分級高于MICRO組及N組,MICRO組的PAD分級高于N組,3組間差異有統計學意義(P<0.05),見表3。

表3 尿微量白蛋白與PAD分級
2.3 相關性分析
在校正其余混雜因素后,通過相關性分析顯示,尿微量白蛋白排泄率與24 h尿蛋白定量、PAD分級相關關系顯著,相關性密切,呈正相關(P<0.05),與TG、LDLC、TC關系較密切(P<0.05),與TG、LDL-C呈正相關,與TC呈負相關。見表4。
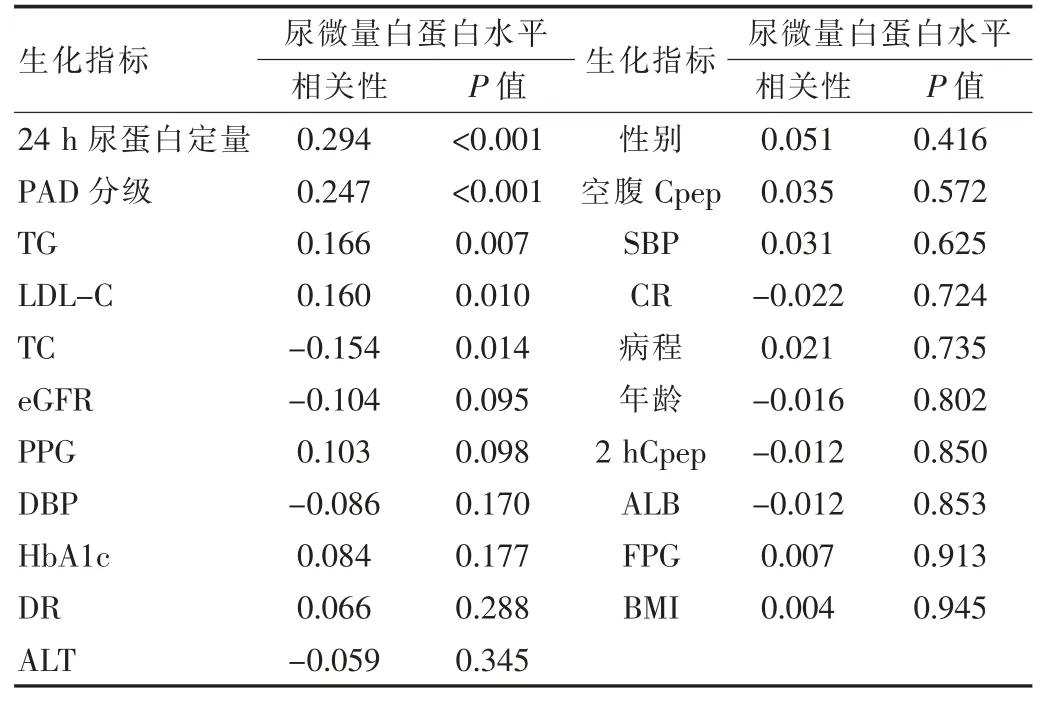
表4 相關性分析
3 討論
在長期研究中,確診為糖尿病20年以上的患者腎臟病變的累積發生率約為27%~60%,出現蛋白尿后10年終末期腎臟病(end stage renal disease,ESRD)的發生率約為10%~35%,伴有糖尿病的ESRD患者心血管疾病病死率更高,這可能是由于糖尿病加劇了患者動脈硬化的程度。事實上,大多數糖尿病腎病患者都合并心血管疾病。血糖升高以及糖尿病本身,通過多種機制,包括胰島素抵抗、炎癥、內皮功能障礙,以及葡萄糖對微血管的毒性作用,導致心血管疾病(cardiovascular disease,CVD)的風險增加[5]。糖尿病和慢性腎臟疾病都與CVD密切相關,控制血糖和血壓可以降低相關風險。值得注意的是,多數糖尿病患者死于CVD,并非CKD[6]。與糖尿病相關的,最常見和最典型的CVD是冠心病、腦血管病、外周動脈疾病和充血性心力衰竭。外周動脈疾病(peripheral arterial disease,PAD)好發于2型糖尿病患者,并與心血管疾病密切相關,是臨床上常見的糖尿病大血管并發癥之一,是下肢截肢的一個重要原因。一旦出現缺血性壞疽、間歇性跛行,其治療難度較大,不僅使患者感到生理上的痛苦,還會使患者經濟負擔逐漸增加。與1型糖尿病患者相比,2型糖尿病患者糖尿病足并發癥的患病率更高[7]。對于糖尿病患者來講,即使存在PAD,癥狀往往不典型,如缺乏間隙性跛行,靜息痛;另外一方面,足潰瘍的患者往往同時存在動脈鈣化,足部感染,水腫和周圍神經病。這些因素均導致PAD診斷比沒有糖尿病的患者更具有挑戰性。不到1/3的醫生認識到糖尿病相關的周圍神經病變的表現,即使患者有癥狀,而且,醫療專業人員對糖尿病足并發癥的綜合管理和治療缺乏了解[1]。糖尿病合并PAD預后較差,比多數惡性腫瘤的5年病死率還要高,接近于50%,進一步,糖尿病合并PAD的截肢患者2年內病死率即達50%。顯而易見,全面診治合并糖尿病的PAD患者至關重要。
如今,有關PAD的大多數研究都將踝肱指數(ankle brachial index,ABI)評估作為篩選測試。該測量是簡單、無創、無風險且廉價,正常ABI介于1~1.3[8]之間,0.91~0.99可接受,ABI低于0.9表示存在PAD。ABI具有較高的敏感性和特異性,但不能對所有類型的患者都達到如此高的準確率。老年人、糖尿病患者或腎病患者的動脈通常鈣化,且大部分存在血管硬化,導致此類病例的敏感性較差[9],對于一組患有PAD的患者,ABI似乎正常(1~1.3)甚至是超常(高于1.3)[9]。同時ABI僅在存在能夠降低踝部收縮壓的晚期動脈病變的情況下才導致異常,因此下肢的早期動脈粥樣硬化病變不能通過ABI測量來檢測[10]。該研究擬評估合并或不合并尿蛋白的糖尿病患者中發生PAD的風險,考慮在糖尿病患者或動脈鈣化的老年人中,ABI敏感性較低,容易出現假陰性,故對于PAD的早期識別,使用超聲作為無創影像學評估。血管彩超可以很好測量內中膜厚度、斑塊大小、明確斑塊性質,結合彩色多普勒成像及頻譜多普勒可以診斷動脈狹窄或閉塞的部位和程度。超聲檢查目前在臨床上作為篩查首選的檢查方法,可準確診斷病變部位及程度。一項研究比較了彩色多普勒成像和血管造影在51例患者的100條腿上的閉塞和狹窄,閉塞檢測的敏感性為95%,特異性為99%;狹窄檢測的敏感性為92%,特異性為97%[9]。總體來說,雖然ABI作為輔助診斷的初始臨床試驗是有用的,但ABI無法確定動脈狹窄或閉塞的位置。而血管超聲用于確定解剖、血流動力學和病變形態,被認為是診斷外周動脈疾病、揭示動脈閉塞和狹窄的金標準和非常有力的工具[10]。
CKD患者發生心血管事件的絕對風險與已有冠心病患者相似,而ESKD患者透析時發生心血管事件和死亡的風險是普通人群的40~50倍[11]。慢性腎臟疾病導致截肢率高1.8倍,且隨著慢性腎臟疾病階段的增加而逐步增加。慢性腎臟病使外周血管疾病患者的院內病死率增加,隨著慢性腎臟病分期升高,風險逐步增加。 慢性腎臟病4期和Fontaine IV期并存的患者的院內病死率最高。與整個PAD隊列相比,慢性腎臟疾病導致費用增加15%,住院時間增加21%。提示CKD對PAD住院患者的發病率、院內病死率、截肢、住院時間長短和報銷費用的階段性影響[12]。
糖尿病腎病的發生對糖尿病下肢血管病變有早期預警作用,風險的增加是多因素的,包括晚期腎功能衰竭與胰島素抵抗、高血壓、血脂異常[13]、血管鈣化[14]、慢性炎癥、蛋白質能量消耗和缺乏規律運動[15]等,有研究表明[16],大量蛋白尿可能是動脈硬化的早期指標。微量白蛋白尿作為糖尿病腎損害最早期、最敏感的指標之一,已被證實其出現可能提示T2DM患者存在全身廣泛的內皮細胞功能紊亂,包括全身的大動脈。既往研究證實[17],在糖尿病受試者中,合并白蛋白尿的患者患PAD風險是沒有蛋白尿的1.90倍,但并沒有對蛋白尿的程度進一步研究,同時,對于非糖尿病受試者,白蛋白尿的程度與PAD無關。一項研究表明[18],大量蛋白尿的患者空腹血糖、尿素氮、肌酐、收縮壓均大于無蛋白尿及微量蛋白尿的患者,下肢動脈病變發生率也明顯較高,但該研究針對下肢病變的調查主要采用問卷法,客觀性不足。中國臺灣的一項研究發現,在年齡超過50歲的2型糖尿病人群中,蛋白尿比eGFR<60 mL/min/1.73 m2更能說明周圍動脈疾病[19]。該研究中共采集了468例2型糖尿病患者的生化指標,其中分為無蛋白尿組、微量白蛋白尿急大量蛋白尿組,通過下肢動脈彩超評估下肢動脈硬化的程度,在調整了潛在的混雜因素后,發現2型糖尿病合并大量蛋白尿的患者動脈硬化閉塞程度更高,印證了大量蛋白尿的2型糖尿病患者下肢動脈病變率更高這一觀點。
作為糖尿病微血管和大血管并發癥之一,糖尿病性腎病和周圍動脈疾病均被認為是一種廣泛性的內皮功能障礙,由一氧化氮的生物利用度降低引起,實際上是在微量白蛋白尿發生之前[20]。腎小球內壓力升高會導致腎小球毛細血管脫落,一方面腎小球內壓力進一步升高,白蛋白通過腎小球毛細血管的滲透更大另一方面。確實,在2型糖尿病患者中,存在白蛋白尿時腎小球內壓較高。此外,在腎臟質量大量減少的患者,剩余的腎臟質量與尿白蛋白排泄成反比[21]。動物實驗也證明蛋白尿與動脈僵硬有關,蛋白尿抑制大鼠血管的擴張性、壁應力,表現為腸系膜阻力動脈橫截面積、內徑和外徑的減小[22]。實際上蛋白尿增多和心血管損害之間的潛在機制仍需進一步闡明。
該研究的局限性,研究對象僅源于該院內分泌內科的住院患者,可能存在一定的選擇偏移。該研究采用橫斷面設計,不能得出確定明確的因果關系。超聲檢查的準確性依賴儀器及操作者的水平,因此尚有一定的局限性。期待未來更多不同人群的大樣本、前瞻性研究來驗證這一觀點。
綜上所述,尿微量白蛋白較高的2型糖尿病患者下肢動脈硬化的風險相對增加,在今后的臨床隨訪中,通過檢測尿微量白蛋白的水平,可為2型糖尿病外周動脈疾病的早期診斷提供依據。

