宣恩火腿加工過程中蛋白質相互作用力變化
范露,郭官清,付宜萍,周辰,周利娟,許云峰,邱朝坤
(武漢設計工程學院食品與生物科技學院,湖北武漢430205)
宣恩火腿是我國湖北省恩施自治州一帶特產,以宣恩縣所產火腿最負盛名,其肉質細嫩、皮黃脂白肉紅、氣味鮮香宜人、滋味濃郁,在乾隆時期就作為貢品進貢朝廷,被譽為“中國四大名腿”之一[1]。
宣恩火腿要歷經十個月以上的加工周期,在此期間,腌制、烘腿、發酵等關鍵工序都會影響蛋白質的結構和相互作用力,對宣恩火腿風味和質地形成產生一定的影響。已有研究表明,蛋白質分子在展開過程中原來掩埋于蛋白內部的疏水基團會暴露于蛋白表面并與風味化合物發生共價結合[2],蛋白分子的疏水區域和巰基具有吸附性,可以增強蛋白質對風味的吸附能力[3],而二硫鍵能夠提高蛋白質被外界破壞作用的抵抗力,保護蛋白質免受快速水解的破壞[4]。
近年來關于豬肉及其制品蛋白質化學作用力的相關研究主要集中在原料肉[5-7]、西式蒸煮火腿[8-9]等,對干腌豬肉火腿以金華火腿為主[10],對宣恩火腿的研究鮮有報道。本課題對宣恩火腿加工過程中不同階段樣品蛋白質相互作用力變化進行測定,為探究宣恩火腿風味和質地的形成機理研究提供理論支撐,從而為宣恩火腿的現代化生產加工技術提供指導。
1 材料與方法
1.1 材料與儀器
火腿由湖北省思樂牧業集團有限公司提供,每個階段采集3支火腿,取股二頭肌用料理機攪碎后置于-18℃備用(為避免脂肪繼續氧化,一個月內完成所有指標測定)。宣恩火腿簡要工藝流程[11]:選腿→修胚→腌制→洗腿→整形→烘腿→入庫發酵→洗霉→修割→驗收。
本課題研究5個階段的樣品分別為原料腿、腌制期、發酵初期、發酵中期和成品腿,原料腿指用于生產制作宣恩火腿的新鮮豬腿(恩施本地黑豬),腌制期指腌制1個月的豬腿(用鹽量為每10 kg豬腿用鹽1 kg,分6~7次上鹽),發酵初期指發酵1個月的豬腿,發酵中期指發酵4個月的豬腿,成品腿指發酵7個月后經洗霉修割的豬腿。
氯化鈉、尿素、β-巰基乙醇、氫氧化鈉、硫酸銅、磷酸二氫鉀、磷酸二氫鈉、磷酸氫二鈉、溴酚藍、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、三氯乙酸、乙醇、乙酸乙酯、鹽酸胍、5,5'二硫代雙(2-硝基苯甲酸)[5,5'-dithiobis-(2-nitrobenzoic acid),DTNB](以上均為分析純):上海阿拉丁生化科技股份有限公司;鹽酸(分析純):平煤神馬集團開封東大化工有限公司試劑廠。
FE20型pH計:瑞士Metteler toledo公司;UV2000型分光光度計:美國Unico公司;AL-104型分析天平:瑞士Metteler Toledo公司;Neofuge 18R型高速冷凍離心機:香港Heal Force公司;XH-C型漩渦混合器:金壇市醫療儀器廠;THZ-82型水浴恒溫振蕩器:常州國華電器有限公司;FJ-200高速均質分散機:上海標本模型廠。
1.2 方法
1.2.1 蛋白質作用力的測定
參照 Gómez-Guillén 等[12]的方法稍加修改,稱取2.00g均勻的樣品于50mL離心管中,分別加入20 mL S1(0.05 mol/L NaCl)、S2(0.6 mol/L NaCl)、S3(0.6 mol/L NaCl+1.5 mol/L 尿素)、S4(0.6 mol/L NaCl+8 mol/L 尿素)、S5(0.6 mol/L NaCl+8 mol/L尿素+1.5 mol/L β-巰基乙醇)溶液,于10 000 r/min均質1 min,將離心管置于4℃下靜置2 h,用雙縮脲法測定上清液中蛋白質含量。S2與S1上清液中蛋白質含量之差表示離子鍵相對含量,S3與S2上清液中蛋白質含量之差表示氫鍵相對含量,S4與S3上清液中蛋白質含量之差表示疏水相互作用力大小,S5與S4上清液中蛋白質含量之差表示二硫鍵相對含量。各作用力的含量與上述4種蛋白質作用力含量之和的比值為該作用力的相對含量。每個樣品平行測定3次。
1.2.2 肌原纖維蛋白的提取
稱取10.00 g均勻的樣品,加入100 mL含15.6mmol/L Na2HPO4和3.5 mmol/L KH2PO4(pH7.5)溶液后勻漿,于4℃10 000 r/min下離心15 min,棄去上清液,沉淀用10倍體積含0.5 mol/L氯化鉀、15.6 mmol/L磷酸氫二鈉和3.5 mmol/L磷酸二氫鉀(pH7.5)溶液溶解,于4℃10 000 r/min下離心15 min,上清液即為肌原纖維蛋白提取液。
1.2.3 肌原纖維蛋白表面疏水性的測定
用肌原纖維蛋白與溴酚藍的結合量表征肌原纖維蛋白的表面疏水性,其測定方法參照Chelh等[13]的方法稍加修改,用0.1 mmol/L的Na2HPO4-NaH2PO4緩沖溶液(pH7.5)將5個階段的火腿肌原纖維蛋白濃度調整為5mg/mL。取1 mL該溶液,加入200μL 1 mg/mL溴酚藍溶液,渦旋振蕩混勻1 min,5 000 r/min下離心15 min,于595 nm處測定上清液吸光值。另取1 mL磷酸鹽緩沖液做空白對照組,每個樣品平行測定3次。表面疏水性按下列公式進行計算。
式中:200 為溴酚藍質量,μg;OD對照組為空白對照組的吸光值;OD樣品組為樣品組的吸光值。
1.2.4 肌原纖維蛋白羰基值的測定
參照Oliver等[14]的方法稍加修改,用0.1 mmol/L的Na2HPO4-NaH2PO4緩沖溶液(pH7.5)將5個階段的火腿肌原纖維蛋白濃度調整為2 mg/mL。取1 mL該溶液,加入1 mL 10 mmol/L DNPH溶液,空白組加入1 mL 2 mmol/L鹽酸溶液,于37℃水浴保溫1 h(期間每隔15 min漩渦混勻1次),加1 mL 30%三氯乙酸溶液,渦旋振蕩混勻30 s,冰浴保溫10 min,4 500 r/min離心15 min,沉淀用1 mL乙醇-乙酸乙酯(1:1,體積比)洗滌3次,靜置10 min,棄去上清液,沉淀用3 mL 6 mmol/L鹽酸胍溶液溶解,37℃水浴保溫30 min,4 500 r/min離心15 min,于370 nm處測定上清液吸光值,每個樣品平行測定3次。羰基值按下列公式進行計算。

式中:A為吸光值;3為反應液終體積,mL;1 000為單位換算系數;21為摩爾吸收系數,L/(mmol·cm);1為比色皿光程,cm;2為樣品中蛋白質質量,mg。
1.2.5 肌原纖維蛋白巰基和二硫鍵的測定
參照Yongsawatdigul等[15]的方法稍加修改,用0.1 mmol/L的 Na2HPO4-NaH2PO4緩沖溶液(pH7.5)將5個階段的火腿肌原纖維蛋白濃度調整為2 mg/mL。取1mL該溶液,加入8mL50mmol/L磷酸緩沖液A(8mol/L尿素、0.6 mol/L NaCl、10 mmol/L乙二胺四乙酸二鈉,pH7.5),再加入1.0 mL 0.1%DTNB溶液,40℃水浴保溫30 min,于412 nm處測定溶液吸光值,每個樣品平行測定3次。巰基含量按下列公式進行計算。
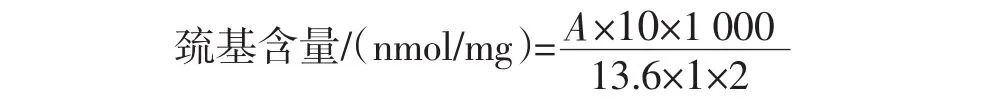
式中:A為吸光值;10為反應液終體積,mL;1 000為單位換算系數;13.6為摩爾吸收系數,L/(mmol·cm);1為比色皿光程,cm;2為樣品中蛋白質質量,mg。
活性巰基的測定用緩沖液B(0.1 mmol/LNa2HPO4-NaH2PO4緩沖溶液、0.6 mol/L NaCl、10 mmol/L 乙二胺四乙酸二鈉,pH7.5)替換緩沖液A,混合液在4℃水浴保溫1 h后,于412 nm處測定溶液吸光值,每個樣品平行測定3次。二硫鍵含量為巰基含量與活性巰基含量之差,每個樣品平行測定3次。
1.3 數據處理
所有試驗和測量均為3份,結果記錄為平均值和標準偏差。使用IBM SPSS Statistics 23對數據進行ANOVA差異顯著性分析,P<0.05為顯著性差異。
2 結果與分析
2.1 宣恩火腿加工過程中蛋白質相互作用力變化
宣恩火腿在不同加工階段,維持蛋白質結構穩定的主要化學作用力相對含量見表1。

表1 宣恩火腿不同階段各蛋白質作用力相對含量變化Table 1 Changes of relative content of protein interaction in different stages of Xuanen ham
從表1中可以看出,在宣恩火腿整個加工階段,離子鍵和氫鍵相對含量持續下降,尤其是在腌制期內,這種變化幅度更大,這可能與鹽分的大量滲入導致細胞內汁液和細胞間水分的流失有關。疏水相互作用和二硫鍵的相對含量則持續增加,且在發酵期內這種增幅更明顯,這可能與此階段蛋白質的降解、氧化等化學變化有關,蛋白質部分變性導致一些側鏈暴露出更多的疏水性氨基酸,其中一些巰基發生了一定程度的氧化形成了二硫鍵。
在原料期,穩定蛋白質結構的化學作用力依次為疏水相互作用>離子鍵>氫鍵>二硫鍵,且以疏水相互作用力(38.4%)和離子鍵為主(相對含量31.5%),這與其他學者的結果基本一致[16]。隨著加工的進行,受到加工條件和環境條件的變化,肌肉蛋白質發生了一系列的變化,維持蛋白質結構的化學作用力也隨之改變,對成品火腿而言,維持起蛋白質結構穩定的作用力以疏水相互作用力(49.7%)和二硫鍵(相對含量28.3%)為主。
2.2 宣恩火腿加工過程中肌原纖維蛋白表面疏水性變化
肌原纖維蛋白占到蛋白質總量的55%左右,它不僅在肌肉收縮中起重要作用,在肉制品加工過程中,與蛋白質的功能特性如凝膠特性、乳化特性等緊密相關,對肉制品的感官品質產生重要影響[7]。
蛋白質表面疏水性主要體現的是蛋白質表面疏水性氨基酸殘基分布的情況,它是體現蛋白質功能特性的重要指標之一[17],與氨基酸間的疏水相互作用及氧化有關[18]。常用溴酚藍結合量表征蛋白質的表面疏水性,宣恩火腿在不同加工階段肌原纖維蛋白溴酚藍結合量變化見圖1。

圖1 宣恩火腿加工過程中肌原纖維蛋白溴酚藍結合量變化Fig.1 Changes of the bromophenol blue binding amount of myofibrillar proteins in different stages of Xuanen ham
從圖1可以看出,從原料腿到成品腿,肌原纖維蛋白溴酚藍結合量顯著性上升(P<0.05),從9.09 μg增加到38.7 μg。在火腿整個加工階段,從原料期到腌制期,肌原纖維蛋白溴酚藍結合量從9.09 μg上升到13.3 μg,與廣式臘腸腌制期內肌原纖維蛋白表面疏水性變化趨勢一致[19],主要原因是鹽分的大量進入導致其含量的升高[20]。從腌制期到發酵初期,肌原纖維蛋白溴酚藍結合量從13.3 μg上升到25.4 μg,增幅在各階段中最大。肌原纖維蛋白的疏水性基團主要埋藏于蛋白質內部[21],火腿在腌制結束后進入烘房(50℃~55℃)烘腿7 d~10 d,在此期間,蛋白質發生部分變性,使得內部的疏水性基團暴露出來,增強了其表面疏水性。進入發酵期,肌原纖維蛋白表面疏水性進一步增加,但幅度已經減緩。此階段蛋白質在酶的作用下逐步水解,使得蛋白質分子重新取向定位[22],一些疏水性基團暴露出來,也增強了其表面疏水性。
2.3 宣恩火腿加工過程中肌原纖維蛋白羰基值變化
任何能引起肉類肌纖維膜系統破壞的處理過程,如絞碎、加熱等,都能導致易氧化的成分暴露于氧氣中,從而加速蛋白質的氧化[23]。有研究報道,蛋白質的氧化可影響其表面疏水性[24]。宣恩火腿在不同加工階段肌原纖維蛋白羰基值變化見圖2。
從圖2可以看出,宣恩火腿的羰基值從原料腿的0.68 nmol/mg增加到成品的2.28 nmol/mg。在發酵初期之前,羰基值沒有發生顯著性變化(P>0.05),進入發酵期后開始顯著上升(P<0.05),尤其在發酵中后期羰基值的增加更快。宣恩火腿在整個加工階段羰基值的變化趨勢與脂肪氧化有關,因為脂肪氧化產生的丙二醛等二羰基化合物可與肌球蛋白發生反應產生羰基[25],而宣恩火腿的脂肪氧化在中后期更加活躍[26]。羰基值與表面疏水性的變化趨勢基本吻合。
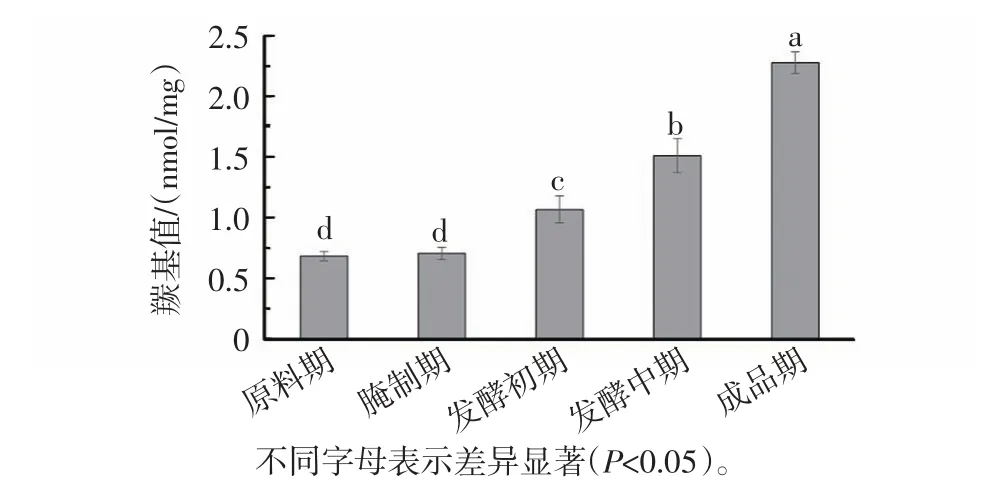
圖2 宣恩火腿加工過程中肌原纖維蛋白羰基值變化Fig.2 Changes of the carbonyl content of myofibrillar proteins in different stages of Xuanen ham
2.4 宣恩火腿加工過程中肌原纖維蛋白巰基和二硫鍵變化
天然蛋白質中的巰基主要包埋在蛋白質分子內部,但在蛋白質發生變性、水解、氧化等情況下,巰基暴露出來并被氧化形成二硫鍵,促進了蛋白質之間的相互交聯[27]。宣恩火腿在不同加工階段肌原纖維蛋白巰基和二硫鍵變化見圖3。
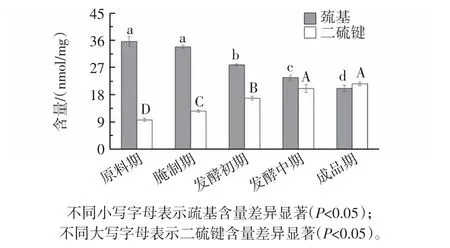
圖3 宣恩火腿加工過程中肌原纖維蛋白巰基和二硫鍵變化Fig.3 Changes of the sulfhydryl and disulfide bond content of myofibrillar proteins in different stages of Xuanen ham
從圖3可以看出,宣恩火腿巰基含量從原料腿的35.6 nmol/mg降低到成品的20.1 nmol/mg,二硫鍵含量從原料腿的9.65 nmol/mg增加到成品的21.6 nmol/mg,二硫鍵發酵期內快速增加與2.1中二硫鍵是穩定宣恩火腿蛋白質結構的主要化學作用力之一的結果相吻合,與其他學者相關研究也基本一致[7]。
3 結論
宣恩火腿在生成過程中蛋白質發生了不同程度的水解和氧化作用,維持其蛋白質結構穩定的作用力發生了明顯變化,成品火腿中貢獻度最大的是疏水相互作用和二硫鍵。疏水相互作用是維持蛋白質三級結構的主要作用力,它對蛋白質結構的穩定性、構象和功能性質具有重要作用,二硫鍵也是穩定蛋白質結構的重要化學鍵,二硫鍵的生成可以降低蛋白質的構象熵,使蛋白質達到穩定的結構和產生良好的熱穩定性。宣恩火腿在長達一年的生成周期內,蛋白質經過高溫、高鹽作用,以及漫長的發酵期,最終得到質地優良、風味濃郁的成品,與這些蛋白質作用力的轉變有重要關系。

