基于尿液代謝組學探討咸味致病的生物學機制?
鐘森杰, 李 靜, 李 琳, 黃淑敏, 楊 夢, 邱 宏, 程 彬, 胡志希
(湖南中醫藥大學中醫診斷研究所,長沙 410208)
咸味為五味之一,《黃帝內經》中提出咸味由水而生,而腎臟在五行中亦屬于水,同氣相求,據此明確提出咸味與腎臟相對應,即“咸入腎”理論。“咸入腎”指咸味藥食首先作用于腎臟,適量攝入咸味可補益腎氣,預防腎臟疾病;過度偏嗜咸味則會影響腎臟功能,并累及他臟而引發疾病,如“味過于咸,大骨氣勞,短肌,心氣抑”“多食咸,則脈凝泣而變色”等論述[1]。食鹽是生活中咸味的主要來源,已有大量研究證據表明,食鹽攝入過度是腎臟、心血管功能損傷的常見因素。這與傳統中醫理論觀點不謀而合[2-3]。
代謝組學是系統生物學領域的新興學科,旨在研究能反映生物體整體功能狀態的內源性代謝產物變化規律。代謝組學技術具有整體性、系統性的研究特色,與中醫學的整體觀存在共性,可作為中醫理論研究的延伸與擴展[4]。本研究運用基于氣相色譜-質譜聯用(gas chromatography mass spectrometer,GC-MS)的代謝組學技術,觀察高鹽飲食對生物體尿液代謝組學的影響,以期從系統生物學角度闡明過食咸味的影響,探討與之相關的病理變化機制,并為疾病預防和中醫理論客觀化發展提供新思路。本研究已通過湖南中醫藥大學實驗動物倫理委員會審查,倫理審查批準編號LL20190902402。
1 材料
1.1 實驗動物
SPF級雄性Sprague-Dawley (SD)大鼠16只,6周齡,體質量(200±10) g,購自湖南斯萊克景達實驗動物有限公司,許可證號SCXK(湘)2016-0002。所有大鼠飼養于湖南中醫藥大學實驗動物中心SPF級實驗室內,室溫18~25 ℃,相對濕度維持在50%~80%之間。
1.2 動物飼料
研究選用實驗大鼠普通飼料(0.4%Nacl濃度)與高鹽飼料(8%Nacl濃度),高鹽飼料由北京科澳協力飼料有限公司制作,質量合格證號1112621900016339。
1.3 試劑與儀器
甲醇(純度≥99.0%,Cas號67-56-1),美國Thermo科技有限公司;氯仿(純度>99.0%,Cas號67-66-3),上海沃凱化學試劑有限公司;甲氧基胺鹽酸鹽(Cas號593-56-6)、吡啶(Cas號110-86-1)、含1%TMCS的BSTFA試劑(Cas號25561-30-2),上海TCI工業發展有限公司。
7890B型氣相色譜儀,美國Agilent科技有限公司;Pegasus BT型質譜儀,美國Leco有限公司;H1650-W型低溫離心機,德國Eppendorf有限公司;BP-2010A型實驗動物血壓計,北京Softron有限公司;53050型真空濃縮儀,德國Eppendorf有限公司;QL-866型混勻儀,美國Vortex Mixer有限公司。
2 方法
2.1 飼養方法
所有大鼠給予普通飼料適應性喂養1周,隨后以隨機數字表法分為高鹽飲食組和正常對照組各8只。正常對照組繼續給予普通飼料飼養,高鹽飲食組給予高鹽飼料飼養,每只大鼠每天飼料20 g,自由取水。依據國內外的相關文獻報道[5-6],實驗大鼠在高鹽飲食8周后會出現血壓升高、心腎功能損傷等明顯的病理表現。故本研究的飼養時間為60 d。飼養期間動態監測大鼠的體質量及鼠尾血壓情況,飼養結束后收集大鼠的尿液樣本。
2.2 尿液樣本采集
尿液樣本采集前禁食12 h,采集實驗動物的晨間1 h尿液分裝至離心管,4 ℃條件下1000 r/min低速離心5 min,提取上清液置于液氮中速凍30 s,-80 ℃冰箱中保存直至上機檢測。
2.3 樣本處理
樣本在4 ℃下融化進行上機檢測前的處理。(1)每一樣本各取30 μL移至離心管中,加入1 mL乙腈:異丙醇:水溶液(3∶3:2,v/v/v,常溫),混勻1 min;(2)4 ℃條件下靜置3 min渦旋1 min,重復步驟1操作2次;(3)4℃12000 r/min離心10 min;(4)提取450 μL上清液于真空濃縮儀中濃縮,余下上清液保存備用;(5)樣本濃縮后加入80 μL甲氧胺鹽吡啶溶液(20 mg/mL)溶解,振蕩30 s,80 ℃條件下反應30 min;(6)加入100 μL含1%TMCS的BSTFA試劑,70 ℃條件下反應90 min,12000 r/min離心3 min,取上清液至檢測瓶中進行后續的上機檢測。
2.4 GC-MS檢測條件
氣相色譜儀采用DB-5 MS毛細管柱,1μL樣品通過自動進樣器以分流比10∶1的方式注入。溫度設置:進樣口為280 ℃,傳輸線為320 ℃,離子源為230 ℃。升溫程序的初始溫度為50 ℃,持續0.5 min,以15 ℃/min的上升速率升至320 ℃,并在320 ℃停留9 min。質譜儀采用范圍從75到650(m/z)的全掃描方法。
2.5 數據處理
GC-MS檢測后獲得可用于分析的原始數據,將其格式轉換后進行峰識別、峰過濾和峰對齊,獲得包含質核比、保留時間和峰面積等信息的數據矩陣。隨后進行總峰面積歸一化處理,以使不同量級的數據可進行比較。根據Kegg數據庫和Metabolon.inc數據庫對代謝產物進行鑒定與分類。
2.6 統計學方法
采用SIMCA-P(v13.0)軟件和R語言ropls包對處理后的數據進行主成分分析(principal component analysis,PCA)和正交-偏最小二乘判別分析(orthogonal partial least squares discriminant analysis,OPLS-DA),繪制相對應的得分圖。組間差異代謝產物鑒定基于OPLS-DA的第一主成分變量重要性值投影(variable important in projection,VIP),以VIP>1.2視為具有重要貢獻的變量,進一步采用單因素方差分析,以P<0.05為最終篩選條件。運用MetaboAnalyst 4.0通路分析軟件進行差異代謝產物的代謝路徑拓撲分析,以RawP<0.05且Impact>0為條件,篩選出富集性顯著的代謝路徑。
3 結果
3.1 體質量與血壓情況
表1示,高鹽飼養60 d后,高鹽飲食組與正常對照組比較,高鹽飲食組的鼠尾收縮壓、舒張壓均顯著升高,差異有統計學意義(P<0.01);體質量變化不顯著,差異無統計學意義(P>0.05)。

表1 2組飼養60 d后大鼠體質量與血壓比較
3.2 總離子流色譜圖
圖1示,GC-MS上機分析后,以離子強度為縱坐標、時間為橫坐標,繪制了2組大鼠的代表性總離子流色譜圖(total ion chromatogram,TIC)。
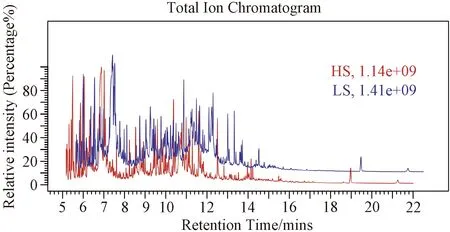
注:HS為高鹽飲食組(紅色),LS為正常對照組(藍色)
3.3 代謝輪廓分析
經PCA與OPLS-DA分析后得到相應的得分圖,以直觀反映2組之間的代謝輪廓差異。圖2示,2組的樣本點均位于置信區間內,分離趨勢明顯,2組之間無交叉與重合;圖3示,2組的樣本點均位于置信區間內,呈對稱分布趨勢,組內聚集良好,組間顯著分離。PCA與OPLS-DA得分圖反映了2組大鼠的代謝輪廓存在顯著差異,提示高鹽飲食組大鼠的內源性代謝功能受擾動。
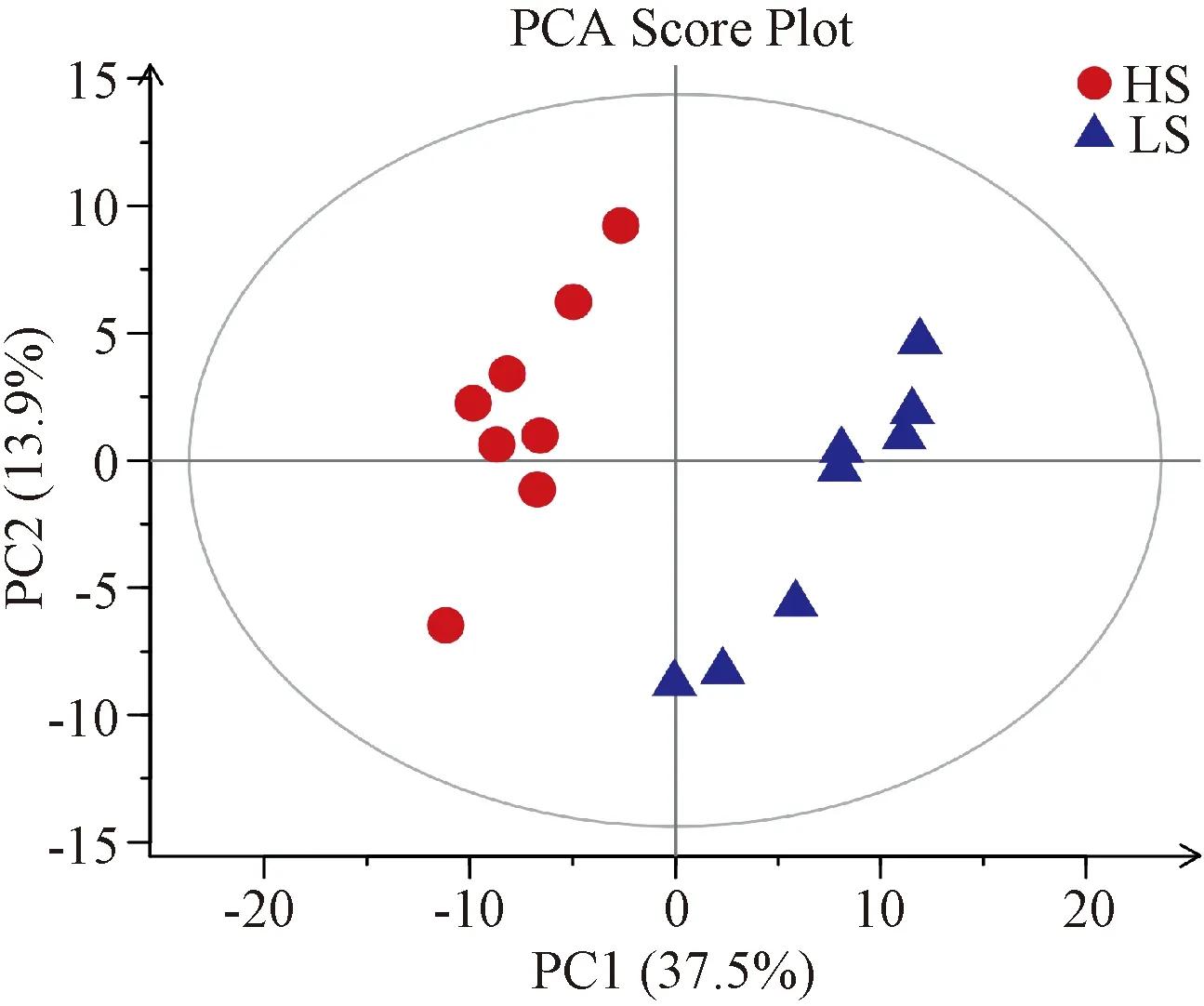
注:HS為高鹽飲食組(紅點),LS為正常對照組(藍點)
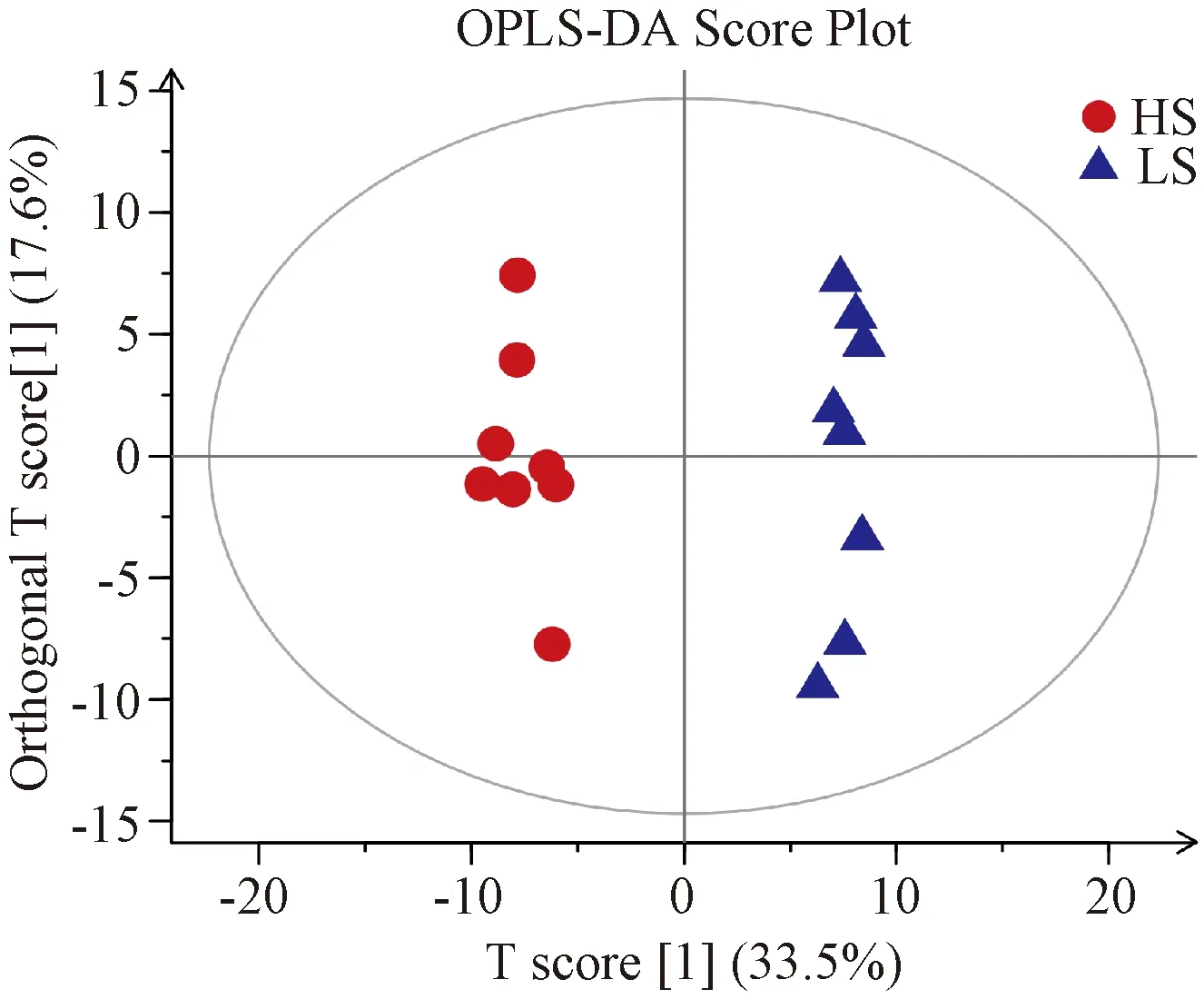
注:HS為高鹽飲食組(紅點),LS為正常對照組(藍點)
3.4 差異代謝產物篩選
表2示,本研究以VIP>1.2且P<0.05為篩選條件,挖掘出2組間的差異代謝產物共28種。與正常對照組比較,高鹽飲食組的甘露糖、腎上腺素、二氫鞘氨醇、愈創木酚、2-氨基苯酚、木糖醇、來蘇糖、蔗糖、核糖、蘋果酸、α-酮戊二酸、腐胺、延胡索酸、馬來酸表達水平上調;尿嘧啶、草酸、嘌呤核糖苷、N-乙酰基-D-甘露糖胺、2-脫氧-D-半乳糖、腺苷、甘露醇、葡萄糖酸、半乳糖醇、黃嘌呤、尿苷、β-丙氨酸、天冬酰胺、葡萄糖-6-磷酸表達水平下調,并通過Kegg化合物數據檢索代謝產物的相關ID號。
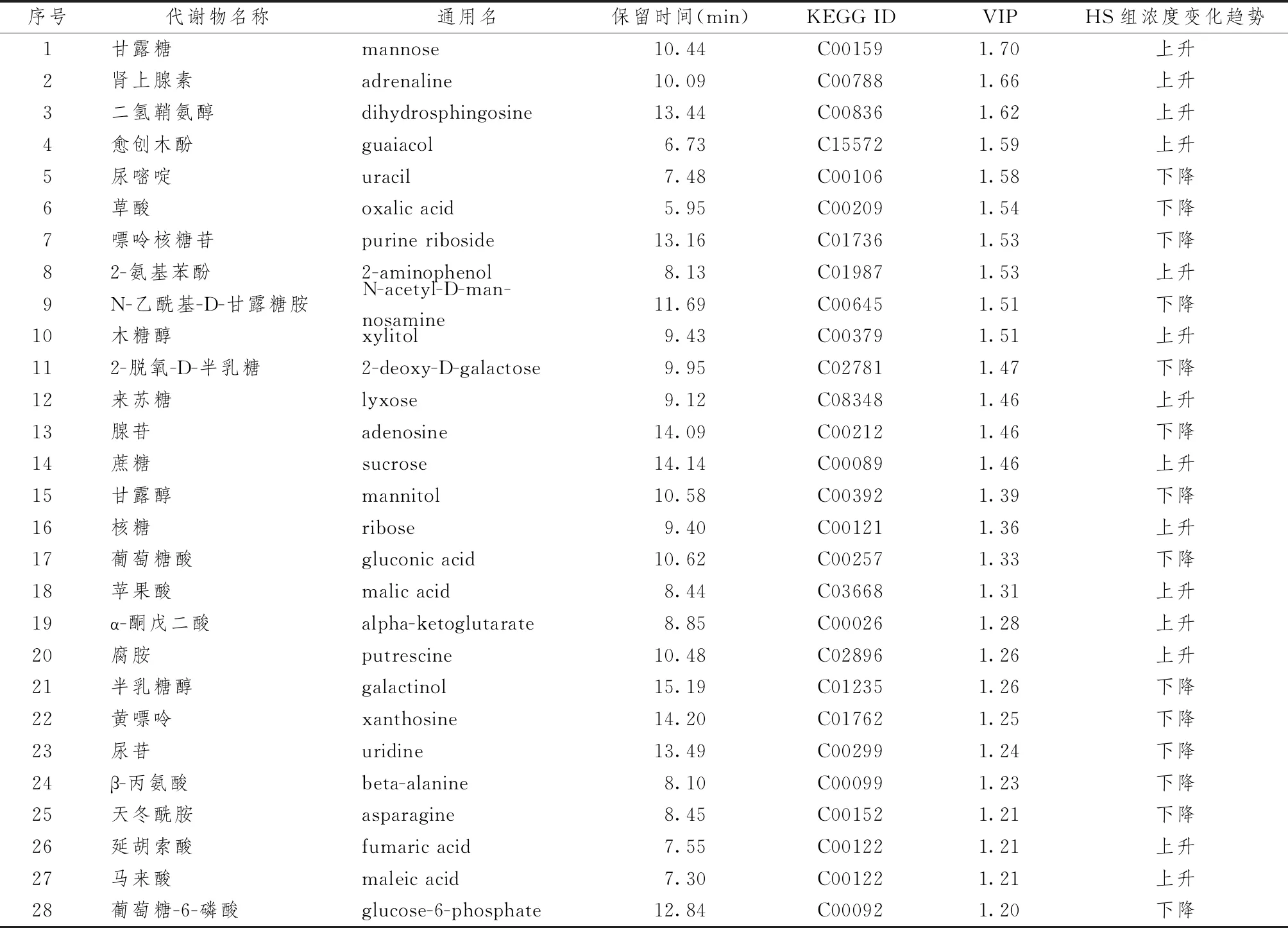
表2 差異代謝產物的基本信息表
3.5 代謝路徑分析
圖4示,代謝路徑概要分析結果顯示,與高鹽飲食組相關的28種代謝產物共參與22條代謝路徑,并繪制了代謝路徑概要圖。表3示,代謝路徑拓撲分析結果顯示,在RawP<0.05且Impact>0的條件下,共篩選出富集性較為顯著的6條代謝路徑,視為高鹽飲食組大鼠的顯著代謝路徑。顯著代謝路徑分別為半乳糖代謝(Galactose metabolism)、丙氨酸、天冬氨酸和谷氨酸代謝(Alanine, aspartate and glutamate metabolism)、嘧啶代謝(Pyrimidine metabolism)、淀粉和蔗糖代謝(Starch and sucrose metabolism)、泛酸和輔酶A生物合成(Pantothenate and CoA biosynthesis)、三羧酸循環(Citrate cycle)。

表3 顯著代謝路徑分析結果
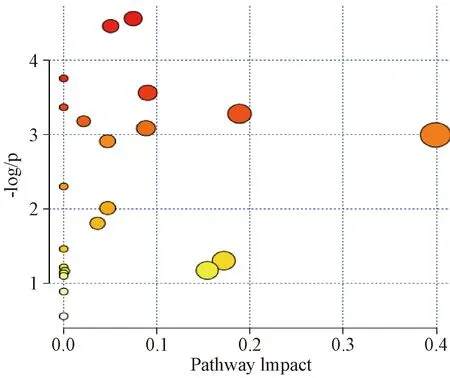
圖4 代謝路徑分析概要圖
4 討論
鹽的主要成分是Nacl,咸味則是Nacl離解的正負離子共作用的結果。鹽的攝入量增加可激活交感神經系統和腎素-血管緊張素系統(renin-angiotensin system,RAS)的活性,增加血容量,多種因素均可導致血壓升高[7]。RAS中血管緊張素Ⅰ活性增加,進而刺激腎上腺髓質分泌腎上腺素,因此高鹽飲食組的腎上腺素呈高水平表達。高血壓是持續高鹽飲食的病理表現,而血管炎癥則是高血壓的關鍵病理機制,炎癥反應可擾動細胞膜并影響細胞膜結構中的鞘脂類物質,體現在二氫鞘氨醇的水平紊亂[8]。腎上腺素、二氫鞘氨醇可作為鹽誘導高血壓的尿液代謝標志物,值得更為深入研究。
在已鑒定的差異代謝產物與顯著代謝路徑中,涉及糖類代謝的占比最重。2-脫氧-D-半乳糖、甘露糖和蔗糖參與了半乳糖代謝通路。半乳糖是食物中乳糖水解的產物,半乳糖被生物體吸收后在肝細胞內先后經過一系列酶促反應生成l-磷酸葡萄糖,并進入葡萄糖代謝途徑[9]。蔗糖、葡萄糖-6-磷酸參與淀粉和蔗糖代謝通路,淀粉由葡萄糖分子聚合而成,其被生物體攝入后,一部分經唾液淀粉酶水解為麥芽糖,另一部分經胰液淀粉酶水解為葡萄糖而被吸收利用;蔗糖由一分子葡萄糖的半縮醛羥基與一分子果糖的半縮醛羥基相互縮合脫水而成,在生物體內蔗糖酶的作用下可轉化為葡萄糖與果糖[10]。此外,葡萄糖經磷酸化生成葡萄糖-6-磷酸。葡萄糖-6-磷酸是糖酵解途徑的首個產物,同時作為起始底物參與磷酸戊糖途徑,它是各糖代謝途徑的共同中間體。上述產物與路徑反映糖代謝紊亂是高鹽飲食組大鼠的主要代謝表征,提示過食咸味可通過擾動體內的多種糖代謝途徑,最終影響葡萄糖的生成與利用。
在丙氨酸、天冬氨酸和谷氨酸代謝通路中,谷氨酰胺在線粒體內經脫氨反應轉化為谷氨酸,谷氨酸在谷氨酸脫氫酶、丙氨酸、天冬氨酸轉氨酶的作用下轉化為α-酮戊二酸,此通路的異常必然導致α-酮戊二酸水平紊亂[11]。α-酮戊二酸是生物體內三羧酸循環(tricarboxylic acid cycle,TCA)的關鍵中間產物,延胡索酸則是TCA的循環底物,上述物質代謝異常是TCA紊亂的標志[12]。機體獲得能量的TCA途徑受擾動,同時心臟產能的重要底物葡萄糖呈代謝紊亂狀態,將進一步影響心臟穩態和能量代謝,這也可能是在高鹽誘導的血壓升高后,繼而逐步導致心室肥厚、心功能衰竭等病理改變的關鍵因素[13]。
尿苷、尿嘧啶和β-丙氨酸參與了嘧啶代謝通路,β-丙氨酸和尿嘧啶參與了泛酸和輔酶A生物合成通路,上述兩條通路與眾多心血管疾病的形成密切相關。泛酸和輔酶A生物合成通路在脂肪酸的合成與氧化方面發揮著重要作用,通路紊亂可導致脂質過氧化反應,進而損傷血管內皮,影響血管的舒縮功能[14]。而在嘧啶代謝通路中,尿苷和尿嘧啶可通過改善心肌細胞線粒體功能和抗氧化系統從而保護心肌,尿液中2種代謝產物的表達水平異常反映機體的心功能受損[15]。
《彭祖攝生養性論》提出“咸多傷心”,即過食咸味會克伐心臟,損傷心之功能并影響血脈運行。基于本次研究結果發現,可能與心臟攝取能量的TCA途徑與葡萄糖代謝受抑制相關。心臟的能量代謝效率降低,氧化功能障礙,伴隨著耗氧量增加和舒縮功能減退,故可導致心悸、氣短、血流緩慢等表現,同時泛酸和輔酶A生物合成通路的異常可致過氧化物堆積,進一步加劇血液運行障礙。這也與中醫學理論關于過食咸味的“心氣抑”“脈凝泣而變色”等相關癥狀描述相契合。綜上所述,本研究從代謝角度初步闡述了過食咸味的影響及其致病的潛在生物學機制,發現過食咸味的影響機制涉及擾動糖代謝、能量代謝、嘧啶代謝、脂質代謝等多個層面,是一個多因素、多層次的復雜過程。研究結果進一步揭示了與中醫理論五味之“咸”相聯系的生物學信息,延伸與擴展了中醫學五味理論的研究內容,并為疾病的預防提供新思路。

