甲基營養型大腸桿菌構建策略的研究進展
陶雨萱,張尚杰,景藝文,信豐學,2,董維亮,2,周杰,2,蔣羽佳,章文明,2,姜岷,2
(1 南京工業大學生物與制藥工程學院,材料化學工程國家重點實驗室,江蘇南京 211816;2 南京工業大學,江蘇先進生物與化學制造協同創新中心(SICAM),江蘇南京 211816)
利用微生物發酵生產生物基產品符合“既要金山銀山,也要綠水青山”的可持續發展理念。近年來,生物制造產業蓬勃發展,已成為我國有經濟競爭性的新型戰略產業,前景光明。但是傳統的微生物發酵通常以谷物等農作物為原料,不僅原料成本高昂,而且面臨著“與民爭糧”、“與糧爭地”的爭議或技術經濟性問題。因此,尋找可再生、低成本的生產原料迫在眉睫。木質纖維素曾被認為是有效的替代品,但是木質纖維素的預處理成本高、水解抑制物去除難、發酵產物的產量低,制約了其進一步發展。作為化工業的重要產品,甲醇、甲烷、甲酸等一碳原料具有儲量豐富、來源廣泛、價格低廉等優點,深具改變傳統生物發酵生產模式的潛力[1]。此外,甲醇的還原度高于木質纖維素糖(葡萄糖、木糖等),其代謝過程中可以產生大量的還原力,是微生物生產還原性高附加值產品的優良底物之一,對實現谷物原料向“非糧”的轉移目標具有重要意義。
自然界中天然代謝碳一化合物的微生物包括真核和原核類的甲基營養菌。這些天然甲基營養菌能以甲醇等碳一化合物為唯一碳源,即通過同化代謝途徑將碳一化合物轉化為生物質,并通過異化代謝途徑從中獲得能量。甲醇的同化代謝途徑有核酮糖單磷酸循環途徑(RuMP cycle)、絲氨酸循環途徑(serine cycle)和木酮糖單磷酸循環途徑(XuMP cycle)3 種,后者僅存在于真核甲基營養菌中[2]。目前已在天然甲基營養菌中實現有機碳一原料到氨基酸、甲羥戊酸、正丁醇、戊二胺以及單細胞蛋白等多種化學品的生產(見圖1)。早在1986 年,研究者就以甲醇為底物,利用扭脫甲基桿菌(M.extorquensAM1)生產絲氨酸[3]。在2000 年,研究者們利用畢赤酵母(Pichia pastoris)、漢遜酵母(Hansenula polymorpha)等甲基營養酵母菌,以甲醇為底物生產單細胞蛋白用于動物飼料[4]。Liang等[5]通過在甲基營養菌M.extorquensAM1 中引入甲羥戊酸模塊,并通過代謝模塊優化、培養基優化和轉錄調節工程,最終的構建菌株可合成2.67g/L 的甲羥戊酸。Zhang 等[6]通過在畢赤酵母中引入番茄紅素的合成模塊,結合啟動子工程調控策略,使其番茄紅素產量可達0.714g/L,為目前報道的畢赤酵母最高水平。然而,由于大多數天然甲基營養菌的生長速率慢、異化代謝能力強,導致代謝物的生產效率低,并且缺乏有效的遺傳操作工具,限制了其在化學品生產方面的潛力[7]。
近年來,研究者致力于利用代謝工程、合成生物學以及進化代謝等技術手段,將大腸桿菌(Escherichia coli)、谷氨酸棒狀桿菌(Corynebacterium glutamicum)和釀酒酵母(Saccharomyces cerevisiae)等模式微生物改造為人工甲基營養菌,進而實現甲醇到各種化學品的生物合成。其改造策略的本質是將天然甲基營養菌中各種甲醇同化代謝途徑(包括核酮糖單磷酸途徑、絲氨酸循環途徑等)的關鍵催化元件和模塊整合到上述模式微生物中。本文介紹了天然甲基營養菌的多種代謝路徑,綜述了引入天然甲醇代謝路徑構建甲基營養型大腸桿菌的多種方法,總結歸納了不同代謝路徑的優化手段與改造成果,并對近年來基于計算機輔助設計合成的人工路徑進行了介紹,進而提出對合成路徑適配性改造和工程菌株耐受性提高的展望。
1 基于核酮糖單磷酸循環的甲基營養型大腸桿菌構建策略
甲基營養菌代謝甲醇的第一步是將甲醇氧化為甲醛。根據電子受體的類型,可將該酶分為依賴吡咯喹啉醌(PQQ) 的甲醇脫氫酶(methanol dehydrogenase,MDH)、依賴煙酰胺腺嘌呤二核苷酸(NAD) 的甲醇脫氫酶和依賴O2的甲醇氧化酶(alcohol oxidase,AOX)3類[8]。隨后甲醛進入3種不同的同化路徑,即核酮糖單磷酸循環、絲氨酸循環和木酮糖單磷酸循環。基于生物量、能量和輔因子的產生能力分析發現,依賴NAD 的甲醇脫氫酶和磷酸核酮糖途徑(RuMP)被認為是在模式菌株中組裝甲醇代謝途徑的最優選擇[9]。
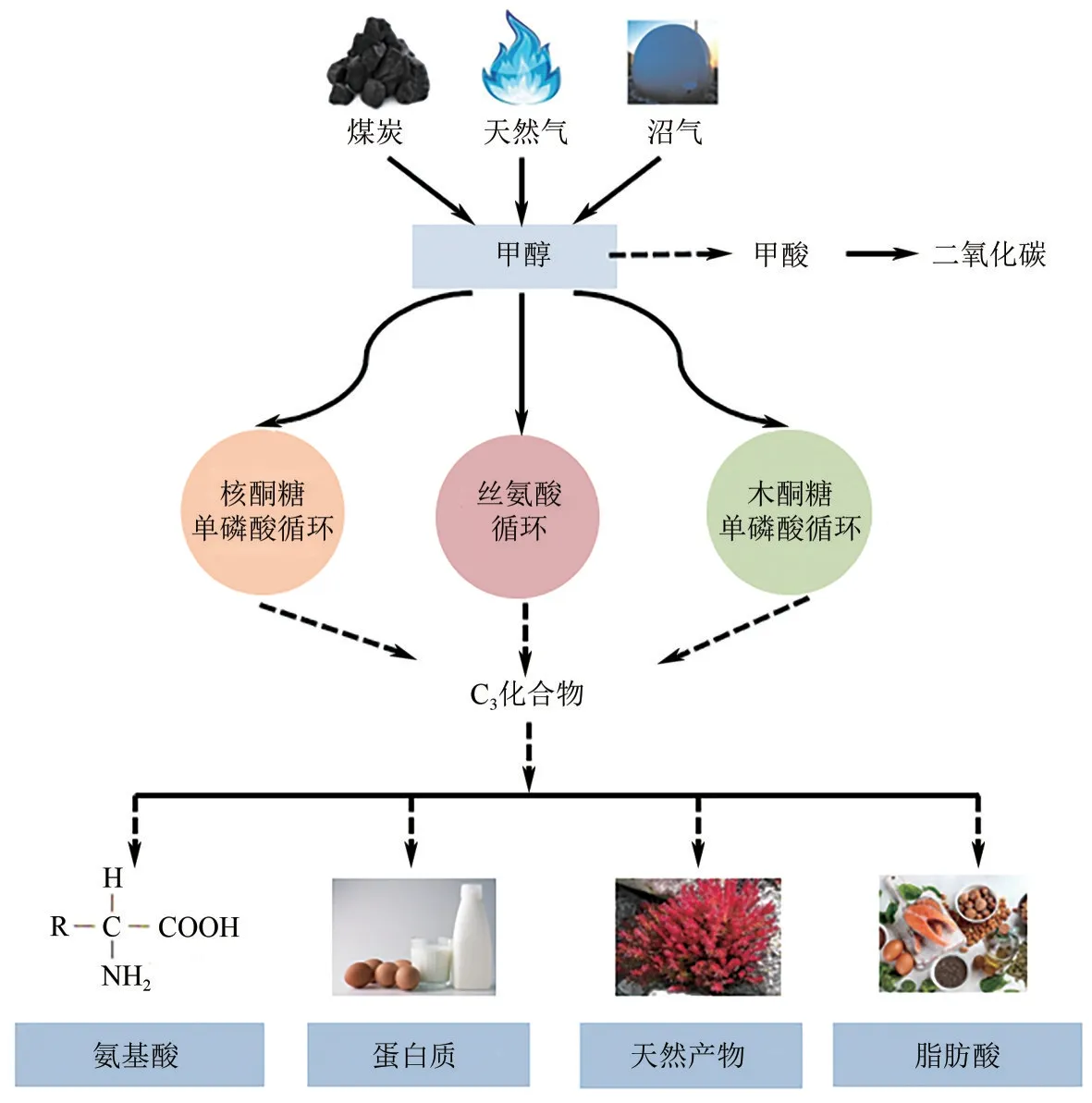
圖1 以甲醇為原料生產各種化學品示意圖
RuMP 途徑是目前甲醛同化效率最高的途徑,可分為3個部分——氧化部分、裂解部分和重排部分[9]。氧化部分,甲醛與5-磷酸核酮糖(Ru5P)縮合并異構化生成關鍵產物6-磷酸果糖(F6P),該反應由兩個關鍵酶3-己酮糖-6-磷酸合成酶(3-hexulose-6-phosphate synthase,HPS)和6-磷酸-3-己糖異構酶(6-phospho-3-hexuloisomerase, PHI)催化[10]。F6P 在細胞內一般通過糖酵解途徑(EMP)、Entner-Doudoroff 途徑(ED)和磷酸戊糖途徑(PPP)進行代謝。隨后F6P被裂解成3-磷酸甘油醛(GAP)和二羥丙酮磷酸(DHAP),最后GAP 和景天庚酮糖-7-磷酸(S7P)被轉酮醇酶(transketolase,TK)重排為兩個五碳糖磷酸酯,后者進一步轉換為Ru5P(圖2)。相關研究表明,Ru5P的再生是維持循環運行的關鍵[20]。
1.1 優化關鍵酶的催化能力
Müller 等[11]最先在工程菌株中實現甲醇異化和同化,并利用合成生物學的方法將來源于甲醇芽孢桿菌(Bacillus Methanolicus)的甲醇代謝模塊成功引入大腸桿菌。研究者們認為實現甲醇利用的最有效方法是組裝NAD 依賴的甲醇脫氫酶以及基于HPS-PHI 的甲醛同化模塊,通過在大腸桿菌中表達甲醇芽孢桿菌(B.Methanolicus)的MDH2、HPS和PHI 基因,Müller 等[11]構建了RuMP 循環,使甲醇在中心代謝中的通量達到了40%。Whitaker 等[12]根據大腸桿菌的最適生長溫度,篩選出嗜熱脂肪芽孢桿菌(Bacillus Stearthermophilus)的MDH與來自甲醇芽孢桿菌的HPS和PHI,并引入工程大腸桿菌中,大幅提升了甲醛消耗量,且其構建后的工程大腸桿菌菌株MDH 活性與天然甲基化營養菌的活性相似。
以往對甲基營養型大腸桿菌進行改造的研究中,大多集中在酶方向,其改造效果受到甲醇脫氫酶動力學不利因素的影響。Wu 等[13]提出甲醇芽孢桿菌的MDH依賴于內源激活蛋白(ACT),并且對甲醇表現出較低的酶特異性。研究者們從Cupriavidus necatorN-1 分離純化出對甲醇親和力高、中溫條件下無需活化的MDH2,以此為基礎構建了MDH2的變異體(CT4-1),使Kcat/Km值(酶的二級常數)提升了6倍,大幅提升了催化甲醇的效率[13]。針對依賴NAD 的MDH 中溫條件下熱力學特性較差的問題,Price 等[14]發明了超分子酶組裝方法,利用SH3-配體相互作用將MDH、HPS 和PHI組裝成工程超分子酶復合物,并在大腸桿菌中進行酶組裝,將甲醇消耗率提高了9倍,為工程菌株的MDH酶活改善開辟了新的方向。

圖2 基于RuMP路徑的優化改造[11-19]
1.2 增強Ru5P再生與利用率
在天然RuMP 路徑中,Ru5P 不足是微生物無法擁有高甲醇通量的主要制約條件。Ru5P 耗盡一方面導致甲醛的積累,細胞無法耐受高濃度的甲醛毒性,另一方面無法維持循環,限制了甲醇的持續利用。因此,提升Ru5P 的再生能力是構建工程菌株的關鍵問題。目前解決此問題有多種研究策略,一種是抑制F6P 進入糖酵解途徑以提升F6P 的含量,進而增強Ru5P 的再生,另一種是引入甲基營養菌的優勢轉化基因以驅動大量Ru5P的生成。
在底物方面,工程菌株不能像天然甲基營養菌那樣以甲醇為唯一碳源進行代謝,為了提高甲醇的摻入量以增加甲醇利用率,通常加入碳源或氨基酸作為共底物。Gonzalez等[15]評估了25種不同的共基質對甲醇的同化作用,比較了多種氨基酸底物對甲醇利用的影響,發現蘇氨酸的利用可提高甲醇利用率,并且其調節機制受亮氨酸反饋調節蛋白(LRP)的影響。通過敲除LRP,工程菌株在甲醇中的生物量比對照組高出34%,間接改善了甲醇的同化效率[15]。Meyer 等[16]選用葡萄糖酸鹽和甲醇共底物以提供5-磷酸戊糖,進一步提高中間體5-磷酸核酮糖的利用率,使高達24%的甲醇進入中心代謝途徑。He 等[17]通過氧化肌氨酸生產甲醛,外源添加木糖生成5-磷酸木糖,進一步合成5-磷酸核酮糖以避開再生循環,增強了Ru5P 的直接利用率。
在代謝通量方面,Bennet等[18]通過敲除磷酸葡萄糖異構酶基因(PGI),重建了G6P 的代謝途徑,在一定程度上降低了糖酵解的代謝通量,改善了甲醇和葡萄糖的共同利用。研究者們通過引入甲醇芽孢桿菌的5 種酶基因,即核酮糖磷酸異構酶(RRE)、果糖-二磷酸醛縮酶(FBA)、磷酸果糖激酶(PEK)、轉酮醇酶(TKT)和景天庚酮糖二磷酸酶(GLPX),強化了大腸桿菌F6P 到Ru5P 的轉化,提升了甲醇的同化能力,使PGI缺陷菌株的丙酮酸效價提升了110%[18]。Woolston等[19]使用抑制劑碘乙酸降低糖酵解通量,并在大腸桿菌中過表達GLPX,激活了RuMP 的景天庚酮糖磷酸酶(SBPase)變體,以提升S7P 的合成量進一步提升Ru5P 的再生能力(圖2),維持循環的同時降低了細胞內的甲醛濃度,并使甲醇通量增加了2倍。
這些實驗結果從底物、酶、循環維持等多個方向著手,在大腸桿菌中優化引入RuMP途徑的實踐中有了突破性的進展(見表1),優點是大幅度提高了甲醇氧化的代謝通量,缺點是工程菌株始終無法直接高效地利用甲醇。而在2020 年,Chen 等[21]通過基因編輯技術與拷貝數變異(CNVs)緩解了大腸桿菌在甲醇中的生長障礙——DNA-蛋白質交聯(DPC),并通過適應性進化使菌株突變,平衡了代謝通量,最終實現了以甲醇為唯一碳源生長;其合成甲基營養型大腸桿菌的倍增時間為8.5h,甲醇耐受性可達1.2mol/L。

表1 基于RuMP路徑的大腸桿菌構建策略
2 基于絲氨酸循環的甲醇代謝路徑構建與優化
在絲氨酸途徑中,甲醛和四氫葉酸(H4F)可自發轉化為亞甲基四氫葉酸;也可先轉化為甲酸鹽,再通過H4F依賴型酶轉化為亞甲基四氫葉酸。絲氨酸羥甲基轉移酶(serine hydroxymethyltransferase,SHMT)催化甲醛與甘氨酸的加成,從而生成絲氨酸[24]。循環的碳同化部分包含3個部分,涉及碳二(C2)、碳三(C3)和碳四(C4)代謝物。碳二代謝物包括乙醛酸、甘氨酸和輸出的乙酰輔酶A。在碳三化合物生成部分,SHMT 催化甘氨酸和5,10-亞甲基四氫葉酸反應生成絲氨酸(C3),絲氨酸進一步轉化為磷酸烯醇式丙酮酸(PEP)(C3)。隨后PEP 經羧化酶羧化后生成碳四化合物草酰乙酸(OAA),最后草酰乙酸轉化成兩個碳二化合物并產生乙酰輔酶A[圖3(a)][24]。
Methylobacterium extorquensAM1 是一種兼性甲基營養細菌,也是研究甲基營養菌生物化學和遺傳學特性的模式菌株。Kalyuzhnaya等[25]從該菌株中發現了QSCR 能夠調節絲氨酸循環中關鍵酶的活性,并影響絲氨酸循環基因的轉錄,實驗證明其與編碼大部分絲氨酸循環酶的兩個操縱子的啟動子(QSC1 操縱子的SGA-HPR-mtDA-FCH 和QSC2 操縱子的mtkA-mtkB-PPC-MCLA)相互作用。后續實驗預測了QSCR 的基因結合位點,表明H4F參與的循環模塊受到QSCR的激活調節,并證明了甲酰四氫葉酸的積累能直接激活QSCR以結合調節的啟動子,使絲氨酸C1轉移途徑基因的轉錄增加,進一步提高了轉化率[26],為后續構建大腸桿菌的絲氨酸代謝奠定了基礎。
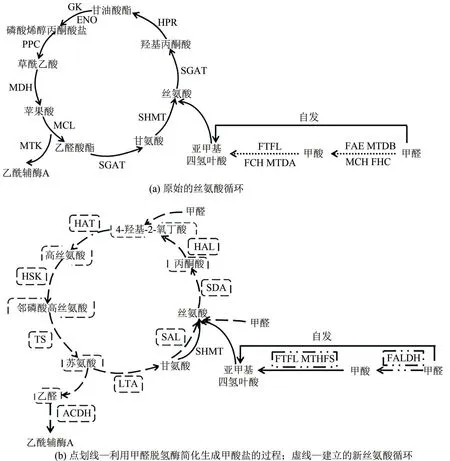
圖3 基于絲氨酸循環的優化改造[24,26-28]
Yu 等[24]因大腸桿菌難以直接利用甲醇,對AM1 中的天然絲氨酸循環進行了修改。一方面為縮短甲醇的氧化流程,研究者利用依賴NAD 甲醛脫氫酶(FALDH)來簡化甲醛氧化成甲酸鹽的過程,并將甲酸鹽轉化為亞甲基四氫葉酸以提供碳一載體;另一方面,丙氨酸轉氨酶(AGT)催化乙醛酸轉氨生成甘氨酸,取代了天然途徑的氨基供體絲氨酸,將甘氨酸與上述亞甲基四氫葉酸合成完成修飾途徑絲氨酸的生成[圖3(b)]。為了避免天然絲氨酸循環中有毒中間體羥基丙酮酸的形成,減少對中心代謝通量的干擾,Leander 等[27]通過引入天然蘇氨酸裂解酶,使大腸桿菌中整個細胞的甘氨酸需求由蘇氨酸的生物合成和降解來提供,構建了絲氨酸-蘇氨酸循環,為實施甲酸在大腸桿菌中代謝提供了可行的方向。
為最大限度地提高生物質量,提升熱力學優勢,He 等[28]進一步優化了絲氨酸循環以提高大腸桿菌對甲醛的利用率。通過絲氨酸醛縮酶(serine aldolase, SAL)將甲醛與甘氨酸縮合生成絲氨酸,再由絲氨酸脫氨酶(serine deaminase, SDA)脫氨為丙酮酸,此過程取代了原有復雜、多ATP 消耗的甲醛同化路徑;隨后由4-羥基-2-氧丁酸(HOB)醛縮酶催化生新C4中間體HOB,氨化生成絲氨酸。此路徑以高效簡潔的甲醛同化反應取代羧化反應,所需酶數量(8種)僅為天然路徑的1/2,在節省能量、提升循環效率、依賴性小、符合熱力學驅動力等多方面具有絕對的優勢。
雖然絲氨酸循環的同化效率不如RuMP 路徑,但是引入絲氨酸循環能夠從產物乙酰輔酶A衍生更多的高價值產物,如乙醇、丙酮、丁酸等。此循環更有利于合成多碳化合物,對于衍生物的開發也更具有研究性。此外,與天然好氧的甲醇同化途徑相比,絲氨酸循環不依賴氧氣,是非常有價值有競爭力的甲基化工程菌株構建路徑(見表2)。但是天然絲氨酸循環由于存在中心代謝反應較多、循環ATP低效等問題,在熱力學、動力學、同化效率等多個方面,仍然存在著許多缺點需要攻克。

表2 基于絲氨酸循環的大腸桿菌構建策略
3 基于計算機輔助設計的人工合成路徑
盡管在缺乏一碳合成代謝途徑的生物中(如大腸桿菌、釀酒酵母)構建天然甲基營養型菌株的代謝路徑已經取得了許多突破,但天然甲醇代謝路徑存在的固有缺陷無法完全克服,這些問題包括路徑復雜性、環境敏感性、氧氣依賴性、同化低效性、動力學熱力學劣勢等。在合成生物學中利用碳一原料的最理想途徑應該具有如下特點:①依賴的酶數量少;②反應步驟短,并且與其他代謝途徑分離,避免中心代謝流通量的沖突;③驅動力強;④在好氧和厭氧條件下都能高效地發揮功能[27];⑤能快速代謝有毒中間產物等。研究者們以此為目標,設計了比天然路徑更為合理的人工一碳利用路徑(圖4)。

圖4 人工合成甲醇代謝路徑[29-32]
Siegel 等[33]利用計算機設計了一種甲醛酶(FLS),是設計催化酶活性的全新方法,它能夠實現碳一到碳三化合物的合成,可以催化3個甲醛分子合成一個二羥基丙酮分子。以此酶可以構建一種新的甲醛酶途徑,使甲醛轉化為中心代謝物二羥丙酮磷酸(DHAP)。使用計算機輔助蛋白質設計開辟了新的酶設計領域,適用于在體外構建固定碳的人工途徑。
為簡化代謝步驟,Wang 等[29]在大腸桿菌內高效表達了甲醇芽孢桿菌依賴NAD+的MDH和一種計算機設計的甲醛酶(FLS),組裝了人工線性甲醇同化途徑。此線性途徑不需要甲醛受體,由兩個酶主導完成反應:先利用甲醇脫氫酶將甲醇氧化成甲醛,再利用甲醛酶將甲醛碳化成二羥丙酮[29]。以上述最優途徑法則來評估,此線性途徑雖在熱力學上不如天然RuMP途徑有利,但能直接生產C3中間體DHA,可以快速進入糖酵解并完成代謝以提供強大的驅動力,在工程大腸桿菌進一步提高甲醇利用率的探索中實現了全新的構想。
乙酰輔酶A作為乙酰基的唯一供體,是許多工業化學品C2基團的供體。前文有提到利用改進的絲氨酸循環還將甲醇和碳酸氫鹽生產乙酰輔酶A,但Lu 等[30]設計了一條全新的、不與已知代謝途徑重疊的合成乙酰輔酶A(SACA)的途徑。SACA途徑對乙醇醛合成酶和乙酰磷酸合成酶進行了改造,將乙醇醛合成酶的催化活性提高了70 倍以上。通過此途徑,可以實現由甲醛等多種碳一生物合成乙酰輔酶A[30]。SACA 途徑具有合成途徑短、熱力學化學驅動力強勁、不依賴氧氣等多種優勢,為將來使用多種碳一底物生產乙酰輔酶A及其衍生物創造了可能性。
Yang 等[31]利用COMB-FBA 的組合算法篩選出最合適的苯甲酰甲酸酯脫羧酶(Gals)和轉醛縮酶(TalBF178Y)兩種工程酶進行人工反應,通過新的組合計算方法,從選擇酶和改進工藝方面入手,研究者們在體外構建了一條新的C1同化途徑即乙醇醛同化(GAA)途徑,使其碳轉化率達到了88%。
碳一人工合成路徑的創建目標明確,在已知天然路徑缺陷的基礎上,設計全新的簡化路徑以提升合成效率,往往以最適用于工程菌株、最簡單化代謝路徑、最符合動力學驅動力等為標準,以計算機以及各種新型算法為輔助篩選最適用反應的酶以大幅提升酶活性,將在甲醛代謝通量方面取得較大的突破(見表3)。

表3 人工合成甲醇代謝路徑的構建策略
4 結語及展望
全球氣候變化引起了人們對當下能源結構的擔憂,大量化石燃料的使用產生的溫室氣體嚴重破壞了環境。在環境友好的同時保證能源的供應,依靠微生物利用可再生資源合成生物燃料是一個重要的解決方案。
生物制造業迫切需要改善微生物中原有碳同化途徑,然后引導這些途徑的代謝流通過各種自然或設計的途徑高效地生產目標產物。就微生物發酵底物而言,碳一化合物以其豐富的來源而頗具優勢。但以甲醇為例,雖然其中一些化合物或中間體可以從天然的甲基營養菌的各種代謝途徑中產生,但這些天然代謝途徑往往需要優化或重新設計,將繁瑣的長路徑簡化并提高甲醇的同化效率。本文主要綜述了將天然甲醇代謝路徑引入大腸桿菌的研究進展,并概述了與之相關的一些人工合成路徑。
針對菌株的耐受性問題,可從以下3個方面考慮。第一,提升菌株的甲醇耐受性。一方面對天然甲基營養型菌株的甲醇耐受性進行比較,挑選出耐受性較好的菌株分析其基因組信息,獲得潛在的耐受元件并導入工程菌株中驗證;另一方面,采用等離子體、常壓室溫等離子體(ARTP)等誘變技術,篩選出甲醇耐受性強的菌株。第二,為減少甲醛對細胞的毒性,可強化已有代謝酶的表達,提升甲醛的代謝效率;也可外源引入甲醛代謝途徑,多途徑提升甲醛的代謝通量;亦可通過人工合成酶簡化甲醛原有的代謝路徑。第三,通過工程菌進化以進一步適配天然代謝路徑,比如可采用適應性實驗室進化(ALE),通過提高細胞對甲醇的耐受性來提高合成的甲醇營養菌的甲醇生物轉化率。原始的天然合成路徑需要從各個方面不斷優化,如酶活性、代謝通量、動力學優勢等,從底物優化、代謝路徑簡化、酶活提升等各個方面強化甲醇的利用。最后,隨著計算機算法的先進與科研的不斷發展,人工合成的新路徑是一個突出的研究方向,其目的性明確、篩選精準、對于特定產物有針對性的產量強化,在未來的工業應用方面具有很強的可塑性,可將高效的人工合成酶與耐受性強的工程菌株相結合,引入優化的甲醇代謝路徑,從多方面著手,突破現有的甲基工程菌株的構建瓶頸。

