精源性卵母細胞激活因子的相關機制研究進展
紀麗軒 高玉平
上海交通大學醫學院附屬新華醫院生殖醫學中心(上海 200092)
通常認為卵母細胞在成熟分裂促進因子(maturation-promoting factor,MPF)和細胞生長抑制因子(cysostatic factor,CSF)的作用下,發育并停滯于第二次減數分裂中期,在精子或某些理化因素的刺激下卵母細胞才能恢復并完成減數分裂,這一過程稱為卵母細胞激活(oocyte activation,OA)[1]。1990年,Swann等人通過將精子內提取物注射入卵母細胞內,并觀察到受精成功的信號——鈣離子振蕩,首次提出關于“精子因子”的證據[2]。精源性卵母細胞激活因子(sperm-borne oocyte activation factor,SOAF)被認為是精卵質膜融合后,由精子向卵母細胞質內釋放的一種或多種可溶性蛋白,可以啟動信號轉導通路,通過誘導鈣離子振蕩以達到激活卵母細胞的目的。目前廣泛接受并唯一已明確的關鍵SOAF是磷脂酶C-zeta(phospholipase C zeta,PLCζ)[4],已有多項研究證實,精子內PLCζ蛋白的缺乏、位置異常、活性及表達異常、相關基因突變與ICSI失敗及男性不育相關[4]。但其后續激活鈣離子振蕩和卵母細胞激活的機制仍未完全闡明;同時,在部分文獻中提出其他可能作為SOAF的候選蛋白,但目前仍存在爭議。本文旨在對SOAF的可能候選蛋白及其相關作用機制進行總結。
一、卵母細胞激活與鈣離子振蕩
自20世紀70年代以來,鈣離子波首先在爪蟾的卵母細胞中被報道[1],隨后通過鈣離子敏感的熒光染色技術已經在包括豬,小鼠,牛等哺乳動物和人類的卵母細胞中分別探測到鈣離子振蕩。然而,鈣離子振蕩模式是具有物種特異性的,不同物種的卵母細胞內鈣離子振蕩波在振幅、持續時間以及頻率上都存在差異[6-7]。目前在哺乳動物的受精過程中,卵母細胞內鈣離子濃度的提高稱為鈣離子誘導鈣釋放過程(Ca+2-induced Ca+2 release,CICR process),目前主要依賴2種鈣離子通道:三磷酸肌醇受體(inosital triphosphate receptors,IP3Rs)和Ryanodine受 體(Ryanodine receptors,RyRs)[1]。IP3Rs和RyRs都是鈣離子依賴的雙向調節通道,當細胞質內鈣離子濃度升高,受體失活,鈣離子被驅動回內質網(endoplasmic reticulum,ER)內儲存,當細胞質內鈣離子濃度回復到基礎狀態,則受體又被激活,重新開始驅動鈣離子從內質網中釋放。通過鈣離子通道的雙向調節,卵母細胞內才會維持長期持續的,呈周期性循環往復的鈣離子振蕩波[6]。雖然目前該機制仍未完全明晰,但由精子穿透進入卵母細胞后會觸發CICR過程已被廣泛接受。而當一個鈣離子瞬變結束,鈣離子回收進入儲存鈣離子的ER則包括一系列分子,包括基質相互作用分子1/2(Stromal-interaction molecules,STIM1/2),Orai 1/2/3以及肌漿內質網Ca-ATP酶(Sarcoplasmic Reticulum Calcium ATPase,SERCA),都在鈣離子穩態中扮演重要角色。鈣離子穩態可允許游離鈣離子重新被儲存到ER內,維持卵母細胞激活中鈣離子振蕩的循環往復[21]。鈣離子波的振幅和頻率則攜帶著一些可被探測到的信息,被細胞內的鈣離子感應器所編碼,并轉換為細胞應答[1]。
第一個對由精子誘導人卵母細胞內鈣離子振蕩的直接研究是在1990年的早期進行的。Taylor CT等人[5]發現添加精子后的20-35分鐘后即會出現鈣離子振蕩,而在受精過程中,從精子中釋放的PLCζ1對于鈣離子振蕩的產生至關重要,首個鈣離子波的振幅最高,達2.25uM,隨后的鈣離子波振幅隨時間下降。在不同卵母細胞內鈣離子的頻率是不同的,在去除透明帶的卵母細胞中,振蕩的間歇是10分鐘,而具有完整透明帶的卵母細胞間歇是35分鐘,持續時間約為4-5小時[1]。人工ICSI所誘導的鈣離子振蕩模式與內源性鈣離子振蕩相近,但在首個鈣離子瞬變出現時間、鈣離子波頻率等參數有所不同。在體外人類卵母細胞激活相關報道中,第一個鈣離子瞬變出現在ICSI之后的30到90分鐘之間,隨后以平均每小時2.4個鈣離子瞬變的頻率持續4-5小時[8]。
二、精源性卵母細胞激活因子
SOAF的首要條件即需觸發卵母細胞胞質內持續的鈣振蕩,這一機制主要通過調節磷酸肌醇信號通路提高細胞內的三磷酸肌醇(1,4,5-trisphosphate,IP3)來實現。其次,SOAF的位置對于其功能來說也至關重要。精子頭部位于頂體膜下方的區域稱為核周鞘膜(perinuclear theca,PT),是一個菲薄的凝聚胞質蛋白層,可分為結構區和功能區。其中功能區又分為三個部分:頂體下區、赤道段和頂體后鞘核周囊(postacrosomal sheath-perinuclear Theca,PAS-PT)。SOAF就 容 納 于PAS-PT區域中,當受精開始時,PAS-PT區域是第一個暴露于卵母細胞胞質的區域[9]。Kimura Y實驗表明如果將精子細胞核周除PT外的所有精子質膜結構移除,精子則仍然可以保留激活卵母細胞的能力,進一步證實了SOAF位于精子頭部的PT區[11]。第一個被認為是候選的SOAF是振蕩素(oxcillin),但后續研究中向倉鼠卵母細胞內注射重組振蕩素或其類似物人氨基葡萄糖-6-磷酸異構體均不能誘導激發鈣離子,故目前認為該蛋白并不是一個SOAF[4]。近幾年廣泛的生化和臨床證據提示主要的SOAF有2個蛋白,即PLCζ和頂體后WW結構域聯合蛋白(WW domain-binding protein,PAWP)。其他可作為SOAF的候選蛋白也在部分文獻中提出,但是否可明確為SOAF仍存在爭議。
三、PLCζ
PLC蛋白家族在卵母細胞激活級聯反應中發揮重要功能,故目前對于PLC蛋白家族的研究是目前關于卵母細胞激活的熱點方向[4]。PLC蛋白可以催化磷脂酰肌醇4,5-二磷酸酯(phosphatidylinositol 4,5-biphosphate,PIP2)的水解,生成IP3和二酰甘油(diacylglycerol,DAG),并介導IP3與其受體結合,釋放ER內儲存的鈣離子。細胞內鈣離子水平的上升激活蛋白激酶C(protein kinase C,PKC)通路,這一信號可被進一步誘導一系列細胞反應[1,4]。目前發現PLC蛋白家族有13個同工酶[12]。雖然該家族的多種亞型只在睪丸和精子中表達,但目前僅有證據表明PLCζ是一種SOAF。發現于2002年的PLCζ是PLC家族中最小的精子特異性PLC蛋白[4],由于其分子結構特異性的缺少SH結構域和PH結構域,故只包含608個氨基酸,分子量僅為70kDa[13]。不像其他PLC蛋白,PLCζ對環境鈣離子濃度十分敏感[4],這與其結構和功能區域密切相關。PLCζ的結構由四個不同可調控的結構域構成:氮基端有4個串聯的EF手型結構域(該區域內的EF3區對高濃度鈣離子敏感,使得PLCζ與其他PLC亞型相區別)、蛋白中段有一個具有催化功能的核心X、Y結構域(可與PIP2結合,對于PIP2水解至關重要)和碳基端的一個C2結構域(可與磷脂膜上的PIP3結合)[14]。
四、PLCζ誘發卵母細胞激活的機制
PLCζ可催化細胞質內的PIP2水解為肌醇1,4,5-三磷酸(IP3)和二酰甘油(DAG),由此誘發鈣離子振蕩,啟動卵母細胞的激活。IP3隨后可與其卵母細胞內質網上的IP3R受體結合,釋放內質網內儲存的鈣離子。鈣離子振蕩激活卵母細胞內多種蛋白激酶,以一定的時間順序激活受精所必須的下游事件。首先,DAG和被釋放的鈣離子將促進PKC的激活,PKC將磷酸化富含丙氨酸的豆蔻酰化蛋白激酶C的作用底物蛋白(myristoylated alanine-rich C kinase substrate MARCKS),這些蛋白負責誘導皮質顆粒(cortical granule,CG)的胞吐,同時阻斷多精子的進入。其次,細胞內鈣離子水平的增加將激活鈣離子/鈣調素依賴性蛋白激酶II(Ca2+/calmodulin-dependent protein kinase II,CaMKII),CaMKII將早期有絲分裂抑制劑2(early mitotic inhibitor 2,Emi2)磷酸化。接下來,Emi2將被泛素-配體復合物降解,不再能抑制細胞分裂后期促進因子/環小體(anaphase-promoting complex/cyclosome,APC/C)的活性。活化的APC/C通過使保全素(securin)和細胞周期蛋白B1變性,導致卵母細胞內姐妹染色單體分離并解壓縮,以促進第二極體排出,并通過將促成熟因子(maturation-promoting factor,MPF)降解使卵母細胞從第二減數分裂中釋放出來。MPF由細胞周期蛋白B(cyclin B,CNB1)和細胞周期蛋白依賴性激酶1(cyclin-dependent kinase 1,CDK1)形成。APC/C可以特異性的靶向介導CNB1的退化。然而,最近有報道提示,為了降低MPF的水平并恢復細胞周期的進行,APC/C對CNB1的變性和另一個卵母細胞激酶Wee1樣蛋白激酶2(Wee1-like protein kinase 2,WEE2)對CDK1的抑制都是必要的。最后,鈣離子振蕩可以使Mos/Mitogen激活的蛋白激酶(Mos/mitogen-activated protein kinase,MAPK)通路失活,導致原核的形成[1,4,13,15]。
盡管有研究表明,在兩種不同的PLCζ相關基因敲除的小鼠模型中,其精子可產生的子代數目減少,但這些PLCζ缺乏的精子仍然可以使卵母細胞受精,誘發相對減少、但足以激活卵母細胞的鈣離子振蕩。而因為原核形成延遲和多精受精提高[16-17],在激活的卵母細胞中鈣離子振蕩的數量上升了70%。這些結果表明,在小鼠體內可能有另一個未知的SOAF,可以在缺乏PLCζ的條件下激活卵母細胞。這種未知的SOAF可以在IVF的過程中成功激活卵母細胞,但無法在ICSI過程中完成相同事件。未知的SOAF可以彌補PLCζ缺陷患者的一些病理過程,并可能成為藥物制劑的新靶點,需要進一步研究。然而,人類精子中這種未知的SOAF尚未得到證實[18-19]。
五、PAWP
頂體后WW結構域結合蛋白(PAWP),是一種堿性蛋白,具有WW結合區域的YGXPPX重復生物序列和一個N末端GRAM結構域,位于精子頭部的核周基質中。2007年,Wu等報道了PAWP在牛、豬、猴和非洲爪蟾蜍卵母細胞,受精過程中可促進減數分裂恢復和啟動原核發育。這一發現在幾年后得到證實,當重組PAWP注入MII期卵母細胞可觸發細胞內鈣離子水平增加,而當向細胞內注射這種蛋白質的競爭性抑制劑,則可阻斷細胞內鈣離子釋放和鈣離子振蕩[20-21]。同樣的實驗也在與人類和公牛的精子中得到驗證[21-22]。此外,PAWP基因敲除小鼠的精子在IVF和ICSI處理后可以誘導卵母細胞內正常的鈣離子振蕩。盡管數據顯示PAWP滿足了所有成為SOAF的要求,然而,關于PAWP表達與鈣離子振蕩之間的關系目前仍未得到解釋。一些研究者提出,PAWP的作用是通過其他蛋白質介導的,如YES相關蛋白,它可以激活PLCγ,隨后激活下游的IP3信號通路[21]。Mehlmann等人利用外源生長因子表達刺激PLCγ途徑,在小鼠卵母細胞中引發鈣離子振蕩[23]。然而,PAWP表達、PLCγ活性與鈣離子振蕩之間的關系無法證明。此外,由PAWP僅僅能誘發細胞內鈣離子濃度升高,但細胞內的鈣離子并不能呈現哺乳動物受精后特征性的鈣離子振蕩波。同時,考慮到PLCγ對鈣離子也并不像PLCζ那樣敏感,目前沒有確鑿的證據表明這種PLC同工酶PLCγ在卵母細胞活化中起著重要作用[4,24-25]。
六、其他可能的SOAF
目前除PLCζ,PAWP外,還有2個可能的SOAF因子,即非洲爪蟾蜍檸檬酸合酶同源物和被刪除頂端的c-kit酪氨酸蛋白激酶受體(Truncated form of the c-kit tyro-sine kinase receptor,Tr-Kit),但 目 前 這2種SOAF候選尚在動物模型實驗階段,人類精子相關實驗仍需進一步探究。非洲爪蟾蜍檸檬酸合成酶同源物是一個45kDa的蛋白,作為SOAF它是有爭議的,Harada等人發現其可以觸發未受精的蠑螈卵母細胞內的鈣離子振蕩,同時如使用抗檸檬酸合酶抗體處理精子提取物后,其卵母細胞激活能力下降。目前尚無其在哺乳動物卵母細胞活化或受精過程中發揮功能的科學報道[25]。另一個SOAF候選物質為被刪除頂端的c-kit酪氨酸激酶受體(Tr-kit)。雖然這種受體在哺乳動物受精中的作用尚不清楚,但它在精子頭部的赤道區域表達,并在高質量精子中的頂體反應后持續存在[26-27]。
七、SOAF與卵母細胞激活失敗
精子與卵母細胞融合后原核形成,在ICSI中,原核形成失敗被視為受精失敗的標志。目前ICSI可達到的受精率約為70~85%,臨床工作中仍有1~5%會出現完全受精失敗(totally fertilization failure,TFF)或受精率極低的情況發生[28]。TFF是指一次刺激周期中獲取到的卵母細胞在ICSI后均無法形成原核,而卵母細胞激活失敗(oocyte activation deficiency,OAD)是其最主要的原因[1]。精子因素,卵母細胞因素及人工因素均可引起OAD,而精子相關OAD則主要與SOAF的異常相關[13]。精子內PLCζ蛋白的缺乏,位置異常,活性、表達異常或基因突變都與ICSI失敗或男性不育相關[4],負責編碼PLCζ的對應基因是位于第12號染色體上的PLCZ1基因(ENSG00000139151),通過對臨床中發生受精率低下或TFF的男性患者進行全外顯子測序(whole exome sequencing,WES)的方式,截止目前為止,已有21個不同的突變基因被報道與受精率低下或TFF相關,包括EF-X連接區的1個錯義突變(p.I120M),X催化結構域(p.V189C fs*12;p.C196*;R197H;p.L224P;p.H233L;p.L246F;p.L277P)和Y催化結構域(p.S350P;p.N377del;p.A384V;p.H398P;p.R412fs;p.P420L;p.K448N)共14個 突 變,X-Y連接區的2個移碼突變(p.T324fs和p.V326K fs*25)和C2結構域的3個無義突變(p.I489F,p.S500L,p.R553P)和位于C端蛋白結構域外的一個無義突變(p.M578T)。所有突變都通過silico分析進行評估,大多數突變也進行了功能分析[38-48],見表1。

表1 PLCZ1突變
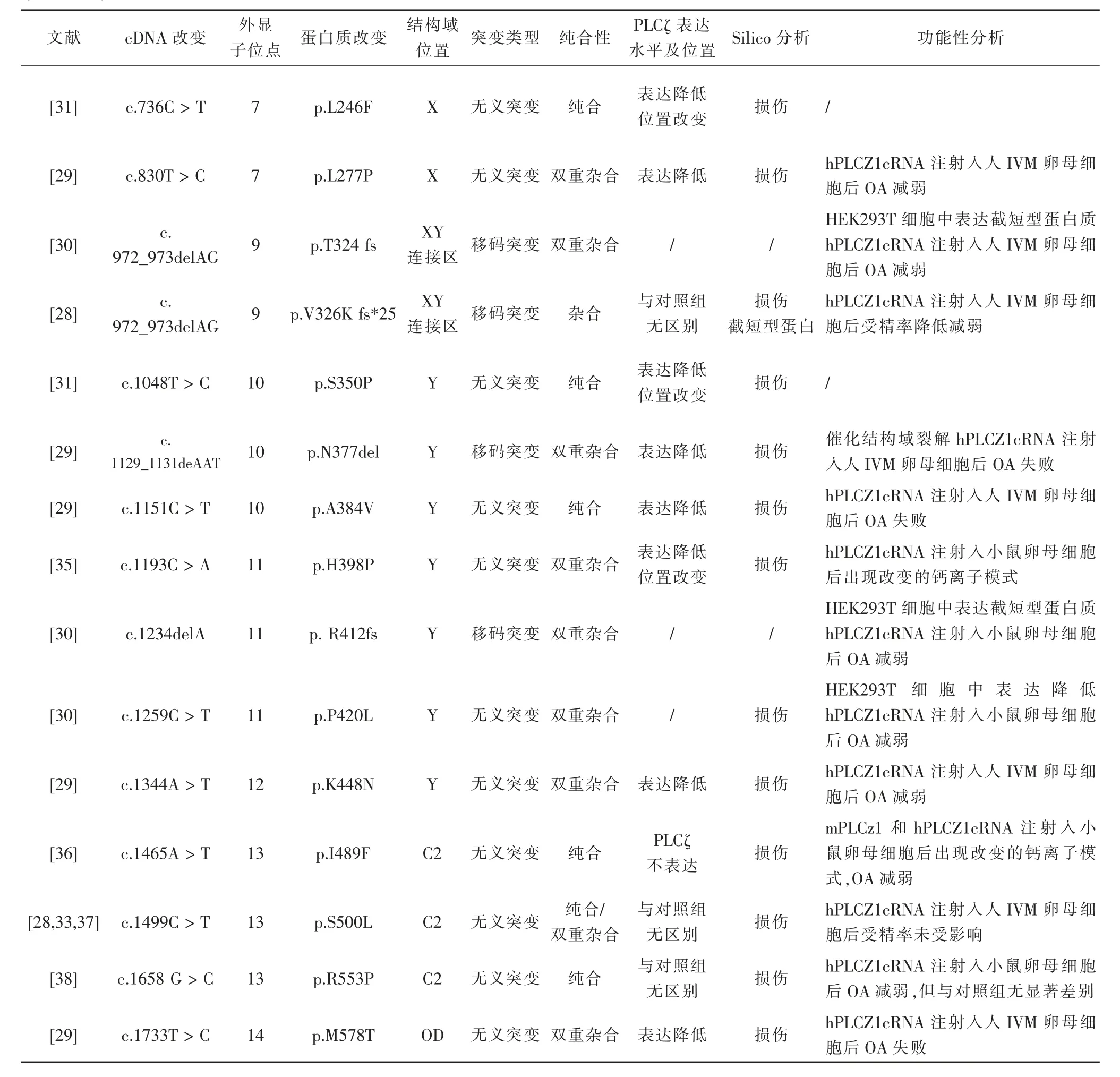
文獻 cDNA改變 外顯子位點 蛋白質改變 結構域位置 突變類型 純合性PLCζ表達水平及位置Silico分析 功能性分析[31] c.736C>T 7 p.L246F X 無義突變 純合 表達降低位置改變 損傷 /[29] c.830T>C 7 p.L277P X 無義突變 雙重雜合 表達降低 損傷 hPLCZ1cRNA注射入人IVM卵母細胞后OA減弱HEK293T細胞中表達截短型蛋白質hPLCZ1cRNA注射入人IVM卵母細胞后OA減弱[28] c.[30] c.972_973delAG 9 p.T324 fs XY連接區 移碼突變 雙重雜合 / /972_973delAG 9 p.V326K fs*25 XY連接區 移碼突變 雜合 與對照組無區別損傷截短型蛋白hPLCZ1cRNA注射入人IVM卵母細胞后受精率降低減弱[31] c.1048T>C 10 p.S350P Y 無義突變 純合 表達降低位置改變 損傷 /[29] c.1129_1131deAAT 10 p.N377del Y 移碼突變 雙重雜合 表達降低 損傷 催化結構域裂解hPLCZ1cRNA注射入人IVM卵母細胞后OA失敗[29] c.1151C>T 10 p.A384V Y 無義突變 純合 表達降低 損傷 hPLCZ1cRNA注射入人IVM卵母細胞后OA失敗[35] c.1193C>A 11 p.H398P Y 無義突變 雙重雜合 表達降低位置改變 損傷 hPLCZ1cRNA注射入小鼠卵母細胞后出現改變的鈣離子模式[30] c.1234delA 11 p.R412fs Y 移碼突變 雙重雜合 / /HEK293T細胞中表達截短型蛋白質hPLCZ1cRNA注射入小鼠卵母細胞后OA減弱HEK293T細胞中表達降低hPLCZ1cRNA注射入小鼠卵母細胞后OA減弱[29] c.1344A>T 12 p.K448N Y 無義突變 雙重雜合 表達降低 損傷 hPLCZ1cRNA注射入人IVM卵母細胞后OA減弱[30] c.1259C>T 11 p.P420L Y 無義突變 雙重雜合 / 損傷mPLCz1和hPLCZ1cRNA注 射入小鼠卵母細胞后出現改變的鈣離子模式,OA減弱[28,33,37]c.1499C>T 13 p.S500L C2 無義突變 純合/雙重雜合[36] c.1465A>T 13 p.I489F C2 無義突變 純合 PLCζ不表達 損傷無區別 損傷 hPLCZ1cRNA注射入人IVM卵母細胞后受精率未受影響[38] c.1658 G>C 13 p.R553P C2 無義突變 純合 與對照組與對照組無區別 損傷 hPLCZ1cRNA注射入小鼠卵母細胞后OA減弱,但與對照組無顯著差別[29] c.1733T>C 14 p.M578T OD 無義突變 雙重雜合 表達降低 損傷 hPLCZ1cRNA注射入人IVM卵母細胞后OA失敗
八、展望
目前對于SOAF仍有很大領域有待研究。對于已明確為SOAF的PLCζ,是否有未知的SOAF可以彌補PLCζ的缺陷,而對其相應的PLCZ1,基因篩選方式可以聚焦到PLCZ1序列上游的調控序列及內含子區域或者直接進行全基因組測序[13]。對于其他SOAF候選物質,PAWP誘發的鈣離子振蕩以激活卵母細胞具體分子機制有待明確,非洲爪蟾蜍檸檬酸合酶同源物質和Tr-Kit則需要進一步在人類精子上進行驗證。

