菠蘿NAC轉(zhuǎn)錄因子基因AcoNAC1生物信息學(xué)及表達(dá)分析
譚秦亮 蔡元保 楊祥燕 李穆 李季東 黃思婕 程琴 龐新華 朱鵬錦 周全光

摘 ?要:NAC轉(zhuǎn)錄因子作為植物中數(shù)量最大的轉(zhuǎn)錄因子家族之一,在植物生長(zhǎng)發(fā)育及各種逆境脅迫中發(fā)揮非常重要的調(diào)控作用。本研究以菠蘿為試驗(yàn)材料,采用RT-PCR技術(shù)克隆得到基因AcoNAC1(GenBank登錄號(hào):XM_020225830),對(duì)其進(jìn)行生物信息學(xué)及表達(dá)分析。生物信息學(xué)分析表明,該基因cDNA序列全長(zhǎng)1723 bp,ORF為1062 bp,編碼353個(gè)氨基酸,相對(duì)分子量為38.34 kDa,理論等電點(diǎn)為8.88;其編碼蛋白的二級(jí)結(jié)構(gòu)由20.40%的α-螺旋(H)和15.30%的β-折疊(E)以及59.21%的無(wú)規(guī)則卷曲(C)組成,具有NAC典型結(jié)構(gòu)保守域。基因表達(dá)分析表明,AcoNAC1基因的表達(dá)受低溫和干旱脅迫誘導(dǎo),低溫脅迫24 h和干旱脅迫12 h時(shí)的表達(dá)量最高;在不同成熟期品種中表現(xiàn)出持續(xù)的誘導(dǎo)表達(dá),但誘導(dǎo)強(qiáng)度逐漸下降,其中早熟品種謝花后20~50 d及晚熟品種謝花后20~60 d基因表達(dá)量均處于較高水平。因此,推測(cè)AcoNAC1基因可能參與菠蘿逆境脅迫響應(yīng)以及果實(shí)發(fā)育與成熟的調(diào)控。
關(guān)鍵詞:菠蘿;NAC轉(zhuǎn)錄因子;生物信息學(xué)分析;逆境脅迫
Abstract: NAC is one of the largest families of transcription factors in plants, which plays an important role in plant growth, development and all kinds of adversity stress response. Mature pineapple pulp was used as the research material. AcoNAC1 (GenBank accession number: XM_020225830) was cloned by RT-PCR from Ananas comosus, then bioinformatics and expression were analyzed. Bioinformatics analysis showed that the full length cDNA of AcoNAC1 was 1723 bp and contained an ORF of 1062 bp, and was predicted to encode a protein of 353 amino acids, with a theoretical molecular weight of 38.34 kDa and an isoelectric point of 8.88. Secondary structure prediction revealed AcoNAC1 had 20.40% alpha helix (H), 15.30% beta folded (E) and 59.21% random curl (C), with typical NAC conservative domain. Gene expression analysis showed that the expression of AcoNAC1 was induced by low temperature and drought stress, and the highest expression was observed in low temperature stress 24 h and drought stress for 12 h. Different maturity varieties showed a continuous induction expression, and the expression was at a higher level after the precocious variety blossom 20-50 d and late-maturing variety blossom 20-60?d. Therefore, AcoNAC1 maight participate in response to adversity stress reaction and fruit development or maturity of regulation.
Keywords: Ananas comosus; NAC transcription factor; bioinformatics analysis; adversity stress
NAC(NAM、ATAF1/2、CUC2)轉(zhuǎn)錄因子是一類植物特有的蛋白家族,最早在矮牽牛(Petunia hybrida)和擬南芥(Arabidopsis thaliana)中被發(fā)現(xiàn)[1],在其他真核生物中尚未發(fā)現(xiàn)該家族成員的存在[2]。NAC轉(zhuǎn)錄因子結(jié)構(gòu)復(fù)雜,大多數(shù)含有1個(gè)保守的N端DNA功能結(jié)合域和C端多變結(jié)構(gòu),N端保守的NAC功能結(jié)構(gòu)域根據(jù)不同的基序可進(jìn)一步分為A、B、C、D、E 5個(gè)保守的亞結(jié)構(gòu)域,具有結(jié)合DNA、蛋白質(zhì)及功能二聚體的特性,并決定著NAC轉(zhuǎn)錄因子的主要生化功能[3-4]。與N端的高度保守性不同,NAC轉(zhuǎn)錄因子的C端序列存在多變性,且富含酸性氨基酸、蘇氨酸、脯氨酸、絲氨酸等,無(wú)論是在編碼氨基酸還是序列長(zhǎng)度上均表現(xiàn)出變化多樣性,因此C端具有轉(zhuǎn)錄激活、抑制或結(jié)合蛋白質(zhì)活性的特點(diǎn)[5]。
大量研究表明,首先NAC轉(zhuǎn)錄因子在植物生長(zhǎng)發(fā)育中起重要的作用[6],通過此類基因的表達(dá)可以調(diào)控植物側(cè)根的發(fā)育[7]、花的形態(tài)建成[8]、果實(shí)成熟[9]、葉片衰老[10]以及次生壁的形成[11]等。例如在擬南芥中,AtNAC2主要在花和根中高度表達(dá),超表達(dá)AtNAC2能夠促進(jìn)側(cè)根的發(fā)育[12]。其次是可以響應(yīng)植物生長(zhǎng)過程中遇到的逆境脅迫,激活多種生物和非生物脅迫過程中相關(guān)基因的表達(dá),提高植物對(duì)逆境脅迫的耐受性[13]。例如在擬南芥中AtANAC019、AtANAC055和AtANAC072 的表達(dá)均受到干旱、高鹽或脫落酸(ABA)的誘導(dǎo),超表達(dá)可提高轉(zhuǎn)基因植株對(duì)干旱的耐受性[14]。在小麥中TaNAC5基因參與逆境脅迫的應(yīng)答,在滲透和低溫脅迫下TaNAC5基因上調(diào)表達(dá),而高鹽脅迫則抑制TaNAC5基因表達(dá)[15]。在水稻中ONAC045過表達(dá)可以提高轉(zhuǎn)基因水稻植株對(duì)冷和鹽脅迫的抗性,還增強(qiáng)植株對(duì)ABA的靈敏度[16];過表達(dá)SNAC1基因既可增加水稻對(duì)ABA的敏感性,又可提高轉(zhuǎn)基因水稻對(duì)干旱和鹽堿化的耐受性,還可以通過調(diào)控保衛(wèi)細(xì)胞的閉合來(lái)增強(qiáng)水稻的抗旱性[17-18]。
菠蘿(Ananas comosus)是鳳梨科鳳梨屬多年生草本植物,廣泛分布于世界上的熱帶、亞熱帶地區(qū),目前全球80多個(gè)國(guó)家與地區(qū)種植菠蘿,但98%產(chǎn)自亞洲、美洲和非洲[19-20]。菠蘿是我國(guó)熱帶、亞熱帶地區(qū)最具特色和優(yōu)勢(shì)的熱帶水果之一[21],與荔枝、香蕉及木瓜合稱為我國(guó)嶺南四大熱帶水果。目前,NAC轉(zhuǎn)錄因子在菠蘿中的生物學(xué)功能尚不清楚,其相關(guān)研究未見報(bào)道。基于前期的研究基礎(chǔ)[22-24],本研究從菠蘿中克隆到1個(gè)NAC轉(zhuǎn)錄因子基因AcoNAC1,利用生物信息學(xué)方法對(duì)該基因的序列及其編碼蛋白進(jìn)行分析,預(yù)測(cè)其蛋白的理化性質(zhì)、結(jié)構(gòu)及功能等,并利用RT-qPCR分析該基因在不同脅迫和不同成熟期的表達(dá)模式,為今后深入研究該基因的功能提供理論依據(jù)。
1 ?材料與方法
1.1 ?材料
試驗(yàn)材料為廣西亞熱帶作物研究所菠蘿種質(zhì)資源圃提供的菠蘿品種‘金菠蘿(MD-2)以及早熟品種‘巴厘(Comte de Paris)和晚熟品種‘pérola。選取處于幼苗期,苗齡為60 d的‘金菠蘿組培苗作為脅迫處理對(duì)象,低溫脅迫選擇4?℃環(huán)境,干旱模擬脅迫選擇20%濃度的PEG 6000澆灌土壤至飽和。在‘金菠蘿幼苗期分別采集經(jīng)4?℃低溫脅迫和20% PEG 6000干旱脅迫0、1、3、6、12、24 h后的葉片,未進(jìn)行處理的植株作為對(duì)照。早熟品種‘巴厘謝花(自然開花,以第一朵小花謝花開始算起,下同)后20、35、50、60、65、70 d分別采集果肉,晚熟品種‘pérola謝花后20、40、60、80、100、120?d分別采集果肉。以上所有材料取樣后液氮速凍,保存于?80?℃冰箱中,用于后期試驗(yàn)。
1.2 ?方法
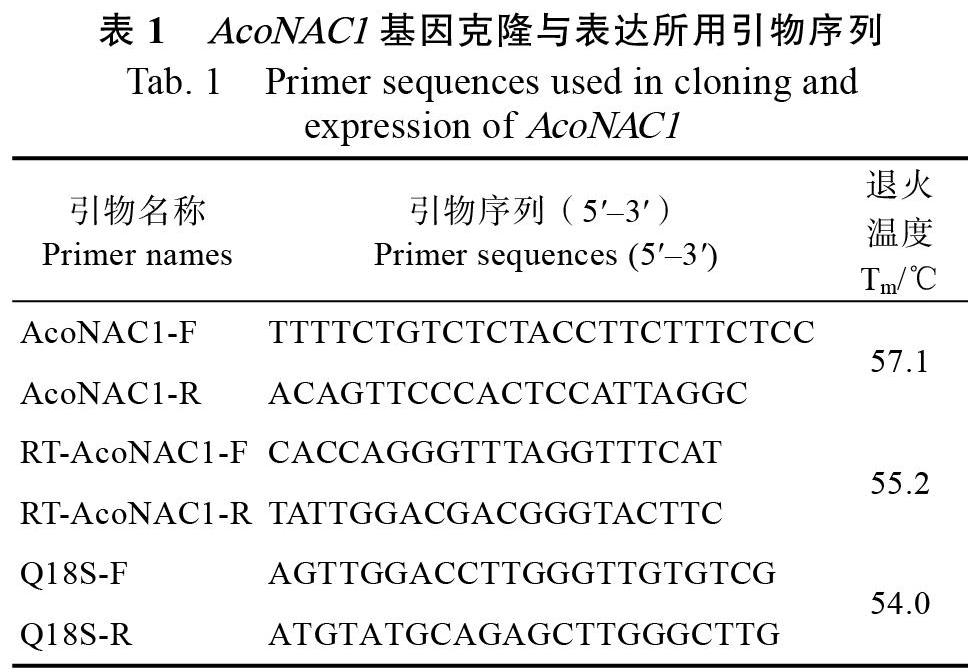
1.2.1 ?菠蘿AcoNAC1基因的克隆 ?采用CTAB改良法提取菠蘿葉片和果肉的總RNA,具體操作參照蔡元保等[24]的方法。利用課題組前期對(duì)菠蘿轉(zhuǎn)錄組測(cè)序獲得的編碼NAC轉(zhuǎn)錄因子的EST序列,設(shè)計(jì)全長(zhǎng)擴(kuò)增引物AcoNAC1-F和AcoNAC1- R,擴(kuò)增AcoNAC1基因的全長(zhǎng)cDNA序列,所用引物(表1)全部由生工生物工程(上海)股份有限公司合成。
1.2.2 ?AcoNAC1蛋白性質(zhì)分析 ?參考蔡元保等[24]和馬海洋等[25]采用的在線工具和軟件分析AcoNAC1蛋白的NAC保守結(jié)構(gòu)域、基本理化特性、信號(hào)肽、亞細(xì)胞定位、蛋白質(zhì)二級(jí)結(jié)構(gòu)及蛋白質(zhì)跨膜區(qū)段等結(jié)構(gòu)和功能。
1.2.3 ?AcoNAC1蛋白同源性及系統(tǒng)進(jìn)化樹分析 ?利用DNAMAN6.0軟件將菠蘿AcoNAC1與NCBI數(shù)據(jù)庫(kù)中搜索的菠蘿AcNAC(OAY83360.1)、水稻OsNAC(XP-006660793.1)、海棗PdNACX2(XP- 017699777.1)、油棕EgNAC(XP-010929381.1)、玉米ZmNAC(PWZ38257.1)、高粱SbNAC(XP- 002462604.1)、大豆GsNACX3(XP_028199935.1)序列進(jìn)行同源蛋白多序列比對(duì)。并利用DNAMAN 6.0軟件,對(duì)菠蘿和22個(gè)不同植物蛋白進(jìn)行系統(tǒng)進(jìn)化樹的構(gòu)建。
1.2.4 ?菠蘿AcoNAC1基因表達(dá)分析 ?采用qRT- PCR方法分析AcoNAC1基因的實(shí)時(shí)表達(dá)情況,AcoNAC1基因的特異引物為RT-AcoNAC1-F和RT-AcoNAC1-R,內(nèi)參基因選擇菠蘿18S rRNA基因,引物為Q18S-F和Q18S-R(表1)。RT-qPCR反應(yīng)體系及程序參考蔡元保等[24]的方法。每個(gè)試驗(yàn)設(shè)3次重復(fù),采用2?ΔΔCT方法分析處理數(shù)據(jù),確定AcoNAC1基因的相對(duì)表達(dá)量。
2 ?結(jié)果與分析
2.1 ?菠蘿AcoNAC1基因的克隆及序列分析
根據(jù)前期研究的菠蘿轉(zhuǎn)錄組測(cè)序獲得編碼NAC轉(zhuǎn)錄因子的EST序列,利用RT-PCR技術(shù)擴(kuò)增獲得該EST的全長(zhǎng)cDNA序列。經(jīng)過序列分析表明,該基因的全長(zhǎng)cDNA為1723 bp,最大開放閱讀框(ORF)為1062 bp,可編碼353個(gè)氨基酸。SMART在線工具預(yù)測(cè)表明,該編碼蛋白含有一個(gè)典型的NAC轉(zhuǎn)錄因子的結(jié)構(gòu)域(圖1),位于該蛋白的N端,初步推測(cè)該蛋白屬于NAC轉(zhuǎn)錄因子,因此將該基因命名為AcoNAC1(GenBank登錄號(hào):XM_020225830)。
2.2 ?編碼蛋白AcoNAC1的理化性質(zhì)分析
利用ProtParam在線工具預(yù)測(cè)編碼蛋白AcoNAC1的理化性質(zhì),AcoNAC1蛋白的分子式為C1702H2604N484O503S14,相對(duì)分子量為38.34 kDa,理論等電點(diǎn)(pI)為8.88。該蛋白由353個(gè)氨基酸殘基組成,富含強(qiáng)堿性氨基酸(Arg、Lys,共36個(gè))和強(qiáng)酸性氨基酸(Asp、Glu,共31個(gè)),占比較高的氨基酸有甘氨酸(Gly)、丙氨酸(Ala)、異亮氨酸(Leu)、脯氨酸(Pro),分別占總氨基酸數(shù)的10.8%、10.2%、7.9%、7.9%。SignaIP4.0軟件分析結(jié)果顯示,AcoNAC1蛋白中不存在信號(hào)肽,亞細(xì)胞定位在細(xì)胞質(zhì)中,平均親水系數(shù)(GRAVY)為?0.543,不穩(wěn)定指數(shù)為43.29,因此預(yù)測(cè)該蛋白為不穩(wěn)定親水蛋白。
2.3 ?編碼蛋白AcoNAC1的二級(jí)結(jié)構(gòu)及跨膜性預(yù)測(cè)
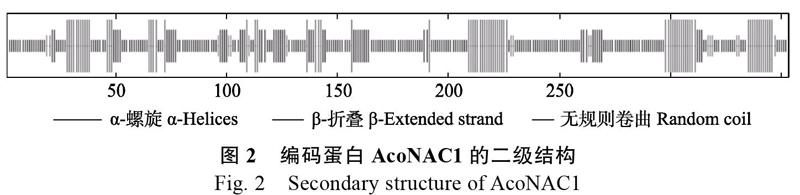
SOPMA軟件分析結(jié)果顯示(圖2),AcoNAC1蛋白結(jié)構(gòu)中主要含有α-螺旋(H)和β-折疊(E)以及無(wú)規(guī)則卷曲(C)這3種二級(jí)結(jié)構(gòu),其百分比分別20.40%、15.30%和59.21%。TMpred軟件跨膜區(qū)域預(yù)測(cè)表明(圖3),AcoNAC1蛋白有1個(gè)比較明顯的跨膜結(jié)構(gòu),為246~273位點(diǎn)。
2.4 ?菠蘿AcoNAC1蛋白的同源性分析
通過Blastp搜索和DNAMAN軟件分析顯示,菠蘿AcoNAC1蛋白與其同源的菠蘿AcNAC(OAY83360.1)序列一致性最高,同源性達(dá)到95.18%;其次為水稻OsNAC(XP-006660793.1)、海棗PdNACX2(XP-017699777.1)、油棕EgNAC(XP-010929381.1),同源性分別達(dá)到65.23%、63.01%、61.43%。而且,AcoNAC1與其他NAC轉(zhuǎn)錄因子一樣,N-端的氨基酸序列高度保守,可以進(jìn)一步劃分為A、B、C、D、E 5個(gè)保守的亞結(jié)構(gòu)域(圖4)。
2.5 ?菠蘿AcoNAC1蛋白的系統(tǒng)進(jìn)化分析
利用DNAMAN軟件分析AcoNAC1蛋白及其同源蛋白的系統(tǒng)進(jìn)化表明,菠蘿AcoNAC1蛋白與其同源的菠蘿AcNAC(OAY83360.1)親緣關(guān)系最近,與海棗PdNACX2(XP-017699777.1)和油棕EgNAC(XP-010929381.1)的親緣關(guān)系次之;與擬南芥AtNAC(NP_188169.1)、亞麻蕎CsNAC(XP_0104873776.1)和煙草NtNAC(XP_ 009625026.1)的親緣關(guān)系最遠(yuǎn)(圖5)。
2.6 ?菠蘿AcoNAC1基因表達(dá)分析
2.6.1 ?AcoNAC1基因在逆境脅迫下的表達(dá)與分析 ?為研究AcoNAC1基因的表達(dá)是否受逆境脅迫的誘導(dǎo),本研究采用低溫、干旱2種不同逆境脅迫對(duì)菠蘿幼苗進(jìn)行處理。結(jié)果表明(圖6),在低溫處理1?h后,AcoNAC1基因表達(dá)量有明顯上調(diào),隨后表達(dá)逐漸減少,到6?h后表達(dá)量再次明顯上調(diào),并在處理12 h后再次回落,之后隨著處理時(shí)間的推遲,該基因的表達(dá)在處理24 h后達(dá)到最高值,表達(dá)量為對(duì)照(處理時(shí)間0 h)的11.25倍;在干旱處理3?h后,AcoNAC1基因表達(dá)量明顯上調(diào),且在12 h后達(dá)到最高值,為對(duì)照(處理時(shí)間0 h)的10.8倍。
2.6.2 ?AcoNAC1基因在菠蘿不同成熟期的表達(dá)與分析 ?為研究AcoNAC1基因的表達(dá)是否能調(diào)控菠蘿成熟期,本研究選用早熟品種(‘巴厘,Comte de Paris)、晚熟品種(pérola)的不同成熟期果肉進(jìn)行檢測(cè)。結(jié)果表明(圖7),在不同成熟期2個(gè)品種中AcoNAC1基因表現(xiàn)出持續(xù)的誘導(dǎo)表達(dá),且整體表達(dá)量呈逐漸減少趨勢(shì)。早熟品種‘巴厘(Comte de Paris)謝花20 d 后AcoNAC1基因表達(dá)量達(dá)到最高峰值,隨后到60 d后表達(dá)量下降到最低峰值,之后該基因的表達(dá)量一直未出現(xiàn)較大的增加;晚熟品種‘pérola謝花20?d后AcoNAC1基因表達(dá)量較高,且在謝花60 d后再次達(dá)到最高值,隨后逐漸下降,到謝花100?d后下降到最低峰值,120?d時(shí)又有所回升。
3 ?討論
NAC轉(zhuǎn)錄因子是一類基因調(diào)控蛋白,植物一系列生理生化反應(yīng)均離不開NAC的調(diào)控,NAC不僅可以調(diào)節(jié)植物基本的新陳代謝和生長(zhǎng)發(fā)育,而且在響應(yīng)逆境脅迫方面也有著重要的作用。目前有關(guān)NAC轉(zhuǎn)錄因子家族的研究越來(lái)越熱門,已在擬南芥[26]、水稻[27]、大豆[28]、番茄[29]、蘋果[30]、葡萄[31]等多種植物中鑒別出NAC轉(zhuǎn)錄因子家族的大量基因,其中擬南芥中存在117個(gè)、水稻151個(gè)、大豆152個(gè)、番茄104個(gè)、蘋果180個(gè)、葡萄74個(gè)。本研究利用轉(zhuǎn)錄組學(xué)等方法從菠蘿中成功獲得AcoNAC1基因(GenBank登錄號(hào):XM_ 020225830)的全長(zhǎng)序列,該序列長(zhǎng)度為1723 bp,開放閱讀框(ORF)為1062 bp,可編碼353個(gè)氨基酸,是一種不穩(wěn)定親水蛋白,有跨膜結(jié)構(gòu)但不存在信號(hào)肽,亞細(xì)胞定位在細(xì)胞質(zhì)中。序列分析表明,AcoNAC1蛋白和其他已知的NAC轉(zhuǎn)錄因子一樣,N-端含有一個(gè)典型的NAC類轉(zhuǎn)錄因子的結(jié)構(gòu)域,可分為5個(gè)亞結(jié)構(gòu)域,與大部分前人研究結(jié)果完全一致。已有研究表明[32-33],NAC轉(zhuǎn)錄因子的N端具有典型的功能結(jié)構(gòu)域特征,由150~160個(gè)氨基酸殘基共同構(gòu)成包含A~E共5個(gè)亞結(jié)構(gòu)域,其中A亞結(jié)構(gòu)域與蛋白互作二聚體的形成有關(guān),B和E亞結(jié)構(gòu)域與NAC轉(zhuǎn)錄因子的功能分化有關(guān),C和D亞結(jié)構(gòu)域與DNA的結(jié)合有關(guān),其中A、C和D亞結(jié)構(gòu)域高度保守,B和E亞結(jié)構(gòu)域保守性不強(qiáng)。二級(jí)結(jié)構(gòu)預(yù)測(cè)可知,該蛋白主要以無(wú)規(guī)則卷曲為主,這與梁芳等[34]對(duì)太行菊NAC轉(zhuǎn)錄因子的研究結(jié)果基本一致。
植物非生物脅迫作用主要包括干旱、低溫、高鹽等環(huán)境脅迫作用,植物受到一定的環(huán)境脅迫時(shí)就會(huì)通過多種信號(hào)轉(zhuǎn)導(dǎo)途徑響應(yīng)脅迫信號(hào),進(jìn)而啟動(dòng)下游相關(guān)脅迫應(yīng)答因子發(fā)揮作用,從而提高植物抵御逆境脅迫的能力。對(duì)香蕉研究發(fā)現(xiàn),過表達(dá)MusaNAC042的香蕉轉(zhuǎn)基因植株經(jīng)干旱脅迫處理后,干旱指標(biāo)脯氨酸含量升高,丙二醛含量降低,相對(duì)含水量高于對(duì)照植株,此外還引起多個(gè)下游相關(guān)基因的表達(dá)上調(diào),說(shuō)明MusaNAC042基因能夠較好的提高香蕉的抗旱性[35]。水稻中OsNAC5和OsNAC095基因受干旱、高鹽等脅迫誘導(dǎo)后上調(diào)表達(dá),但受低溫脅迫后下調(diào)表達(dá),過表達(dá)這些基因能夠增強(qiáng)轉(zhuǎn)基因株系的抗干旱和抗高鹽水平[36-37]。過表達(dá)OsNAC022的轉(zhuǎn)基因水稻植株在干旱脅迫下較野生型(WT)植株耐旱性強(qiáng),成活率高,生長(zhǎng)性能好,其中蒸騰速率會(huì)降低,脯氨酸和可溶性糖含量會(huì)增加,且可通過ABA依賴通路調(diào)控轉(zhuǎn)基因植物中OsNAC022基因的表達(dá)[38]。綜上所述,NAC基因成員確實(shí)參與了植物的各種逆境應(yīng)答。本研究發(fā)現(xiàn),干旱和低溫都對(duì)AcoNAC1基因的表達(dá)具有誘導(dǎo)作用,在低溫處理1、6、24 h與干旱處理3、12、24 h后AcoNAC1基因的表達(dá)均有明顯的增強(qiáng)趨勢(shì),這些變化說(shuō)明AcoNAC1基因參與了菠蘿非生物脅迫的調(diào)控響應(yīng)過程,但其在不同脅迫條件下參與調(diào)控的途徑和方式存在差異。
開花和果實(shí)成熟是植物生長(zhǎng)發(fā)育中特有的一個(gè)發(fā)育階段,是受到多種因素共同調(diào)控的復(fù)雜過程,在不同植物中相關(guān)基因調(diào)控的作用存在差異。近年來(lái)研究表明,NAC(NAM、ATAF1/2、CUC2)是一種具有特異性且可調(diào)控多種生物功能的植物轉(zhuǎn)錄因子,在轉(zhuǎn)錄水平上NAC轉(zhuǎn)錄因子可根據(jù)自身的特異性結(jié)合靶基因啟動(dòng)子上的順式作用元件,激活或抑制下游靶基因的表達(dá),進(jìn)而調(diào)控果實(shí)的成熟期、外觀、風(fēng)味及品質(zhì)的相關(guān)變化。在臍橙晚熟突變體中發(fā)現(xiàn)1個(gè)NAC基因CitNAC[39],其在成熟柑橘的果皮和果肉中表達(dá)較高,而在果實(shí)發(fā)育的其他階段表達(dá)量相對(duì)較低,推測(cè)其可能與果實(shí)的成熟和組織的衰老密切相關(guān)。本研究中菠蘿AcoNAC1基因在早熟和晚熟品種的果實(shí)成熟期中,均受到誘導(dǎo)表達(dá),但表達(dá)量整體呈下降的趨勢(shì),推測(cè)其在菠蘿果實(shí)形成過程中有促進(jìn)作用,但是在菠蘿果實(shí)成熟后期具有一定的負(fù)調(diào)控作用。
參考文獻(xiàn)
Aida M, Ishida T, Fukaki H, et al. Genes involved in organ separation in Arabidopsis: An analysis of the cup-shaped cotyledon mutant[J]. Plant Cell, 1997, 9(6): 841-857.
劉美英, 冶曉芳, 唐益苗, 等. TaNAC提高轉(zhuǎn)基因煙草的抗旱功能[J]. 中國(guó)煙草學(xué)報(bào), 2010, 16(6): 82-88.
張慧珍, 白雪芹, 曾幼玲. 植物NAC轉(zhuǎn)錄因子的生物學(xué)功能[J]. 植物生理學(xué)報(bào), 2019, 55(7): 915-924.
Jensen M K, Kjaersgaard T, Nielsen M M, et al. The Arabidopsis thaliana NAC transcription factor family: Structure-function relationships and determinants of ANAC019 stress signalling[J]. Biochemical Journal, 2010, 426(2): 183-196.
Puranik S, Sahu P P, Srivastava P S. NAC proteins: regulation and role in stress tolerance[J]. Trends in Plant Science, 2012, 17(6): 369-381.
Olsen A N, Ernst H A, Leggio L L, et al. NAC transcription factors: Structurally distinct, functionally diverse[J]. Trends Plant Science, 2005, 10(2): 79-87.
Hao Y J, Wei W, Song Q X, et al. Soybean NAC transcription factors promote abiotic stress tolerance and lateral root formation in transgenic plants[J]. The Plant Journal, 2011, 68(2): 302-313.
Hendelman A, Stav R, Zemach H, et al. The tomato NAC transcription factor SINAM2 is involved in flower-boundary morphogenesis[J]. Journal of Experimental Botany, 2013, 64(18): 5497-5507.
Ma N N, Feng H L, Meng X, et al. Overexpression of tomato SINAC1 transcription factor alters fruit pigmentation and softening[J]. BMC Plant biology, 2014, 14: 351.
Guo Y F, Gan S S. AtNAP, a NAC family transcription factor, has an important role in leaf senescence[J]. Plant Journal, 2006, 46(4): 601-612.
Chai M F, Bellizzi M, Wan C X, et al. The NAC transcription factor OsSWN1 regulates secondary cell wall development in Oryza sativa[J]. Journal of Plant Biology, 2015, 58(1): 44-51.
He X J, Mu R L, Cao W H, et al. AtNAC2, a transcription factor downstream of ethylene and auxin signaling pathways, is involved in salt stress response and lateral root development[J]. The Plant Journal, 2005, 44(6): 903-916.
張 ?丹, 馬玉花. NAC轉(zhuǎn)錄因子在植物響應(yīng)非生物脅迫中的作用[J]. 生物技術(shù)通報(bào), 2019, 35(12): 144-151.
Tran L S P, Nakashima K, Sakuma Y, et al. Isolation and functional analysis of Arabidopsis stress inducible NAC transcription factors that bind to a drought-responsive Cis-element in the early responsive to dehydration stress 1 promoter[J]. Plant Cell, 2004, 16(9): 2481-2498.
胡 ?偉, 顏 ?彥, 韋運(yùn)謝, 等. 小麥TaNAC5基因克隆及表達(dá)分析[J]. 西北植物學(xué)報(bào), 2014, 34(12): 2394-2398.
Zheng X, Chen B, Lu G, et al. Overexpression of a NAC transcription factor enhances rice drought and salt tolerance[J]. Biochemical and Biophysical Research Communications, 2009, 379(4): 985-989.
Saad A S, Li X, Li H P, et al. A rice stress-responsive NAC gene enhances tolerance of transgenic wheat to drought and salt stresses[J]. Plant Science, 2013, 203-204: 33-40.
Hu H, Dai M, Yao J, et al. Overexpressing a NAM, ATAF, and CUC (NAC) transcription factor enhances drought resistance and salt tolerance in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(35): 12987-12992.
Botella J R, Smith M. Genomics of pineapple, crowning the king of tropical fruits, genomics of tropical crop plants[J]. Genomics of Tropical Crop Plants, 2008: 441-451.
劉海清, 劉志頤. 中國(guó)菠蘿鮮果產(chǎn)業(yè)的國(guó)際競(jìng)爭(zhēng)力分析[J]. 江蘇農(nóng)業(yè)科學(xué), 2017, 45(17): 334-337.
楊文秀, 趙維峰, 鄧大華, 等. 云南省菠蘿產(chǎn)業(yè)發(fā)展現(xiàn)狀分析[J]. 農(nóng)學(xué)學(xué)報(bào), 2014, 4(1): 60-63.
楊祥燕, 蔡元保, 張治禮, 等. 菠蘿MADS-box基因AcMADS2的克隆與表達(dá)分析[J]. 植物生理學(xué)報(bào), 2016, 52(9): 1406-1412.
蔡元保, 楊祥燕, 孫光明, 等. 菠蘿葉片色澤、色素及抗氧化活性的關(guān)系[J]. 植物科學(xué)學(xué)報(bào), 2017, 35(2): 283-290.
蔡元保, 楊祥燕, 孫光明, 等. 菠蘿花發(fā)育相關(guān)基因AcMADS1的克隆與組織表達(dá)特性分析[J]. 植物學(xué)報(bào), 2014, 49(6): 692-703.
馬海洋, 趙秋芳, 陳 ?曙, 等. 菠蘿PEPC基因家族生物信息學(xué)分析[J]. 熱帶作物學(xué)報(bào), 2020, 41(1): 97-103.
Ooka H, Satoh K, Doi K, et al. Comprehensive analysis of NAC family genes in Oryza sativa and Arabidopsis thaliana[J]. DNA Research, 2003, 10(6): 239-247.
王春雨, 張 ?茜. 植物NAC轉(zhuǎn)錄因子功能研究進(jìn)展[J]. 生物技術(shù)通報(bào), 2018, 34(11): 14-20.
王 ?洋, 柏 ?錫. 大豆NAC基因家族生物信息學(xué)分析[J]. 大豆科學(xué), 2014, 33(3): 325-333.
姜秀明, 牛義嶺, 許向陽(yáng). 番茄NAC基因家族的系統(tǒng)進(jìn)化及表達(dá)分析[J]. 分子植物育種, 2016, 14(8): 1948-1964.
李德龍, 周 ?軍, 王大瑋, 等. 蘋果NAC轉(zhuǎn)錄因子的克隆與全基因組生物信息學(xué)分析[J]. 基因組學(xué)與應(yīng)用生物學(xué), 2017, 36(6): 2507-2517.
Su H, Zhang S, Yuan X, et al. Genome-wide analysis and identification of stress-responsive genes of the NAM-ATAF1, 2-CUC2 transcription factor family in apple[J]. Plant Physiology and Biochemistry, 2013, 71: 11-21.
Ernst H A, Olsen A N, Larsen S, et al. Structure of the conserved domain of ANAC, a member of the NAC family of transcription factors[J]. EMBO Reports, 2004, 5(3): 297-303.
Hao Y J, Song Q X, Chen H W, et al. Plant NAC-type transcription factor proteins contain a NARD domain for repression of transcriptional activation[J]. Planta, 2010, 232(5): 1033-1043.
梁 ?芳, 張 ?燕, 郝平安, 等. 太行菊NAC轉(zhuǎn)錄因子基因OpNAC1的克隆及生物信息學(xué)分析[J]. 分子植物育種, 2018, 16(11): 3477-3486.
Tak H, Negi S, Ganapathi T R. Banana NAC transcription factor MusaNAC042 is positively associated with drought and salinity tolerance[J]. Protoplasma, 2017, 254(2): 803-816.
Jeong J S, Kim Y S, Redillas M C, et al. OsNAC5 overexpression enlarges root diameter in rice plants leading to enhanced drought tolerance and increased grain yield in the field[J]. Plant Biotechnology Journal, 2013, 11(1): 101-114.
Huang L, Hong Y, Zhang H, et al. Rice NAC transcription factor ONAC095 plays opposite roles in drought and cold stress tolerance[J]. BMC Plant Biology, 2016, 16(1): 203.
Hong Y B, Zhang H J, Huang L, et al. Overexpression of a stress-responsive NAC transcription factor gene ONAC022 improves drought and salt tolerance in rice[J]. Frontiers Plant Science, 2016, 7: 4.
Liu Y Z, Baig M N R, Fan R, et al. Identification and expression pattern of a novel NAM, ATAF, and CUC-like gene from Citrus sinensis Osbeck[J]. Plant Molecular Biology Reporter, 2009, 27(3): 292-297.
責(zé)任編輯:謝龍蓮

