芒果MiFY基因克隆和表達模式分析
范志毅 羅聰 余海霞 曾學梅 王金英 謝小杰 何新華


摘 ?要:FY是擬南芥自主途徑中調控成花的基因,FY通過與RNA結合蛋白FLOWERING CONTROL LOCUS A (FCA)相互作用下調成花抑制基因FLOWERING LOUS C (FLC)的表達從而促進開花。目前關于FY基因如何調控芒果成花的機制尚無研究報道。通過挖掘芒果轉錄組數據克隆獲得1個FY基因,命名為MiFY。生物信息學分析顯示,MiFY基因的ORF全長為2178?bp,編碼725個氨基酸,蛋白質分子量為799.59?kDa,理論等電點為8.72,氨基酸序列中含有WD40和Cytadhesin_P30兩個保守結構域。基因表達模式分析顯示,MiFY基因在2個芒果品種的開花期均具有較高的表達水平,而在營養生長期表達水平較低。因此推測MiFY基因可能在調節芒果成花中起著重要作用。
關鍵詞:芒果;開花基因;FY;克隆;表達模式
Abstract: FY is a flowering gene in the autonomous pathway of Arabidopsis thaliana. The expression of the flower suppressor gene FLC is down regulated by interaction with the RNA binding protein FLOWERING CONTROL LOCUS (FCA). The mechanism of how FY gene regulating the flower formation in mango has not been studied. In the study, a FY homologous gene was obtained from the transcriptome data of mango, named MiFY. Sequences analysis showed that the open reading frame of the gene had 2178?bp which encoding 725 amino acids. The molecular weight was 799.59?kDa and isoelectric point was 8.72, respectively. Conserved domain analysis showed that FY protein contained two conserved domains, WD40 and Cytadhesin_P30. Expression analysis showed that MiFY expressed in all tested tissues but with expression level differences. MiFY gene was higher expressed during the flowering development period and lower expressed during the vegetative growth period. The results indicated that MiFY gene may play an important role in regulating mango flowering.
Keywords: mango; flowering gene; FY; cloning; expression pattern
成花轉變是高等植物生長發育重要的生理過程之一。通過對模式植物擬南芥成花分子機制的研究發現,參與植物成花調控的途徑包括光周期途徑、春化途徑、赤霉素途徑、年齡依賴途徑、溫敏途徑和自主途徑[1]。在沒有外源開花信號誘導的條件下,植物的營養生長達到一定階段后也會開花的途徑叫做自主途徑[2]。其中,擬南芥的自主途徑通過下調成花抑制基因FLOWERING LOUS C(FLC)的表達而促進開花[3]。目前自主途徑至少包括7個基因:FY、FLOWERING CONTROL LOCUS A (FCA)、FLOWERING LOCUS D (FLD)、FLOWERING LOCUS K (FLK)、LUMINIDEPENDENS (LD)、FPA、FVE,任何一個基因的突變都會增加FLC的表達,導致開花延遲[4-5]。其中,FY基因作為一個高度保守的開花時間調控基因,是一個具有特殊C末端的真核蛋白聚腺苷酸化特異性因子(leavage and polyadenylation specificity factor,CPSF)復合物的亞單位,FY基因的C末端有2個植物獨有的Pro-Pro-Leu-Pro-Pro(PPLPP)結構域,可與FCA-WW結構域相互作用形成復合體,FCA/FY復合體是RNA 3端的剪切因子,可調節FLC前體mRNA 3端剪切,抑制FLC基因的表達從而提早開花[6-8],也可在缺少FCA的情況下自主抑制FLC基因的表達[9]。因此,FY基因對于植物的開花調控極其重要。目前已克隆出少數木本植物FY同源基因,但進一步的功能研究還較少。
芒果(Mangifera indica L.)為漆樹科芒果屬果樹,是世界著名熱帶果樹,其較長的童期是芒果新品種選育的最大障礙。目前在芒果成花研究中已有FLOWERING LOCUS T (FT)、CONSTANS (CO)、APETALA1 (AP1)等成花基因的相關研究[10-13],但還沒有關于FY基因的報道。本研究以廣西地區一年能夠多次成花多次結果(4~5次)的‘四季蜜芒和一年開花結果一次的‘臺農一號芒為供試材料,克隆獲得MiFY基因,對其序列進行生物信息學分析,同時通過實時熒光定量對其時空和組織表達進行分析,以明確MiFY基因的序列特征及在2個具有不同成花習性芒果品種正常花發育不同時期的表達模式,為深入研究FY基因在調控芒果成花過程中的功能奠定基礎。
1 ?材料與方法
1.1 ?材料
供試材料為16年生‘四季蜜芒和‘臺農一號芒,種植于廣西大學農學院果樹標本園。組織表達特性和年周期樣品采集分別為2018年11月5日、12月5日,以及2019年1月4日和29日、3月6日的‘四季蜜芒和‘臺農一號芒的成熟葉、成熟莖和芽/花。采樣時間統一定為17:00—18:00,樣品采集后立即放入?80?℃冰箱冷凍保存。
1.2 ?方法
1.2.1 ?RNA的提取及cDNA的合成 ?采用天根生化科技(北京)有限公司的RNAperp Pure多糖多酚植物總RNA提取試劑盒提取芒果RNA,方法參考試劑盒說明書。逆轉錄采用TaKaRa公司的Reverse Transcriptase M-MLV(RNase H-)反轉錄酶合成第一鏈cDNA,用雙蒸水稀釋cDNA濃度至100?ng/μL,保存于?40?℃備用。
1.2.2 ?MiFY基因的克隆與序列信息分析 ?以反轉錄得到的cDNA為模板,根據前期芒果轉錄組測序獲得的MiFY基因序列設計特異引物。其中正向引物為MiFYu(5-ATGATGT ACGC TGA T CCTCA-3),反向引物為MiFYd(5-CCTACTGC GGCGTTTGGCTA-3)。PCR體系為25?μL,擴增程序為:95?℃預變性3?min;95?℃變性40?s,54?℃退火40?s,72?℃延伸150?s,36個循環;最后在72?℃下延伸10?min。用1.6%瓊脂糖凝膠電泳檢測PCR產物,將目標片段利用膠回收試劑盒進行純化,并連接至pMD18-T載體上,然后轉化大腸桿菌DH5α感受態。涂板后挑選單菌落進行菌落PCR檢測,經篩選的陽性克隆被送往生工生物工程(上海)股份有限公司進行測序。為了預測MiFY蛋白的生物學功能,在NCBI數據庫的Conserved Domain Search中搜索MiFY蛋白同源序列。利用DNAMAN 8.0軟件進行同源氨基酸序列比對,然后用鄰接法(Neighbour-Joining, N-J)進行聚類分析并構建系統發育樹。
1.2.3 ?MiFY基因時空和組織特異性表達分析 ?根據MiFY基因序列設計熒光定量PCR引物。正向引物為qMiFYu(5-CATCAGCAGAATCAG CCGCAG-3),反向引物為qMiFYd(5-GA G TAGTGGACGAGGCAGACG-3)。以芒果Actin1為內參基因[14],引物為qActinu(5-CCGAGACAT GAAGGAGAAGC-3),qActind(5-GTGG TC TCATGGATACGAGCA-3)。實時熒光定量PCR儀器為ABI7500。擴增反應體系和程序參照試劑盒SYBR Premix Dimer Eraser(TaKaRa)說明書進行。以50?ng/?L的cDNA為模板,反應總體系為20??L,其中cDNA 1.5??L,上下游引物各0.5??L,SYBRⅡ 10??L,ROXⅡ 0.4??L,超純水7.1??L。PCR程序為:95?℃ 30?s;95?℃ 5?s,60?℃ 34?s,95?℃ 15?s,60?℃ 1?min,40個循環;95?℃ 15?s。采用2?ΔΔCT法計算相對表達水平[15]。
2 ?結果與分析
2.1 ?MiFY基因的克隆
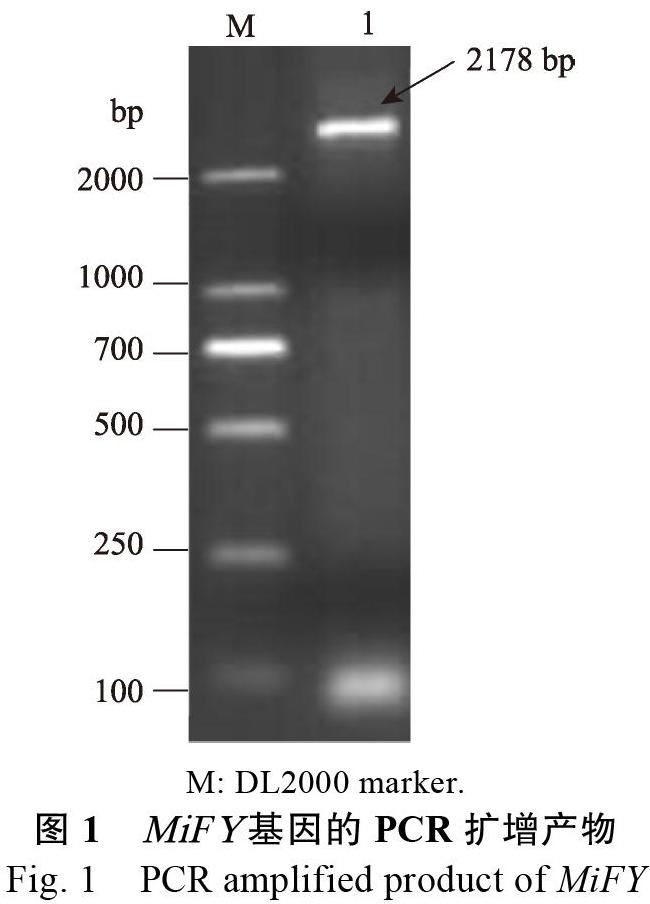
在前期轉錄組研究中,獲得了1個FY基因的全長。為了驗證FY基因序列的正確性,設計了能夠擴增基因全長編碼區的特異引物,以逆轉錄產物cDNA為模板,通過RT-PCR法克隆‘四季蜜芒MiFY基因,電泳檢測顯示成功獲得1條長度約為2200?bp的條帶,與目的條帶大小一致(圖1)。將克隆結果送生工生物工程(上海)股份有限公司測序,獲得的序列長度為2178?bp,與轉錄組獲得的序列一致。
2.2 ?MiFY基因生物信息學分析
利用IBS 1.0軟件描述MiFY蛋白結構域,結果表明,MiFY由7個連續重復的WD40和2個PPLPP結構域組成(圖2)。利用DNAMAN 8.0將MiFY與柑橘、橡膠樹等其他植物的氨基酸序列進行比對,其中,單下劃線為WD40結構域,雙下劃線為PPLPP結構域(圖3)。為了分析MiFY的親緣關系,使用DNAMAN 8.0的N-J方法進行聚類分析,并構建系統發育樹(圖4)。結果顯示,芒果MiFY與柑橘CsFY1同源性最高,氨基酸相似性為86.48%,在進化上和柑橘(CsFY)、蓖麻(RcFY)較為接近,同源性分別為86.07%、84.17%。由此可確定克隆所得基因為芒果FY同源基因MiFY,GenBank登錄號為MT199952。
2.3 ?MiFY基因表達模式分析
為了探討MiFY基因在不同組織和不同成花時期的表達模式,在芒果成花不同發育時期,分別采集莖、葉和芽/花為材料進行熒光定量檢測(圖5),結果表明,在‘四季蜜芒中,FY基因在各個測試組織的各個時期均表達,但在芒果的成花誘導期之前表達水平偏低,而誘導期之后表達水平迅速上升,其中在成熟葉和芽中的上升水平高于成熟莖中的表達。MiFY基因的最高表達高峰出現在開花期的成熟葉中,其次是在花芽分化期的頂芽中。在‘臺農一號芒中,MiFY基因模式與在‘四季蜜芒中的表達情況類似,均在成花誘導期之前表達水平很低,但其表達高峰主要出現在花芽分化后期和成花期,MiFY基因的最高表達高峰出現在花芽分化期的頂芽中,其次是在花芽分化期的成熟莖中,而在開花期的花中也有很高的表達水平。在2個不同的品種中,MiFY基因的整體表達趨勢類似,但又存在著組織表達差異。
3 ?討論
近年來,借助擬南芥突變體,影響植物成花的很多基因被挖掘出來,植物成花調控網絡的研究也越來越深入。與模式植物擬南芥相比,木本果樹具有較長的童期,嚴重影響果樹的育種進程,因此對果樹成花基因的挖掘與功能研究對縮短木本果樹的童期具有重要意義。FY基因作為自主途徑中調控植物成花的重要基因,其具有多重功能。據報道,FY基因的主要功能是正確定位成花抑制基因FLC的多腺苷化而控制開花時間[9]。FY作為FLC的激活劑和抑制劑在調控開花時間中具有雙重作用,可與FCA相互作用抑制FLC活性,也可通過激活FLC的表達而延遲開花[16]。此外,FY在種子休眠、ABA響應、胚胎發育等過程中發揮作用[17-18]。最新研究結果表明,FY在mRNA多腺苷化中具有保守性和特異性功能[19]。因此,研究和闡明FY基因在開花途徑中的調控機理,對探索木本植物花期調控具有重要意義。
目前,FY基因的功能研究僅在少數單子葉植物(水稻、黑麥草、蝴蝶蘭)和雙子葉植物(擬單南芥)中[20-21, 23],在木本植物中的調控機制尚未見系統報道。鑒于此,本研究在前期已完成芒果轉錄組測序的基礎上,成功獲得1個FY同源基因,采用RT-PCR技術從‘四季蜜芒中克隆得到了MiFY的編碼區序列,對其氨基酸序列特性和蛋白結構進行分析,并分析MiFY在2個芒果品種中的表達模式。結果顯示,MiFY包含7個WD重復區域和2個PPLPP保守結構域,與前人報道相同[20, 22]。其中,第一個PPLPP保守結構域在C端區高度保守,與前人研究結果一致[7]。系統發育樹顯示,芒果的MiFY與柑橘進化關系最近,它們都屬于木本植物,這符合植物各科屬在進化中的關系。黃玉婷[23]研究發現FY基因在蝴蝶蘭各個發育時期均表達,其中在第84天表達量最高,之后持續緩慢降低。本研究中MiFY基因在2個不同開花習性芒果品種的所有測試組織中均表達,但存在組織表達差異,并且發現MiFY基因在2個芒果品種成花期均大量表達,而在營養生長期表達水平較低,這與在蝴蝶蘭中的結果類似。因此可以推測MiFY基因在不同芒果品種的成花過程均發揮重要作用。
本研究通過對芒果MiFY基因的克隆、序列分析和基因表達模式分析,為進一步深入研究MiFY基因的功能奠定基礎。
參考文獻
Ahmad S, Li Y S, Yang Y J, et al. Isolation, functional characterization and evolutionary study of LFY1 gene in Prunus mume[J]. The Plant Cell, 2019, 136(3): 523-536.
Simpson G G, Dean C. Arabidopsis, the Rosetta stone of flowering time[J]. Science, 2002, 296(5566): 285-289.
Michaels S D, Amasino R M. FLOWERING LOCUS C encodes a novel MADS domain protein that acts as a repressor of flowering[J]. The Plant Cell, 1999, 11(5): 949-956.
Michaels S D, Amasino R M. Loss of FLOWERING LOCUS C activity eliminates the late-flowering phenotype of FRIGIDA and autonomous pathway mutations but not responsiveness to vernalization[J]. The Plant Cell, 2001, 13(4): 935-941.
Putterill J, Laurie R, Macknight R. Its time to flower: The genetic control of flowering time[J]. Bioessays, 2004, 26: 363-373.
Sudol M, Hunter T. New wrinkles for an old domain[J]. Cell, 2000, 103(7): 1001-1004.
Simpson G G, Dijkwel P P, Quesada V, et al. FY is an RNA 3 end processing factor that interacts with FCA to control the Arabidopsis floral transition[J]. Cell, 2003, 113(10): 777-787.
Henderson I R, Liu F, Drea S, et al. An allelic series reveals essential roles for FY in plant development in addition to flowering-time control[J]. Developmental Biology, 2005, 132(16): 3597-3607.
Feng W, Jacob Y, Veley K M, et al. Hypomorphic alleles reveal FCA-independent roles for FY in the regulation of FLOWERING LOCUS C[J]. Plant Physiology, 2011, 155(3): 1425-1434.
Vyavahare S N, Krishna B, Joshi S S, et al. Characterization of mango Flowering Locus T (FT) and Terminal Flower 1 (TFL1) genes[J]. Acta Horticulturae, 2017(1183): 113-124.
徐 ?趁, 羅 ?聰, 余海霞, 等. 杧果MiCO基因的克隆與表達模式分析[J]. 果樹學報, 2017, 34(4): 418-426.
Luo C, Yu H X, Fan Y, et al. Research advance on the flowering mechanism of mango[J]. Acta Horticulturae, 2019(1244): 17-22.
Yu H X, Luo C, Fan Y, et al. Isolation and characterization of two APETALA1-Like genes from mango (Mangifera indica L.)[J]. Scientia Horticulturae, 2020, 259: 108814.
Luo C, He X H, Chen H, et al. Molecular cloning and expression analysis of four actin genes (MiACT) from mango[J]. Biologia Plantarum, 2013, 57(2): 238-244.
Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1101-1108.
Feng W, Michaels S D. Dual roles for FY in the regulation of FLC[J]. Plant Signaling & Behavior, 2011, 6(5): 703-705.
Cyrek M, Fedak H, Ciesielski A, et al. Seed dormancy in Arabidopsis thaliana is controlled by alternative polyadenylation of DOG1[J]. Plant Physiology, 2016, 170(2): 947-955.
Jiang S L, Kumar S, Eu Y J, et al. The Arabidopsis mutant, fy-1, has an ABA-insensitive germination phenotype[J]. Journal of Experimental Botany, 2012, 63(7): 2693-2703.
Yu Z B, Lin J C, Li Q S. Transcriptome analyses of FY mutants reveal its role in mRNA alternative polyadenylation[J]. The Plant Cell, 2019, 31(10): 2332-2352.
Winichayakul S, Beswick N L, Dean C, et al. Components of the Arabidopsis autonomous floral promotion pathway, FCA and FY, are conserved in monocots[J]. Functional Plant Biology, 2005, 32(4): 345-355.
Lu Q, Xu Z K, Song R T. OsFY, a homolog of AtFY, encodes a protein that can interact with OsFCA-γ in rice (Oryza sativa L.)[J]. Acta Biochimica et Biophysica Sinica, 2006, 38(7): 492-499.
Marquardt S, Boss P K, Hadfield J, et al. Additional targets of the Arabidopsis autonomous pathway members, FCA and FY[J]. Journal of Experimental Botany, 2006, 57(13): 3379-3386.
黃玉婷. 蝴蝶蘭光周期和自主成花途徑相關基因表達譜分析[D]. 杭州: 浙江農林大學, 2015.
責任編輯:黃東杰

