新疆雙峰駝乳酪蛋白血管緊張素轉化酶抑制肽的酶法制備和抑制特性
劉 宸,王學清,豆智華,王 俊,李榮蓉,徐趙玉,楊 潔
(新疆大學生命科學與技術學院,新疆 烏魯木齊 830046)
血管緊張素轉化酶(angiotensin converting enzyme,ACE)是通過腎素-血管緊張素系統調節血壓的一種關鍵酶[1],它是一種膜結合外在金屬蛋白酶,主要存在于肺組織、外周血管組織和血管內皮細胞及其他種類的細胞中[2]。ACE可以使無活性的血管緊張素Ⅰ的C末端水解2 個氨基酸后轉變成有活性的血管緊張素Ⅱ,血管緊張素Ⅱ可以降低血液流速,減少腎臟水分和鹽的分泌,導致血管平滑肌收縮,引發高血壓,同時ACE可水解血管舒緩激肽,使其失活,而血管舒緩激肽可以舒張血管,使血壓降低,當舒緩激肽受到抑制而血管緊張素Ⅱ的活性增加后,就會引發高血壓[3]。因此,以ACE為靶點的藥物研究引起了越來越多的關注,ACE已被證明在降低高血壓方面是成功的[4-5]。自1977年根據ACE底物的化學結構推測出ACE活性部位的模型并據此開發設計了第1個化學合成的ACE抑制劑卡托普利(Captopril)以來,ACE抑制劑藥物在高血壓治療中的作用得到了醫學界的普遍認可,但其對腎臟的毒副作用使研究者開始尋找安全性更高的ACE抑制劑[6]。天然來源的ACE抑制肽具有安全性高、毒副作用小、易吸收等特點,有著合成化學藥物不可比擬的優越性,成為抗高血壓藥物研究的熱點之一,其中食品來源的ACE抑制劑更是研究熱點[7]。生物活性肽是食物蛋白質的特殊片段,對人體健康具有一定的生理功能,它們存在于完整的食物蛋白質中,可在食品加工過程中釋放,如發酵、體外或體內酶水解[8-9]。
根據聯合國糧農組織的統計數據,世界上約有2 900 萬峰駱駝[10]。而新疆駱駝占比為全國首位,主要為準噶爾雙峰駝,泌乳期長達12~14 個月,全疆雙峰駝乳的年產量可達到3.2 萬t[11]。由于駝乳含有豐富的生物活性肽和保護酶,其對氧化損傷、腸胃疾病、肝炎和糖尿病都具有良好的治療作用[12]。同時由于駝乳中含有豐富的α-乳白蛋白,缺乏β-乳球蛋白,具有與母乳相似的蛋白結構,因此引起的過敏反應會大大降低[13]。目前多項研究證明,駝乳中含有豐富的ACE抑制肽,有研究者發現駝乳的全酪蛋白和β-酪蛋白經消化水解后,抗氧化活性和ACE抑制活性得到明顯提高[14]。也有研究者對駝乳在不同蛋白酶水解下的產物ACE抑制活性進行比較,并分離出具有降血壓功能的肽段[15-16]。同時,對比不同菌株發酵后駝乳和牛乳的活性發現,經發酵后的駝乳具有較高的抗氧化活性和ACE抑制活性,對人結直腸腺癌細胞(Caco-2)、人乳腺癌細胞(MCF-7)和人宮頸癌細胞(HELA)有較強的增殖抑制作用[17]。發酵后的駝乳對自發性高血壓大鼠的降血壓效果更好,其ACE抑制活性也更強[18]。同時有研究者通過質譜檢測在水解后駝乳樣品中發現多種具有ACE抑制活性的肽段[19]。目前國內研究大多針對牛乳或羊乳,對駝乳的ACE抑制肽活性研究報道較少。實驗室前期研究發現,駝乳的確能夠對高血壓大鼠起到降低血壓的作用,駝乳進入體內需要經過胃腸道的消化,因此本研究在體外模擬駝乳酪蛋白在體內的消化過程,檢測水解液對ACE的抑制活性,對駝乳酪蛋白降血壓能力進行評價。
1 材料與方法
1.1 材料與試劑
駝乳采自新疆烏魯木齊市紅雁池哈薩克村牧民家準噶爾雙峰駝。
馬尿酰-組氨酰-亮氨酸(Hip-His-Leu,HHL)標準品、ACE、Tris、甲醛、卡托普利 美國Sigma公司;馬尿酸(hippuric acid,HA)標準品 日本東京化成工業株式會社;胃蛋白酶(1∶3 000)、胰蛋白酶(1∶250)上海藍季科技發展有限公司;乙腈 美國Fisher公司;三氟乙酸(trifluoroacetic acid,TFA) 成都市科龍化工試劑廠;氫氧化鈉、鹽酸、氯化鈉、硼砂、硼酸(均為分析純) 天津市福晨化學試劑廠。
1.2 儀器與設備
LC-10ATvp高效液相色譜儀(配備UV檢測器(SPD-10Avp)和脫氣裝置(DGU-12A)) 日本島津公司;Shimpack VP-ODS色譜柱(150 mm×4.6 mm,5 μm) 日本島津公司;PHS-2F精密pH計 上海精密科學儀器有限公司;3K30低溫離心機 德國Sigma公司;SHB-BA15華牌循環水真空泵 河南鞏義市英峪予華儀器廠;B3200S超聲波清洗儀 美國Branson公司;AL104電子天平 梅特勒-托利多儀器(上海)有限公司;超濾離心管(50、10、3 kDa) 美國Millipore公司;ALPHA 1-2 LD真空冷凍干燥機 德國Martin Christ公司;基質輔助激光解析電離-串聯飛行時間質譜(matrix assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF/TOF-MS)蛋白質組分析儀 美國應用生物系統公司。
1.3 方法
1.3.1 駝乳酪蛋白的制備
駝乳用4 層無菌紗布過濾除去雜質,3 500 r/min離心15 min,除去上層脂肪,反復多次離心,直至上層無脂肪為止,收集脫脂乳,備用。用1 mol/L HCl調節pH值至4.6,8 000 r/min離心10 min,沉淀部分(酪蛋白)用溫蒸餾水反復沖洗3 次,冷凍干燥,備用。
1.3.2 駝乳酪蛋白的單酶水解和復合酶水解
單酶水解:采用2 種蛋白酶(胃蛋白酶和胰蛋白酶)分別水解駝乳酪蛋白。酪蛋白溶解于0.05 mol/L NaOH,底物質量濃度為5 g/100 mL,攪拌溶解,40 ℃預水浴,用1 mol/L NaOH或1 mol/L HCl分別調節至pH 2(胃蛋白酶)和pH 8(胰蛋白酶);加入2%蛋白酶,反應過程中持續滴加NaOH或HCl維持反應體系pH值,分別水解0.5、1、2、3、4、5、6、8、10、12 h,取樣,測定蛋白質水解度。反應結束后,水解液經90 ℃水浴15 min滅酶,迅速冷卻到40 ℃,調節溶液pH值至4.6,冷卻,4 000 r/min低溫離心10 min,取上清液,調節pH值至7.0,冷凍干燥后冷藏,待分析。實驗重復3 次。
復合酶水解:在底物質量濃度5 g/100 mL、酶底比(E/S)0.4、水解溫度37 ℃、pH 2.0的條件下進行胃蛋白酶單酶水解,水解2 h后,90 ℃水浴15 min滅酶,冷卻至37 ℃后,調節反應pH值至8,加入胰蛋白酶水解,分別在反應后0.5、1、2、3、4 h取酶解產物,90 ℃水浴15 min滅酶,迅速冷卻到40 ℃,調節溶液pH值至4.6,冷卻,4 000 r/min低溫離心10 min,取上清液,調節pH值至7.0,冷凍干燥后冷藏,待分析。實驗重復3 次。
1.3.3 蛋白質水解度測定
蛋白質水解度按式(1)計算。

式中:h為水解后每克蛋白被裂解的肽鍵毫摩爾數/(mmol/g);htot為每克蛋白所含的肽鍵毫摩爾數(8.3 mmol/g)。
式(1)中,h按式(2)計算。

式中:ρ為底物蛋白質質量濃度/(g/mL);c為水解液中氨基氮濃度/(mmol/mL);c0為未水解底物溶液中氨基氮濃度/(mmol/mL)。
氨基氮濃度測定:采用甲醛滴定法,取樣品溶液10 mL置于小燒杯中,加入30 mL超純水,在攪拌狀態下以精密酸度計測定pH值;用0.05 mol/L NaOH標準溶液預滴定至pH 8.2,再加入10 mL中性甲醛,1 min后用0.05 mol/L NaOH標準溶液滴定至pH 9.2,并記錄消耗的NaOH標準溶液體積。
溶液中氨基氮濃度按式(3)計算。
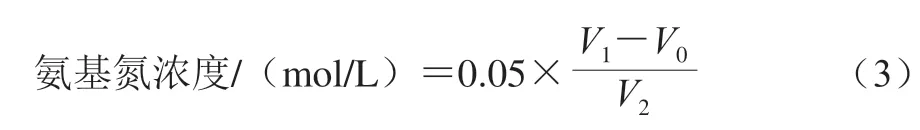
式中:0.05為NaOH標準溶液濃度/(mol/L);V0為空白組消耗NaOH標準溶液體積/mL;V1為樣品溶液消耗NaOH標準溶液體積/mL;V2為樣品溶液體積/mL。
1.3.4 ACE抑制率測定
1.3.4.1 樣本制備
采用HHL方法檢測ACE體外抑制率。
硼酸鹽緩沖液配制:用超純水配制含有0.3 mol/L NaCl的0.1 mol/L、pH 8.3硼酸鹽緩沖液。
HHL溶液配制:將HHL溶于硼酸鹽緩沖液,溶液濃度為5 mmol/L,分裝成1 mL,-20 ℃保藏。
ACE溶液配制:將0.25 U ACE用含有0.3 mol/L NaCl的50 mmol/L、pH 7.5 Tris-HCl溶液溶解,溶液濃度為100 mU/mL,分裝成250 μL,-20 ℃保藏。
對照組加入100 μL HHL溶液和25 μL硼酸鹽緩沖液,樣品組加入100 μL HHL溶液和25 μL酶解液,37 ℃水浴10 min,樣品組和對照組各加入10 μL ACE溶液,37 ℃水浴30 min,4 500 r/min離心5 min,各加入100 μL 1 mol/L HCl,終止反應后的樣品用0.45 μm微孔濾膜過濾,待檢測。
1.3.4.2 反相高效液相色譜(reversed phase-high performance liquid chromatography,RP-HPLC)法檢測
檢測條件:Shim-pack VP-ODS色譜柱(150 mm×4.6 mm,5 μm);流動相A:體積分數0.05% TFA-水溶液,流動相B:體積分數0.05% TFA-乙腈;檢測波長228 nm;流速0.5 mL/min;梯度洗脫程序:0~10 min、流動相B體積分數5%~60%,10~12 min、流動相B體積分數60%,12~13 min、流動相B體積分數60%~5%,13~17 min、流動相B體積分數5%;進樣量20 μL;溫度25 ℃;外標法定量。
酶解產物樣品用超純水溶解至0.4 mg/mL,ACE抑制率按式(4)計算。

式中:S對照為空白對照組HA的峰面積/(mAU·S);S樣品為添加酶解液組HA的峰面積/(mAU·S)。
取HA標品,用硼酸鹽緩沖液配制1 mg/mL母液,再用緩沖液稀釋成0.01、0.05、0.10、0.50、0.80、1.00 mg/mL,色譜方法檢測ACE抑制率,每個標準溶液平行測定3 次,取平均值,繪制標準曲線。
1.3.5 駝乳酪蛋白酶解產物的超濾分離
駝乳酪蛋白的酶解產物用超濾離心管進行50、10、3 kDa超濾分離,測定截留液的ACE抑制活性。
1.3.6 駝乳酪蛋白酶解產物與卡普里托抑制特性的比較
對比0.125、0.250、0.500、0.750、1.000 mmol/L底物(HHL)濃度下,0.4 mg/mL酪蛋白胰蛋白酶水解產物和0.02 μmol/L卡普里托對ACE的抑制活性,以Lineweaver-Burk作圖法確定抑制劑對酶促反應的抑制類型,然后根據抑制類型應用作圖法,根據米-曼式方程,求出抑制常數(Ki)。
1.3.7 駝乳酪蛋白酶解產物截留液的質譜檢測
將3~10 kDa的截留液樣品用于MALDI-TOF/TOF分析,在NCBI上查詢相關蛋白信息。
1.4 數據處理
用Excel和Prism 5軟件對數據進行線性關系和單因素方差分析。
2 結果與分析
2.1 駝乳酪蛋白水解產物中所含HA在RP-HPLC中的響應
以HA標品質量濃度(x,mg/mL)為橫軸,峰面積(y)為縱軸繪制標準曲線,得到線性方程為y=6×106x+123 872(R2=0.998 4),表明HA在0.01~1.00 mg/mL內線性關系良好,平均回收率為94.45%,相對標準偏差為3.2%,該方法的穩定性、精密度和重現性的相對標準偏差分別為1.51%、1.38%和1.03%,干擾較少、分析時間短、穩定性、精密度和重現性良好,此方法用于檢測ACE抑制活性穩定可靠。

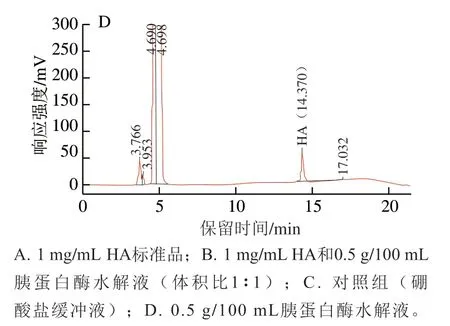
圖1 HA溶液和駝乳酪蛋白水解產物的RP-HPLC響應色譜圖Fig. 1 RP-HPLC chromatograms of HA and camel casein hydrolysates
HA溶液和駝乳酪蛋白水解產物中HA的RP-HPLC響應色譜圖如圖1所示。
2.2 駝乳酪蛋白酶解產物水解度和ACE抑制率
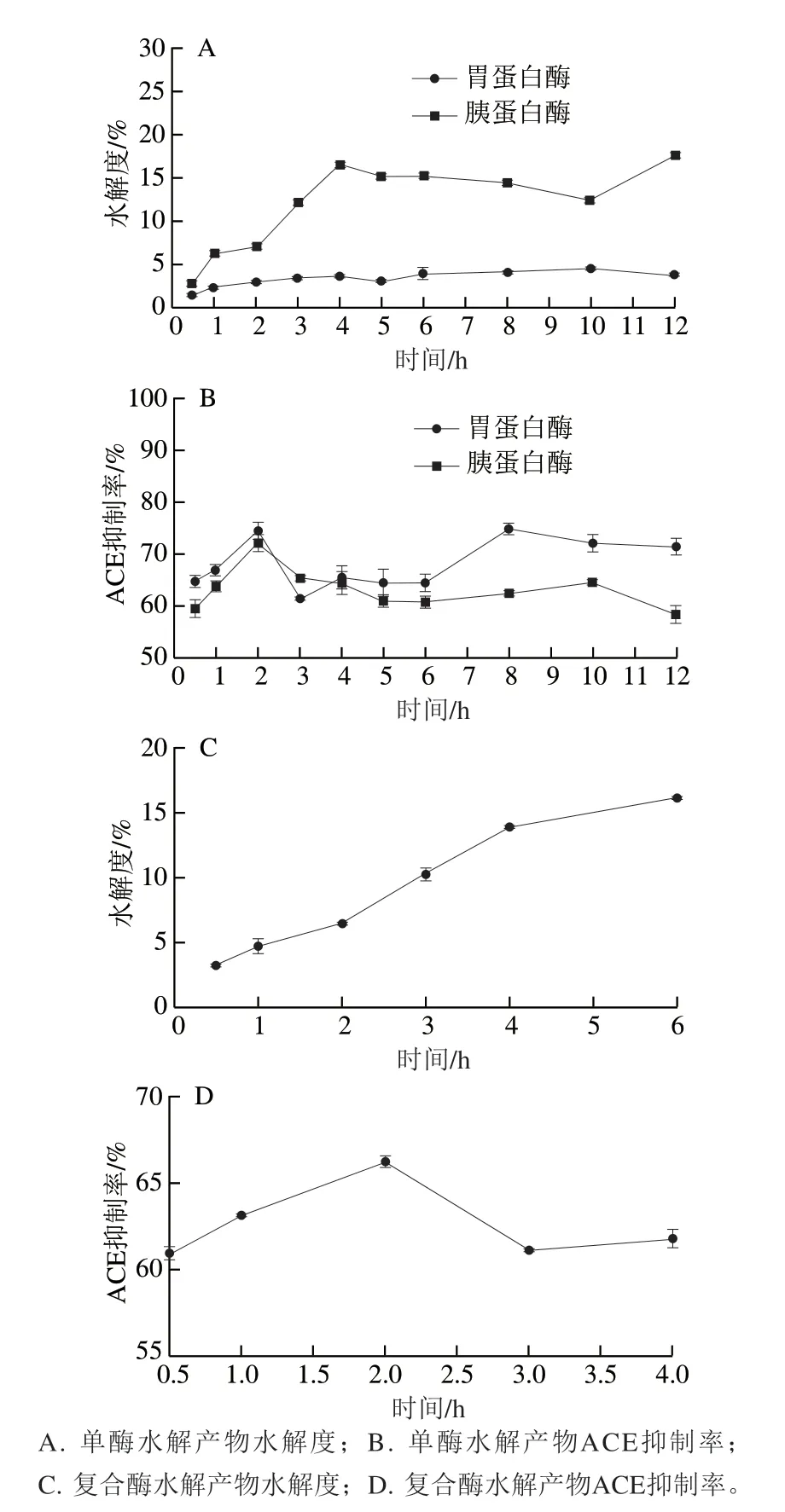
圖2 駝乳酪蛋白酶解產物水解度和ACE抑制率隨時間的變化Fig. 2 Changes in hydrolysis degree and ACE inhibition activity of camel milk casein with hydrolysis time
由圖2A、2B可知,由于蛋白酶水解位點的特異性,對酪蛋白的水解能力有所不同,同一時間,2 種蛋白酶水解酪蛋白的水解度不同。胃蛋白酶的水解能力最弱,其可斷裂苯丙氨酸、色氨酸、酪氨酸或纈氨酸等疏水性氨基酸殘基的氨基端肽鍵,水解度小于5%,未水解底物較多,水解2 h,ACE抑制率為74.67%左右。胰蛋白酶專一性較強,只斷裂賴氨酸殘基或精氨酸殘基的羧基參與形成的肽鍵,在水解4 h后,駝乳酪蛋白酶解產物水解度達到15%以上,ACE抑制率在2 h達到72.33%。2 種酶水解2 h時的ACE抑制率差異明顯,水解12 h內的水解度差異明顯,底物蛋白經蛋白酶水解一定時問后,反應體系中存在未水解大分子蛋白和部分水解的蛋白。
由圖2C、2D可知,駝乳酪蛋白在雙酶聯合酶解條件下,與單酶水解相比,組合酶解后酶解產物的水解度迅速上升,均高于單酶水解的水解度。水解度的增加表明酶解產物中氨基酸含量增加,即底物蛋白在雙酶水解作用下產生了更多短肽,酪蛋白在單酶水解作用一定時間后,底物中敏感肽鍵含量降低,由于酶作用的位點特異性使反應速率變慢,水解度變化趨向平緩,具有活性的多肽保持平衡,具有ACE抑制活性的多肽含量達到一定值不再增加,或是增加緩慢。而雙酶水解酪蛋白時,由于酶作用位點不同,溶液中的大分子多肽段在酶作用下發生變化,溶解肽段含量增加,水解度升高,但ACE抑制率并不隨著水解度的增加而增加,當進行雙酶水解時,加入胰蛋白酶可能作用于具有活性的肽段,因而引起酶活性的下降。
2.3 駝乳酪蛋白酶解產物半抑制質量濃度(half inhibitory concentration,IC50)及超濾組分ACE抑制活性
以酶解產物質量濃度的對數值作為橫坐標,ACE抑制率作為縱坐標,在質量濃度0.01~0.80 mg/mL范圍內得出線性關系:y=0.330 7x+0.996 8(R2=0.996 8),通過計算求出酪蛋白酶解產物的IC50為0.198 9 mg/mL。

圖3 胰蛋白酶酶解產物不同超濾液組分的ACE抑制率Fig. 3 ACE inhibitory activity of different fractions of ultrafiltration
由圖3可知,酪蛋白酶解產物經過50、10、3 kDa截留后,表現出不同的ACE抑制率,3 kDa截留液的ACE抑制活性最強。
2.4 駝乳酪蛋白酶解產物對ACE的抑制特性

表1 不同HHL濃度下水解產物中多肽及卡托普利的ACE抑制率Table 1 ACE inhibitory activity of casein peptides and captopril at different concentrations of HHL
由表1可知,卡托普利對ACE的抑制率隨底物濃度的降低而增加,這是競爭性抑制的典型表現,底物的增加與抑制劑競爭與酶結合,減輕了抑制劑對酶的抑制作用。不同底物濃度條件下,水解產物中多肽的ACE抑制率無明顯差異,由此可見,增加底物濃度不能消除多肽對ACE的抑制,符合非競爭性抑制劑的特點。
為研究水解產物對ACE抑制作用的特性,以Lineweaver-Burk作圖法確定抑制劑對酶促反應的抑制類型,然后根據抑制類型應用作圖法求得抑制常數(Ki)。
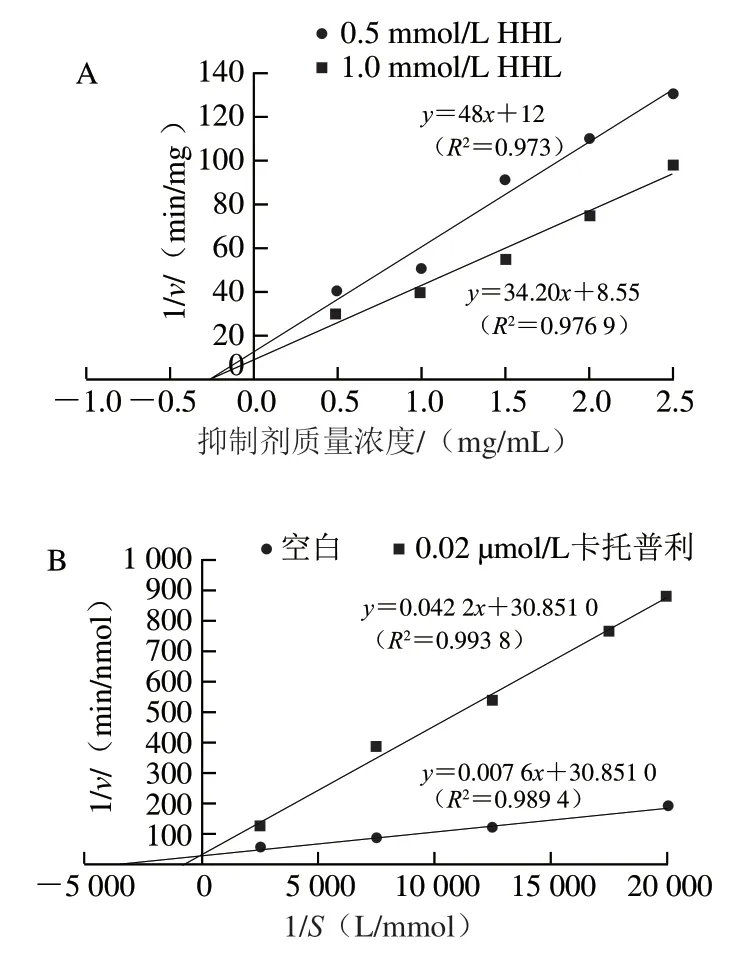
以Dixon作圖法求取多肽對ACE的Ki,以抑制劑質量濃度為橫坐標,以1/v為縱坐標,采用2 個底物濃度,繪制線性曲線,計算水解產物的Ki,如圖4A所示,直線交點的橫坐標為Ki,為0.25 mg/mL。
測定在不同底物濃度條件下,加入不同濃度的多肽、卡托普利與未加入抑制劑時的ACE抑制活性。由圖4B、4C可知,代表不同底物水解物的幾條直線與橫軸相交,直線斜率和縱軸截距隨水解產物濃度的增大而增大,可推斷酶解產物對ACE的抑制為非競爭性抑制。卡托普利是典型的ACE競爭性抑制劑,在抑制劑存在時,直線斜率增大,與無抑制劑的曲線相交于縱軸。
2.5 駝乳酪蛋白酶解產物3~10 kDa截留液中的肽段
3~10 kDa截留液通過質譜檢測得到的主要蛋白質和肽段如表2~3所示。
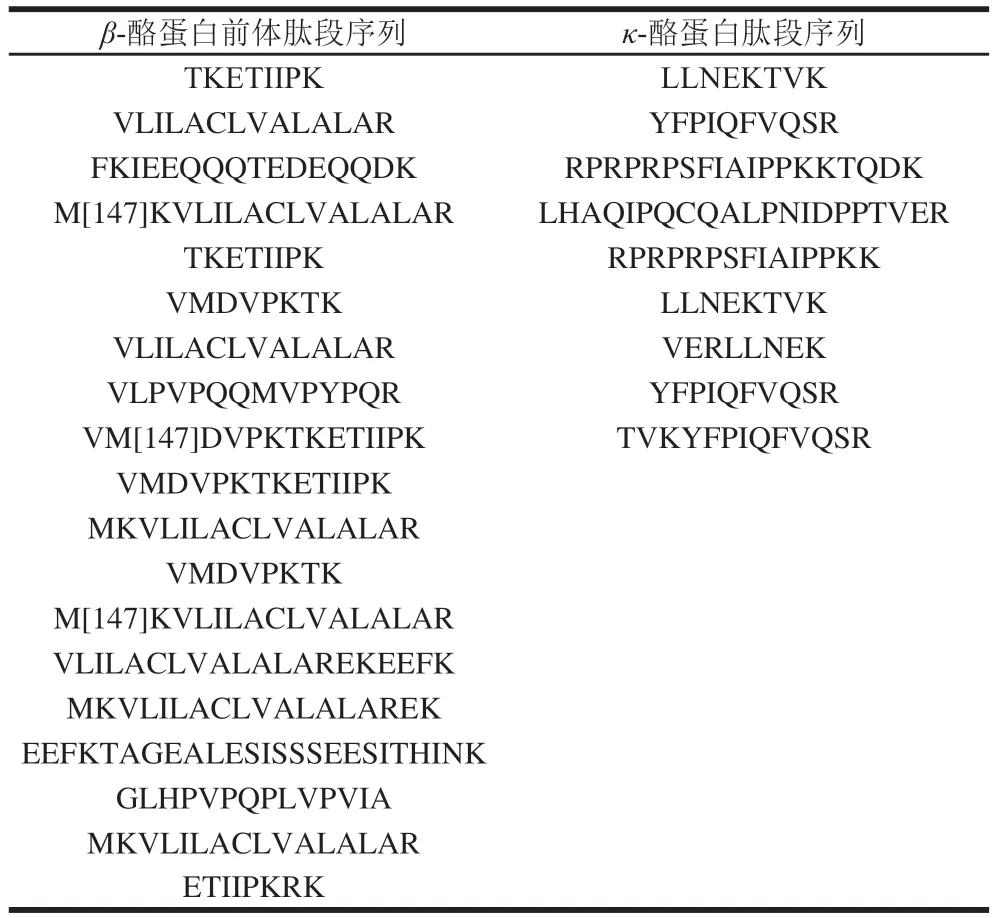
表3 駝乳酪蛋白酶解產物3~10 kDa截留液中酪蛋白肽段序列Table 3 Sequences of casein peptides in 3- 10 kDa retenate
由表2~3可知,3~10 kDa組分中含有多種乳清蛋白肽段,這可能是在酪蛋白的制備過程中,乳清蛋白共沉淀下來,分離不佳。其中乳鐵蛋白含量較高,存在66 個小分子肽段,乳鐵蛋白不僅是中性粒細胞的組成成分,同時有增強免疫力和抗氧化等生物功能。同時也發現了存在和氧化應激相關的101 個肽段,大部分來自谷胱甘肽硫轉移酶和超氧化物歧化酶,這為駝乳具有抗氧化功能的效果提供了理論基礎。同時還發現其具有多種瘦素以及和糖原合成相關的糖原合酶1型蛋白和降低血糖的胰島素肽段共295 個,這也與駝乳能夠降低脂肪堆積和起到降糖效果相對應。在來源于血紅蛋白亞基β和酪蛋白前體肽段中,發現2 條多肽結構與已知具有ACE抑制活性多肽(LLVVYPWTR和VLPVPQQMVPYPQR)相似,這也為水解液的ACE抑制活性提供了理論依據。
3 結 論
駝乳原本的ACE抑制活性較低,但經過蛋白酶水解后,酪蛋白的ACE抑制活性增加,最終確定胰蛋白酶水解后的酪蛋白水解產物IC50為0.198 9 mg/mL。食物蛋白源的ACE抑制肽通常由蛋白酶在溫和條件下水解蛋白質獲得,由于酶作用位點特異性,酶解產物的肽鏈長度及肽段結構與蛋白酶的選擇相關。水解液中含有ACE抑制肽和無ACE抑制活性的多肽、游離氨基酸等多種物質,這些組分在酶的作用下發生變化,過程復雜,存在多種轉化方式,溶液中小分子肽段含量增加,但ACE抑制活性無明顯變化,有研究者認為與酶解液中生成了IC50較低的ACE抑制肽有關。Cheung等[20]研究認為,ACE抑制肽的抑制活性主要取決于C端氨基酸,C端氨基酸為芳香族氨基酸(Tyr、Trp、Phe)和Pro時其抑制活性最強,說明酶解產物的ACE抑制活性不僅與多肽鏈的長度有關,也與多肽氨基酸結構有關。本研究中雙酶水解酪蛋白,由于酶作用位點不同,溶液中的大分子多肽段在酶作用下發生變化,溶解肽段含量增加,水解度升高,但ACE抑制率并不隨著水解度的增加而增加,當進行雙酶水解時,加入胰蛋白酶可能作用于具有活性的肽段,因而引起酶活性的下降,吳建平等[21]在大豆降壓肽的研制中也觀察到了同樣的現象。經過3~10 kDa分子截留的組分表現出較強的ACE抑制活性;也有研究者通過蛋白酶K水解駝乳酪蛋白,并將水解產物進行超濾,同樣發現3 kDa的截留液具有較高的ACE抑制活性,與本研究結果一致[22]。本研究還發現駝乳酪蛋白水解產物對ACE的抑制為非競爭性抑制,反應底物HHL濃度的增加不能消除多肽對ACE的抑制,多肽的抑制常數為0.25 mg/mL。降血壓藥物卡托普利是ACE的競爭性抑制劑,其活性基團SH螯合ACE活性中心的Zn2+,抑制酶的活性[23]。而目前對食源性蛋白多肽對ACE抑制類型的報道不多。有研究者提出對酶促反應的抑制作用,非競爭性抑制劑優于競爭性抑制劑[24],這也說明駝乳具有和藥物聯合用藥的潛力。本研究發現了LLVVYPWTR和VLPVPQQMVPYPQR 2 條可能具有ACE抑制活性的多肽。Haines等[25]在鹿茸的發酵液中發現了具有ACE抑制活性的多肽LVVYPW、LVVYPWTQ和VVYPWTQ,這與本研究肽段LLVVYPWTR具有較高的相似度,其可能通過相同的空間結構來抑制ACE活性。Chen Li等[26]用復合酶水解牛乳后發現了具有抑制作用的肽段VLPVPQ,Soleymanzadeh等[27]利用乳酸菌PTCC1899發酵駝乳后發現了β-酪蛋白抗氧化活性肽MVPYPQR,而這2 個肽段與本研究檢出的屬于β-酪蛋白前體的肽段VLPVPQQMVPYPQR具有極高的相似性,不同的是本研究中的肽段是前2 個肽段之間用谷氨酰胺將二者連接。同時在κ-酪蛋白的肽段中具有和ACE抑制肽的肽段IPP相同結構的肽段,但可能由于酶的不同,其肽段過長,并未徹底將肽段IPP分離開,但這也說明水解液中含有多種具有ACE抑制活性的多肽,它們各自具體的抑制活性還需要后續進行實驗研究,但這些都解釋了駝乳對于輔助治療高血壓方面能起到良好的作用。
總的來說,雙酶水解相比單酶水解,駝乳酪蛋白水解度增加,但ACE抑制活性未隨著水解度的增加而增加,這可能是第2種蛋白酶(胰蛋白酶)作用于具有活性的肽段,因而引起酶活性的下降。經水解后的酪蛋白水解物與卡托普利符合非競爭性抑制劑的特點,多肽的抑制常數為0.25 mg/mL。且水解后3~10 kDa截留物的ACE抑制活性最好,對其質譜檢測發現了2 條與已知ACE抑制肽結構相似的肽段LLVVYPWTR和VLPVPQQMVPYPQR。

