楮實子多糖提取工藝及抗皮膚光老化能力研究*
祁永華,吳 迪,張晏航,吳鵬程,張 寧
(1.黑龍江中醫藥大學 佳木斯學院,黑龍江 佳木斯 154007;2.東北林業大學,黑龍江 哈爾濱 150040)
皮膚光老化主要機制為中波紫外線(UVB)穿透皮膚表皮層,導致皮膚內活性氧(ROS)的過量產生[1],而ROS 可誘導基質金屬蛋白酶(MMPs)活性增加,破壞細胞外基質,導致皺紋等皮膚老化癥狀的出現[ 7]。
楮實子化學成分主要包括生物堿、氨基酸、多糖等[2]。具有抗衰老、抗氧化等藥理作用[3,4]。為了了解楮實子多糖的抗氧化活性,有必要確定合理可行的提取工藝。本研究以正交試驗確定多糖的最佳提取工藝后,采用UVB 輻射人皮膚成纖維細胞復制光老化模型,研究楮實子多糖的抗氧化活性,為楮實子多糖在抗皮膚光老化方面提供實驗支持。
1 實驗部分
1.1 藥品與試劑
人皮膚成纖維細胞(ESF-1,北京協和細胞資源中心);楮實子(批號:191003 購自佳木斯市百盛藥材公司,經黑龍江中醫藥大學陳效忠教授鑒定為桑科植物構樹Broussoneria papyrifera(L.)Vent.的干燥成熟果實);D-無水葡萄糖對照品(批號:110833-201205,中國食品藥品檢定研究院);DMEM 培養液、胰蛋白酶、PBS,Gibco 公司;胎牛血清、二甲基亞砜、MTT,Sigma 公司。
1.2 主要儀器
YT-SY96 型酶標儀(上海熱電儀器有限公司);8-5K 型離心機(上海安亭科學儀器廠);FZ-A 型紫外線輻照計(北京師范大學光電儀器廠);IX-71-21PH 型Olympus 倒置顯微鏡(日本Olympus 公司);MS-500E 型半自動生化分析儀(四川美生公司)。
1.3 楮實子多糖提取工藝
1.3.1 楮實子多糖的提取 楮實子干燥后粉碎,稱取50g,加入750mL 蒸餾水,浸泡120min,置于水浴鍋中升溫至80℃,趁熱過濾,濾液濃縮至50mL,待冷卻后按照醇沉比1∶4 加入無水乙醇,放置過夜,離心,收集沉淀,用無水乙醇、丙酮、乙醚洗滌,即得楮實子粗多糖。
1.3.2 楮實子多糖含量測定 準確稱取葡萄糖對照品0.15g,定容至100mL 容量瓶中,制成濃度為1.5mg·mL-1的儲備液。取儲備液適量,配制成0.02、0.04、0.06、0.08、0.10mg·mL-1的濃度梯度,并分別加入1mL 苯酚和5mL H2SO4后混勻,于沸水浴中加熱10min,冷卻至室溫,測定吸光度(490nm),分別以濃度和吸光度為橫、縱坐標繪制標準曲線,得回歸方程為Y=6.550X+0.0423(r=0.9997),線性范圍為0~0.10mg·mL-1。取楮實子多糖提取液0.5mL,用2mL水稀釋,量取稀釋液1mL,加入1mL 苯酚和5mL H2SO4后混勻,于沸水浴中加熱10min,冷卻至室溫,測定吸光度并計算楮實子多糖含量。
1.3.3 單因素試驗優化楮實子多糖提取工藝
(1)提取溫度與楮實子多糖含量的關系 按照“1.3.1”項下的方法提取多糖、“1.3.2”項下的方法測定多糖含量,其他條件不變,比較在40、60、80、100℃的多糖含量,每個試驗重復3 次。
(2)提取次數與楮實子多糖含量的關系 按照“1.3.1”項下的方法提取多糖、“1.3.2”項下的方法測定多糖含量,其他條件不變,比較提取1、2、3、4 次的多糖含量,提取次數兩次或超過兩次的提取液需合并濾液后再濃縮至50mL,每個試驗重復3 次。
(3)料液比與楮實子多糖含量的關系 按照“1.3.1”項下的方法提取多糖、“1.3.2”項下的方法測定多糖含量,其他條件不變,比較料液比為1 號(1∶10)、2 號(1∶15)、3 號(1∶20)、4 號(1∶25)、5 號(1∶30)對楮實子多糖含量的影響,每個試驗重復3 次。
1.3.4 楮實子多糖提取工藝優化的正交試驗 根據單因素試驗結果,試驗以提取溫度、提取次數和料液比例為考察因素,設置每個因素3 個水平,采用四因素三水平正交試驗表(L9(34))設計正交試驗,以多糖含量為指標篩選最佳工藝。見表1。

表1 L9(34)正交試驗因素水平表Tab.1 Factors and levels of L9(34)orthogonal test
1.3.5 多糖提取工藝的驗證試驗 按照正交試驗篩選的最佳試驗條件,重復進行3 次試驗,測定楮實子多糖含量,評價優化后工藝的合理性。
1.4 楮實子多糖抗皮膚光老化能力
1.4.1 光老化模型建立 將處于對數生長期的ESF-1 用0.25%胰酶消化后接種于96 孔板,培養24h。待細胞全部貼壁后移除培養液,每孔加入100μL PBS 緩沖液,置于強度為70mJ·cm-2的中波紫外光下進行照射,用紫外線強度檢測儀監測強度,空白組不予照射。各試驗組移除PBS 緩沖液后,按試驗分組加入相應DMEM 培養液或含藥DMEM 培養液繼續培養。
1.4.2 試驗分組 將處于對數生長期的ESF-1 接種于96 孔板,分為空白組、模型組、維生素E 組(陽性組)、給藥組,各組均設5 個復孔。空白組給予DMEM 培養48h,模型組、維生素E 組、給藥組于70mJ·cm-2的UVB 照射后,分別給予DMEM 培養液、含維生素E 500μg·mL-1DMEM 培養液、含楮實子多糖500μg·mL-1DMEM 培養液繼續培養。
1.4.3 指標測定 取各組細胞上清液,按照SOD、MDA、GSH-PX 試劑盒說明書進行操作,分別測定其指標變化,以考察楮實子多糖抗UVB 所致細胞氧化損傷。
1.4.4 數據處理 采用SPSS 21.0 統計軟件進行分析。兩組間比較用獨立樣本t 檢驗,P<0.05 說明差異有顯著性意義。
2 結果與討論
2.1 單因素試驗結果
2.1.1 提取溫度的影響
圖1 為提取溫度與楮實子多糖含量的關系圖。

圖1 提取溫度與楮實子多糖含量的關系Fig.1 Relationship between extraction temperature and content of Fructus Broussonetiae polysaccharides
由圖1 可見,隨著提取溫度的升高,楮實子多糖含量亦隨之增高,表明升高溫度有利于楮實子多糖的提取,然而當溫度升至80℃后含量曲線接近與橫軸平行,表明隨溫度升高楮實子多糖含量無明顯變化,因此,選擇優化溫度范圍為70~90℃。
2.1.2 提取次數的影響
圖2 為提取次數與楮實子多糖含量關系圖。

圖2 提取次數與楮實子多糖含量的關系Fig.2 Relationship between extraction times and content of Fructus Broussonetiae polysaccharides
由圖2 可見,隨提取次數增加,多糖含量先大幅度增加后小幅度下降,原因為提取次數增加,提取液的量增加,濃縮時間延長,使少量植物多糖降解。當提取次數為2 次時,楮實子多糖含量最高,因此,選擇優化提取次數為1~3 次。
2.1.3 料液比的影響
圖3 為料液比與楮實子多糖含量的關系圖。
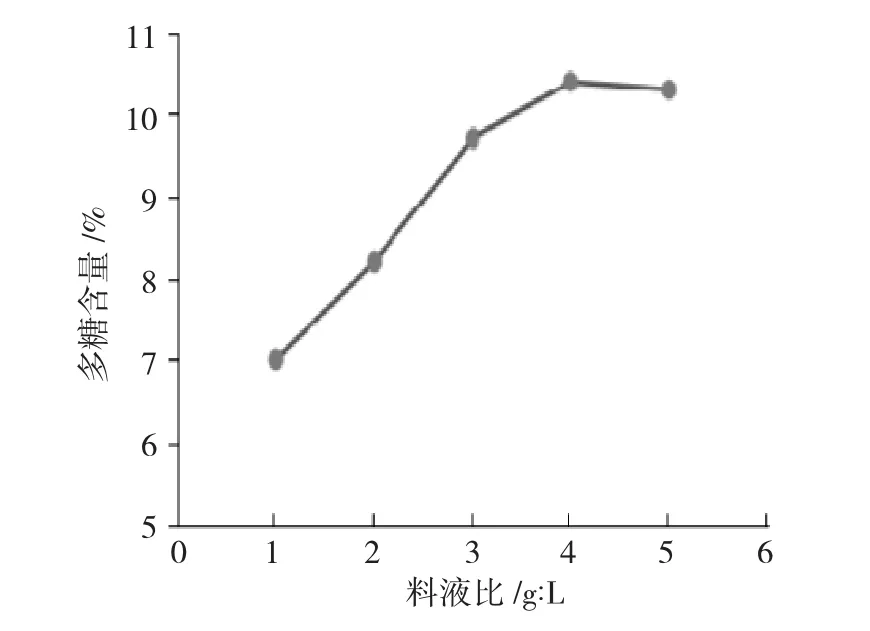
圖3 料液比與楮實子多糖含量的關系Fig.3 Relationship between solid-liquid ratio and content of Fructus Broussonetiae polysaccharides
由圖3 可見,料液比對多糖含量的影響呈先升高后小幅降低的趨勢,雖然料液比例1∶30 比1∶25提取的含量有所降低,但楮實子多糖含量仍高于料液比1∶20,其中料液比為1∶25 時效果最好,因此,選擇優化范圍為1∶20~1∶30 設計正交試驗。
2.2 多糖提取工藝優化的正交試驗
表2 為正交試驗設計及結果。
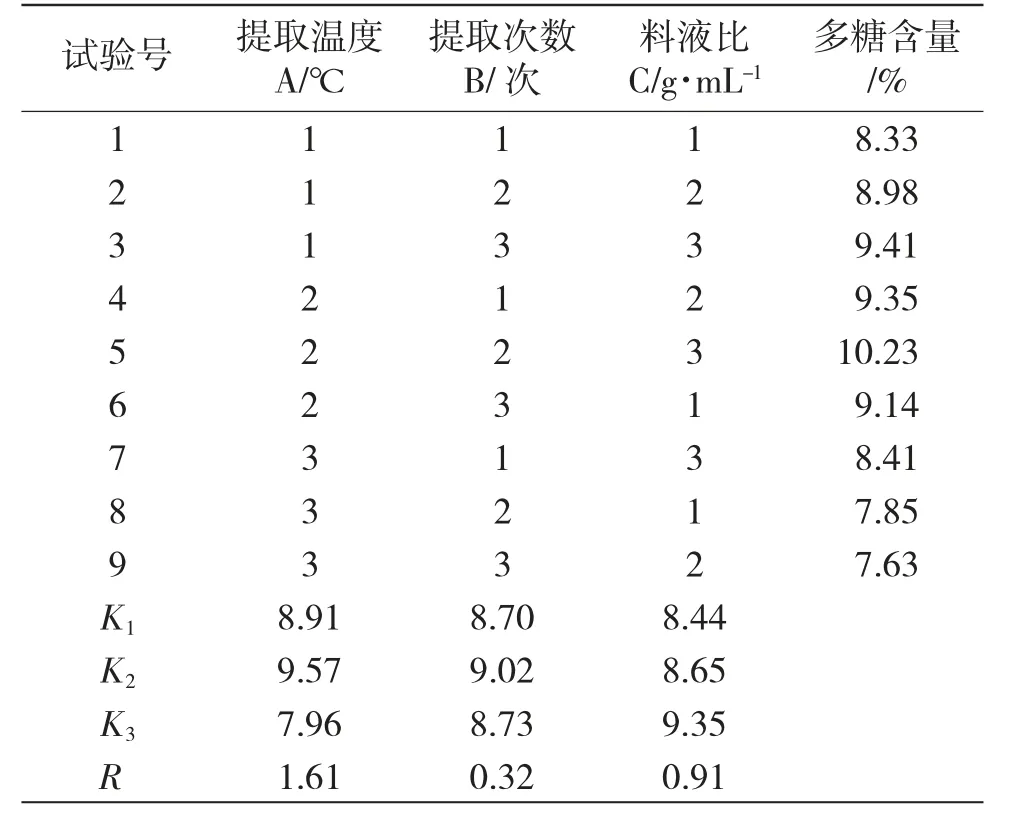
表2 正交試驗設計及結果(n=3)Tab.2 Design and result of orthogonal experiment
由表2 可見,極差分析結果表明因素影響的次序為A>C>B,說明提取溫度是影響多糖提取的主要影響因素,最優組合為A2B2C3。
方差分析結果見表3。

表3 方差分析結果Tab.3 Result of analysis of variance
溫度對多糖提取效果有極顯著影響,料液比對多糖提取效果有顯著性影響,提取次數對多糖提取效果無顯著影響。最終確定的最佳工藝為提取溫度80℃,提取次數2 次,料液比1∶25。
2.3 多糖提取工藝的驗證試驗
按照最優組合平行制備的3 批樣品多糖含量分別為:10.35%,10.69%,10.27%,RSD<3,表明工藝合理、可行,重復性好。
2.4 楮實子多糖對SOD、MDA、GSH-PX 水平的影響
由圖4 可見,與空白對照組比較,模型組SOD、GSH-PX 水平顯著下降,MDA 水平顯著升高(P<0.05),表明光老化模型復制成功。與模型組比較,維生素E組與楮實子多糖組SOD、GSH-PX 水平明顯升高(P<0.05),MDA 水平明顯降低(P<0.05),表明楮實子多糖有抗UVB 致皮膚成纖維細胞氧化損傷作用。

圖4 楮實子多糖對皮膚成纖維細胞SOD、MDA、GSH-PX水平的影響Fig.4 Fructus Broussonetiae polysaccharides effect on level of SOD、MDA、GSH-PX
3 結論
本研究通過單因素試驗考察了楮實子多糖提取溫度、提取次數及料液比對多糖含量的影響,確定了適宜范圍,采用L9(34)正交試驗法對多糖的提取方法進行優化,確定最佳提取溫度為80℃,提取次數為2 次,料液比為1∶25,多糖平均含量為10.44%,提示優化后的多糖提取工藝合理可行。
人皮膚長期處于UVB 照射下,細胞內ROS 水平顯著升高,引發脂質過氧化及DNA 損傷[6]。正常情況下,SOD、GSH-PX、維生素E 等抗氧化劑對ROS 有清除能力,過量的ROS 能使機體自身抗氧化防御系統失衡,細胞遭受氧化應激損傷,MDA 含量升高,最終導致皮膚光老化。本研究通過皮膚成纖維細胞復制光老化模型,對楮實子多糖的抗氧化活性進行了研究,初步證明了楮實子多糖的體外抗氧化活性,有用于抗老化中藥化妝品領域的潛力。

