HMGA1在葡萄膜黑色素瘤中的表達及對細胞增殖和侵襲的影響
明 媚,張 勁,羅 鋼,蔡麗英,梅 雪
0引言
葡萄膜黑色素瘤(uveal melanoma,UM)作為成人眼部最為常見的起源于葡萄膜的惡性腫瘤,發病率高居眼部腫瘤的第二位,且近年來呈上升趨勢[1]。盡管現有診療手段不斷進步,但患者總體生存率依然較低,預后不佳[2]。研究發現,高增殖活性及易發生眼外轉移是導致該腫瘤診療困難及死亡率高的主要原因,有超過90%的患者死于肝轉移[3]。高遷移率族蛋白A1(high mobility group A1,HMGA1)作為一種核蛋白,在細胞分化、轉移、胚胎形成及調控基因轉錄中發揮重要作用[4],研究發現HMGA1蛋白在多種惡性腫瘤組織中呈高表達[5]。亦有研究指出,HMGA1參與了腫瘤細胞增殖及侵襲過程[6],但其在UM中的作用鮮有報道。本研究分析UM組織中HMGA1蛋白表達,并觀察其與人UM細胞系M23增殖、遷移和侵襲的相關性,以期為UM的病理機制研究提供基礎資料。
1對象和方法
1.1對象選取2014-02/2019-08在我院接受手術治療的UM患者53例53眼,其中男29例29眼,女24例24眼;年齡28~76(平均48.36±11.14)歲;眼別:左眼25例,右眼28例;發生部位:睫狀體18眼,脈絡膜35眼;病理學類型:上皮細胞型19眼,梭形細胞型25眼,混合型9眼;35眼出現鞏膜浸潤。所有患者術前未行放化療治療,均行病理學檢查確診,于眼球摘除后,剝離腫瘤組織,甲醛固定,石蠟包埋保存。同期,留取因外傷摘除眼球的正常葡萄膜組織34例34眼,其中男20例,女14例,年齡26~77(平均48.07±10.92)歲;眼別:右眼19例,左眼15例。所有患者排除UM和其他腫瘤。兩組患者性別、年齡、眼別差異均無統計學意義(P>0.05),均衡可比。本研究通過醫院倫理委員會批準,入選對象均知情同意。
1.2方法
1.2.1主要試劑和設備免疫組織化學試劑盒及試劑購自北京中杉金橋生物技術有限公司,兔抗人HMGA1多克隆抗體購自英國Abcam公司,人UM細胞系M23購自上海烜雅生物科技有限公司,胎牛血清購自杭州四季青生物工程有限公司,RPMI1640培養液、青霉素-鏈霉素購自美國Gibco公司,HMGA1干擾序列和陰性對照序列由上海美軒生物科技有限公司提供,HMGA1和內參引物由上海生工生物公司設計合成,Trizol總RNA提取試劑盒和轉染試劑盒購自美國Invitrogen公司,逆轉錄和PCR試劑盒購自大連寶生物工程有限公司,CCK-8試劑購自武漢博士德生物工程有限公司,Transwell小室購自上海夏夷實業有限公司,Matrige基質膠購自美國BD公司,StepOnePlus實時熒光定量PCR儀購自美國ABI公司。
1.2.2免疫組織化學法檢測組織中HMGA1蛋白表達取組織石蠟標本,按4μm厚度連續切片,脫臘、水化,浸入枸櫞酸鹽緩沖液行加熱處理,PBS沖洗3次,浸入3%過氧化氫溶液,PBS沖洗3次,將一抗兔抗人HMGA1多克隆抗體1∶400稀釋后加入,過夜孵育(4℃),PBS沖洗3次,加入HRP標記二抗,室溫反應60min,PBS沖洗3次,經顯色、復染、脫水、封片,顯微鏡下觀察,高倍鏡下隨機取5個視野,根據染色情況和陽性細胞比例進行判定[7]:(1)染色情況:不染色0分,淡黃色1分,棕黃色2分,黃褐色3分;(2)陽性細胞比例:≤5% 0分,6%~25% 1分,26%~50% 2分,51%~75% 3分,≥76% 4分;(3)將(1)和(2)評分相乘,≤3分為陰性(-),>3分為陽性(+)。
1.2.3細胞培養和處理用含10%胎牛血清的RPMI1640培養液培養細胞。5% CO2、37℃、飽和濕度培養24h,胰酶消化,傳代。待細胞融合度達到90%時,按照轉染試劑盒說明進行分組轉染,HMGA1下調組轉染HMGA1干擾序列(5’-GAGTCAGAAAGAGCCCAGT-3’);陰性對照組轉染陰性對照序列(5’-TTCTCCGAACGTGTCACGT-3’);空白組不作處理。各組轉染后按上述條件繼續培養48h。
1.2.4實時熒光定量PCR術檢測HMGA1mRNA表達取細胞,加入裂解液,提取總RNA并檢測濃度,用逆轉錄試劑盒進行逆轉錄獲得cDNA,使用實時熒光定量PCR儀按擴增試劑盒說明進行擴增,引物序列:HMGA1:上游:5’-GCAGGAAAAGGATGGGACTG-3’,下游:5’-AGCAGGGCTTCCAGTCCCAG-3’;GAPDH:上游:5’-CTTCTTTTGCGTCGCCAGCCGA-3’,下游:5’-ACCAGGCGCCCAATACGACCAA-3’。反應條件:95℃ 3min,95℃ 30s,60℃ 30s,74℃ 30s,連續36個循環。用2-△△Ct法計算HMGA1 mRNA表達量。
1.2.5CCK-8法檢測細胞增殖能力取各組細胞,胰酶消化,制備細胞懸液,接種于96孔板,5×104/孔,繼續培養,分別在0、24、48、72、96h時,向各孔加入CCK-8液20μL,利用酶標儀取450nm波長下對各孔檢測,記錄吸光度值(OD),重復實驗3次,每次設置6個復孔。
1.2.6Transwell法檢測細胞遷移能力取各組細胞,胰酶消化,用無血清培養液制備單細胞懸液,密度為5×105/mL,取200μL加入Transwell小室上室,將含有20%胎牛血清的培養液加入小室下室,繼續培養24h,將小室取出,PBS沖洗,甲醛固定,結晶紫染色,將散落細胞拭去,鏡下觀察,隨機取5個高倍視野,對穿膜細胞進行計數[8]。
1.2.7Transwell法檢測細胞侵襲能力將Matrige基質膠用培養液稀釋后,在Transwell小室上室內進行均勻平鋪,過夜風干。其余步驟同1.2.5中Transwell實驗操作步驟。
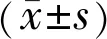
2結果
2.1UM和正常葡萄膜組織中HMGA1蛋白表達UM組織中HMGA1蛋白陽性表達率為77%(41/53),高于正常葡萄膜組織中的29%(10/34),差異有統計學意義(χ2=19.630,P<0.001),見圖1。
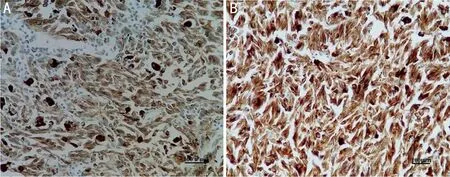
圖1 免疫組織法檢測UM和正常葡萄膜組織中HMGA1蛋白表達(SP) A:正常葡萄膜組織中HMGA1蛋白呈低表達;B:UM組織中HMGA1蛋白呈高表達。
2.2UM患者腫瘤組織中HMGA1蛋白表達情況HMGA1蛋白陽性表達率在不同年齡、性別、眼別、發生部位、視盤受累、繼發視網膜脫落、腫瘤高度和病理學類型患者中差異均無統計學意義(P>0.05),但與未發生鞏膜浸潤、未累及睫狀體和未發生眼外生長的患者相比,HMGA1蛋白在發生鞏膜浸潤、累及睫狀體和發生眼外生長的患者腫瘤組織中陽性表達率升高,差異均有統計學意義(P<0.05),見表1。
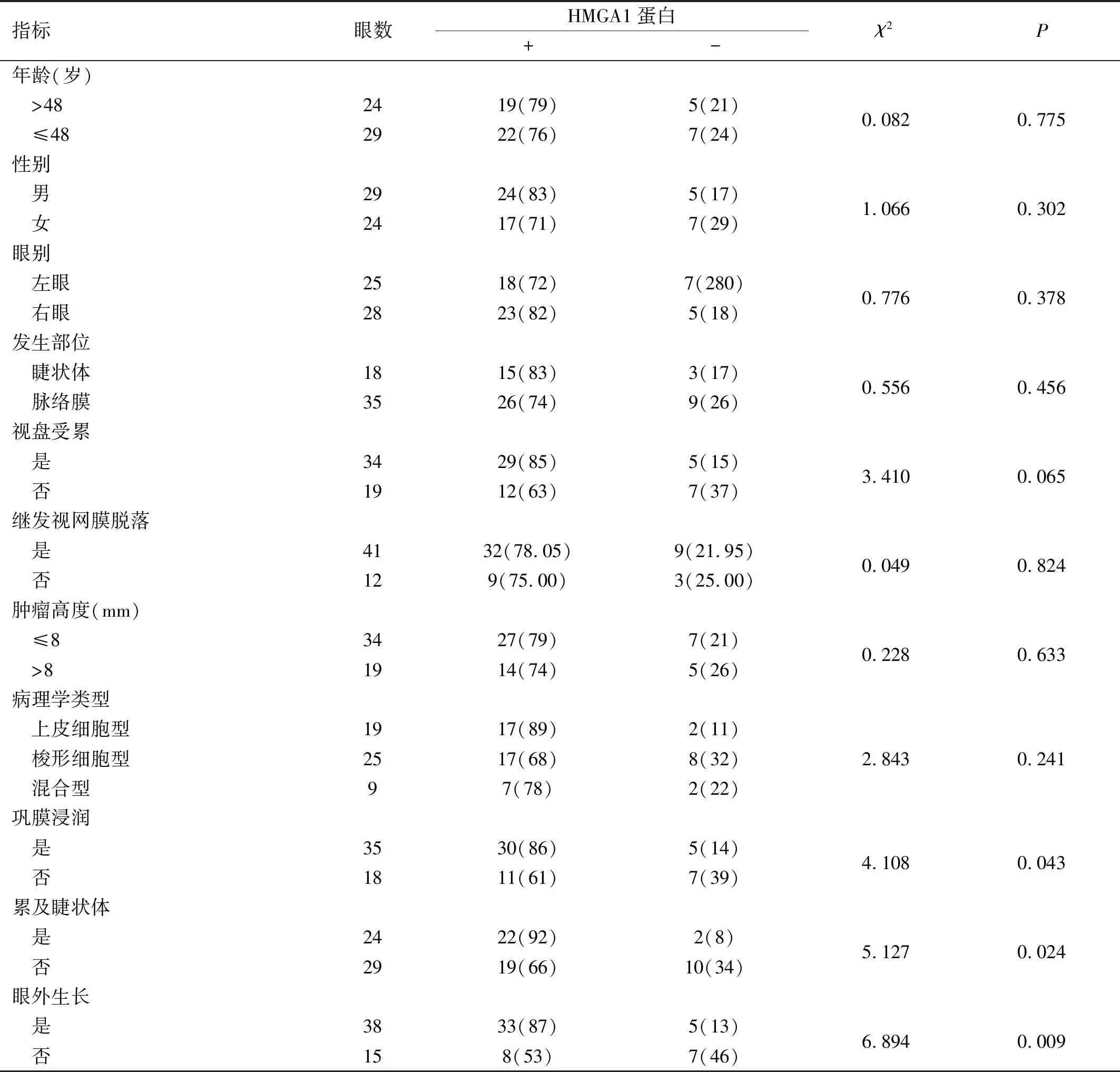
表1 UM患者腫瘤組織中HMGA1蛋白表達情況眼(%)
2.3各組細胞中HMGA1表達HMGA1下調組、陰性對照組和空白組細胞中HMGA1 mRNA相對表達量分別為0.29±0.08、0.98±0.07和1.01±0.06,差異有統計學意義(F=193.400,P<0.001),HMGA1 mRNA在陰性對照組和空白組細胞中相對表達量差異無統計學意義(P=0.431),HMGA1 mRNA在HMGA1下調組細胞中相對表達量低于陰性對照組和空白組,差異均有統計學意義(P<0.05)。
2.4各組細胞增殖能力與陰性對照組和空白組相比,HMGA1下調組細胞培養24、48、72、96h時吸光度OD值降低,差異均有統計學意義(P<0.05),見表2。
表2 各組細胞不同時間點吸光度OD值比較
2.5各組細胞遷移能力各細胞遷移能力相比,陰性對照組和空白組遷移細胞數差異無統計學意義(P>0.05),HMGA1下調組遷移細胞數明顯少于陰性對照組和空白組,差異均有統計學意義(P<0.05),見圖2,表3。

圖2 Transwell法檢測各組細胞遷移能力 A:HMGA1下調組;B:陰性對照組;C:空白組。
2.6各組細胞侵襲能力各組細胞侵襲能力相比,陰性對照組和空白組侵襲細胞數差異無統計學意義(P>0.05),HMGA1下調組侵襲細胞數明顯少于陰性對照組和空白組,差異均有統計學意義(P<0.05),見圖3,表3。
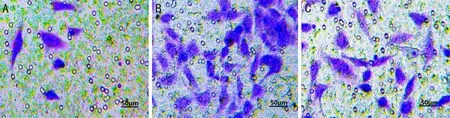
圖3 Transwell法檢測各組細胞侵襲能力 A:HMGA1下調組;B:陰性對照組;C:空白組。
表3 各組遷移細胞數和侵襲細胞數比較個)
3討論
UM作為眼內常見的惡性腫瘤,發病率僅次于視網膜母細胞瘤,且惡性程度高、增殖力和侵襲力強,早期便可發生轉移[9],有研究指出,轉移特別是突破眼眶的遠處轉移,是導致患者死亡的重要原因[10]。因此,積極尋找與UM轉移相關的敏感基因對患者診療及改善預后具有重要意義。HMGA1定位于人染色體6q21,在胚胎期高表達,但在成人正常組織中普遍低表達,可通過調控多條途徑而在細胞生長、分化、細胞周期、基因轉錄及DNA復制修復中發揮重要作用[11]。近年研究發現,HMGA1蛋白高表達于多種惡性腫瘤組織[12-13]。研究表明,HMGA1高表達可促進乳腺癌MCF7和T47D細胞增殖[4],HMGA1參與調控腎透明細胞癌轉移[11],其可作為一種靶基因在細胞侵襲和遷移中發揮重要作用[14]。本研究結果顯示,UM組織中HMGA1蛋白陽性表達率高于正常葡萄膜組織,說明HMGA1蛋白在UM組織中呈高表達,可能與該腫瘤的發生有關。同時,本研究發現HMGA1蛋白陽性表達率與鞏膜浸潤、累及睫狀體和眼外生長相關,表明HMGA1蛋白可能參與了UM侵襲和轉移過程。
本研究利用基因干擾技術特異性沉默M23細胞中HMGA1表達,結果顯示,HMGA1 mRNA在HMGA1下調組細胞中相對表達量低于陰性對照組和空白組,表明HMGA1下調組細胞中HMGA1 mRNA表達被成功抑制。有研究指出,miR-424可靶向調控HMGA1阻滯細胞周期G1期進而影響宮頸癌細胞的增殖[15]。本研究結果顯示,與陰性對照組和空白組相比,HMGA1下調組細胞培養24、48、72、96h時吸光度OD值降低,說明下調HMGA1表達可有效抑制M23細胞增殖,提示HMGA1可能參與了細胞增殖過程。另有研究指出,HMGA1可加速子宮頸癌的遷移和侵襲[16]。本研究結果顯示,HMGA1下調組遷移細胞數和侵襲細胞數均明顯少于陰性對照組和空白組,說明HMGA1可能參與了M23細胞遷移和侵襲過程,可能是調控細胞遷移和侵襲的重要基因之一,但具體調控機制尚待進一步研究明確。
綜上所述,UM組織中HMGA1蛋白陽性表達率升高,且與腫瘤惡性進展指標有關,下調M23細胞中HMGA1表達可減少細胞增殖,抑制細胞遷移和侵襲,有望為UM機制研究及臨床診療提供新的潛在靶基因。

