多形貌SnO2含碳復合材料制備及其電化學性能分析
何 棟 ,唐 婷
(西安航空職業技術學院, 陜西 西安 710089)
碳材料以其獨特的物理與化學特性,以及豐富的形態結構,而發展為最重要的功能材料,實現了在儲能、催化劑、電極材料等多領域的廣泛應用。基于復合金屬及其氧化物與碳,所生成復合材料,可兼顧二者優點。碳材料制備方法各式各樣,最常見的有還原法、模板法、電弧放電法、化學氣相沉積法等等,這些方法工藝復雜,反應能耗過高,比表面積較小,碳材料表層官能團匱乏,根本無法滿足當前碳材料制備的多元化需求。而水熱法制備碳材料,不僅設備操作間大,產物干凈純粹,且工藝環保節能,其主要以葡萄糖、蔗糖、纖維素等生物質材料為原料。而且研究發現含碳復合材料的力學性能與導電性能良好[1]。據此,本文以乙醇醇解為碳源,制備了SnO2含碳復合材料。
1 不同形態SnO2含碳復合材料研究現狀
1.1 點/線形態結構復合材料
點/線形態結構即SnO2粒子與線狀結構碳基體材料復合生成。SnO2粒子與具備中空結構的碳納米管復合時,可處于納米管外表層,也可處于內表層[2]。Zhang通過水熱法制備了SnO2納米顆粒分散于CNTs外表層的復合材料,先將HNO3處理之后的CNTs添加于PVP溶液內,以100 ℃水熱進行12 h熱處理,獲取PVP分子所修飾CNTs,并添加SnO2溶膠,100 ℃溶劑進行0.5~1.5 h熱處理,基于PVP橋接作用,分解PVP為小分子,并徹底去除干凈,以此制成SnO2納米顆粒均勻分散于碳納米管的復合材料[3]。Yang基于靜電紡絲與熱處理生成SnO2納米顆粒分散于碳纖維的復合材料,其循環性能良好,處于100 mA/g恒流狀態時,首次可逆容量為964 mAh/g,在100次循環之后,依舊具備420 mAh/g可逆容量,且高倍率循環容量保持性能良好,于0.5C與2C高倍率條件,100次循環之后可逆容量具體為226、236 mAh/g[4]。
1.2 點/面形態結構復合材料
點/面形態結構即SnO2粒子與片狀碳基體材料復合生成,其初始可逆容量與倍率性能非常大[5]。Zhang通過濕化學法,有機混合SnCl2鹽酸溶液與氧化石墨烯懸濁液,通過快速攪拌生成均勻溶液,在15 min之后采集固體產物,以去離子水進行清洗,于80 ℃狀態自然干燥,經過一個晚上之后,基于氬氣保護在300 ℃狀態下進行2h處理,以獲取具備單一分散性SnO2納米晶體附著于石墨烯兩側的復合材料[6]。
1.3 點/體形態結構復合材料
點/體形態結構即SnO2粒子與存在孔洞結構的碳基體材料復合生成。SnO2粒子處于碳基體材料孔洞內部,基于空洞結構有效抑制SnO2粒子發生體積變化,碳基體材料擔任緩沖層角色,以提升材料循環性能,其可逆比容量較低,循環性能良好[7]。Srinivasan利用模板法合成SnO2顆粒基于模板中間體附著,并在模板內部與外表層生成碳層,取出模板,從而獲得SnO2顆粒附著于介孔碳的復合材料[8]。Park等人以熱癥法與熱分解法進行了碳包覆SnO2粉末制備,通過100 mA/g電流密度于0.05~1.5 V循環過程中,充放電的首次不可逆比容量只達到732 mAh/g,在30次循環之后,可逆比容量超出400 mAh/g,以熱分解法所獲取無定形碳,可有效緩解體積化,并保持活性材料間產生的電接觸[9]。
1.4 核殼形態結構復合材料
核殼形態結構即SnO2粒子外部包覆著碳殼,可基于機械球磨、水熱化、氣相沉積等方法生成,其可逆容量比較大,且循環性能良好[10]。Lou等人以錫酸鉀與尿素溶入乙醇/水溶液獲取孔結構SnO2中空納米球,將其分散于葡萄糖溶液,以180 ℃狀態下進行3h水熱反應,并碳化處理,從而獲得雙層碳殼間夾層SnO2殼中空納米球結構,于SnO2殼內添加碳網,不僅可抑制鋰離子進入與脫離時產生的體積變化,還可適度加大電子導電性[11]。
2 實驗分析
2.1 實驗準備
2.1.1 實驗原料
實驗原料主要選用SnCl4·5H2O,無水乙醇,碘,甲基橙,NaCl,分析純。
2.1.2 實驗儀器
實驗儀器[12]具體如表1所示。

表1 實驗儀器
2.1.3 材料制備
于30 mL乙醇內溶解0.01 molSnCl4·5H2O、0.000 1 molNaCl、0.24 g碘,將溶液轉移于50 mL水熱釜內,于160 ℃狀態下進行1 d加熱,自然冷卻之后,以乙醇與去離子水進行5次離心純化,于60 ℃狀態下進行12 h烘干處理,以此成功制備SnO2含碳復合材料。
2.1.4 電化學測試方法
于室溫條件下,利用鋰金屬與參考電極進行雙電極電池自制,并對其開展電化學測試[13]。工作電極由活性材料、導電劑、黏合劑構成,三者比例為80∶10∶10;電解質則由乙烯碳酸酯與碳酸二乙酯混合生成,二者比例為50∶50。利用充滿氣體的箱子組裝電池,水分與氧氣質量分數控制在10-6以內。于200 mA/g恒電流密度條件下,基于活性物質與電化學工作站對電池放電周期進行測試,電壓控制于0~3 V。
2.2 結果分析
2.2.1 物相分析
SnO2含碳復合材料XRD譜圖[14]具體如圖1所示。
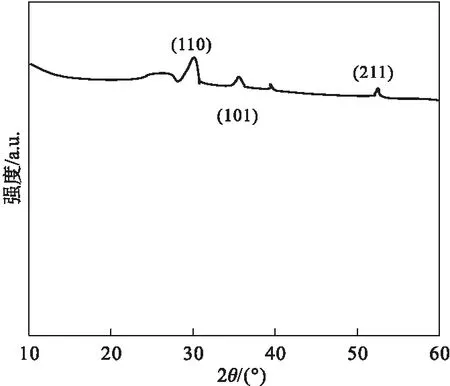
圖1 SnO2含碳復合材料XRD譜圖
由圖1可知,除于26.5°位置上出現了碳特征峰,還出現了其他三個極強衍射峰,具體表現為典型晶體結構特征,于27°、34°、52°位置,分別相對應SnO2(110)、(101)、(211)晶面,據此可知其中Sn以SnO2形式存在,即所謂的SnO2含碳復合材料。
2.2.2 形貌分析
SnO2含碳復合材料形貌[15]與構成圖具體如圖2~圖5所示。

圖2 復合材料SEM圖

圖3 復合材料TEM圖

圖4 復合材料HRTEM圖
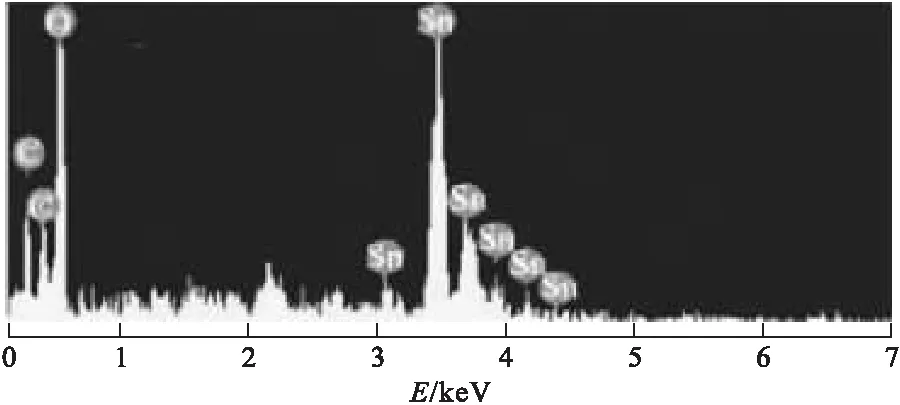
圖5 復合材料EDS圖
其中,圖2、圖3是通過無模板法所制備的多孔SnO2含碳復合材料,直徑控制在100~200 nm。如圖2所示,納米粒子的形貌比較獨特,表層為直徑20~50 nm的納米顆粒堆積組成;如圖3所示,SnO2含碳復合材料TEM圖中各個SnO2納米粒子表層都附帶著光亮二階層面,其是由含碳復合材料所生成的;如圖4所示,晶格條紋明晰清楚,相對應(110)晶面,結晶度非常高,也表明了SnO2含碳復合材料不僅僅處于表層,還進一步滲透到了內部;如圖5所示,由SnO2含碳復合材料EDS分析可知,其由Sn、O、C三種元素共同構成,其中碳含量為4.8%,表明材料中包含含碳材料。
2.2.3 不同NaCl含量下材料形貌
不同NaCl含量下SnO2含碳復合材料的形貌具體如圖6~圖8所示。

圖6 NaCl為0.017 mol/L時的復合材料TEM圖

圖7 NaCl為0.014 mol/L時的復合材料TEM圖

圖8 NaCl為0.012 mol/L時的復合材料TEM圖
由圖6~圖8可以看出,在NaCl含量為0.017 mol/L時,構成表現為米粒狀,直徑為1~2 nm納米材料;在NaCl含量為0.014 mol/L時,構成納米顆粒所聚集的絮狀;在NaCl含量為0.012 mol/L時,部分粒子集中于直徑100~150 nm球體內。這就表明,NaCl含量對SnO2含碳復合材料形貌具有顯著影響作用,其中不僅改變了溶液離子強度,還轉變了無機陰離子介電常數。陰離子具有一定的水化作用,可促使SnO2含碳復合材料形貌從米粒狀轉換為球狀。基于嚴格控制NaCl含量,可獲得更多不同形貌SnO2含碳復合材料。并且,SnO2含碳復合材料的結晶度良好。
2.2.4 不同NaOH含量下材料形貌
不同NaOH含量下SnO2含碳復合材料的形貌具體如圖9~圖10所示。

圖9 NaOH為0.004 mol/L時復合材料的SEM圖

圖10 NaOH為0.017 mol/L時復合材料的SEM圖
由圖9~圖10可以看出,在NaOH為0.004 mol/L時,生成直徑30~50 nm不規則沙粒狀粒子;在NaOH為0.017 mol/L時,生成直徑6~12 μm微球。這主要是由于NaOH提供了OH-,加快了Sn4+轉化為SnO2的速度。因此,基于嚴格控制NaOH含量,可獲得不同形貌SnO2含碳復合材料。
2.2.5 電化學性能
多形貌SnO2含碳復合材料的電化學性能測試結果,及復合材料作為電極與鋰離子電池內的儲電性能[16]具體如圖11~圖12所示。
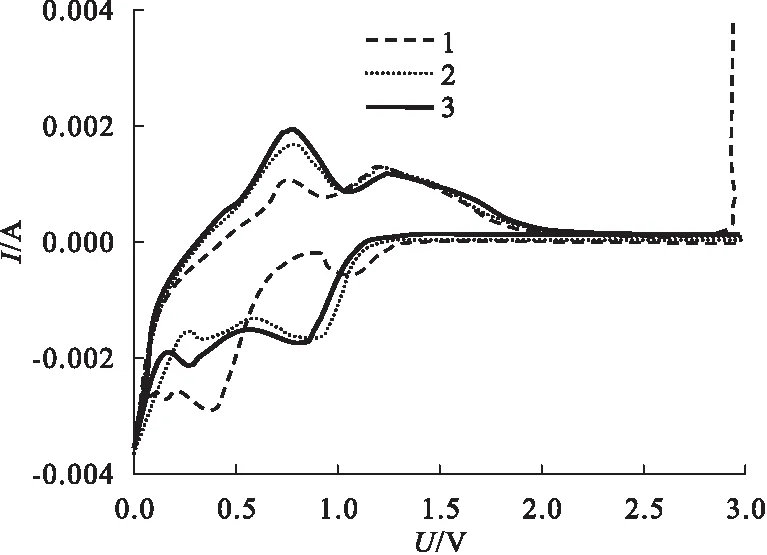
圖11 循環伏安曲線示意圖
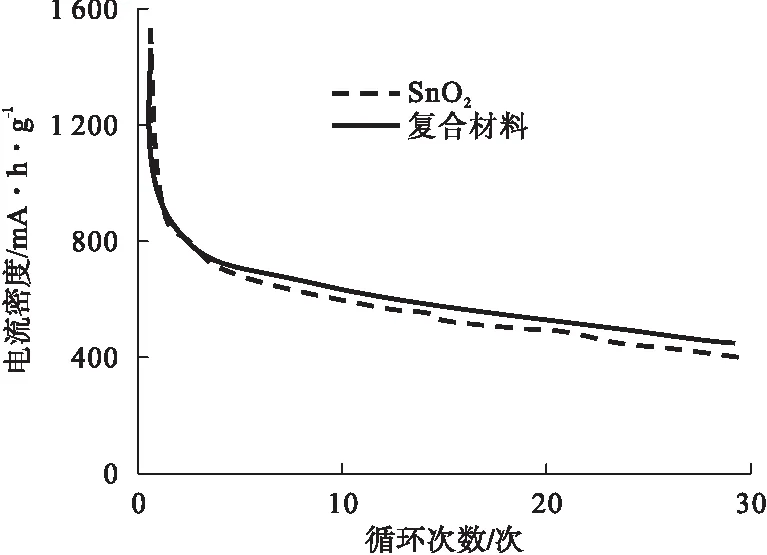
圖12 放電剖面示意圖
由圖11可知,在前三個充放電周期內,循環伏安曲線以0.5 mV/s速度掃描SnO2含碳復合材料,電壓控制在0.01~3 V。第一周期內,陽極與電解質之間,陽極表層生成了固態電解質間相膜。固相間膜SnO2分解生成Sn(SnO2+4Li++4e→Sn+2Li2O)。由圖12可知,在密度是200 mA/g時,SnO2含碳復合材料與SnO2的循環性能,50個周期以內,SnO2的電容量下降為278 mAh/g。但是就SnO2含碳復合材料而言,電容量則下降為350 mAh/g,這就說明添加含碳復合材料之后,電極容量與穩定可靠性都實現了顯著提升。總之,電化學測試結果表明,SnO2含碳復合材料的穩定性良好。
3 結 論
綜上所述,本文基于節能環保的水熱法,以乙醇為碳源制備了SnO2含碳復合材料,并進行了電化學性能實驗,結果表明,不同NaCl含量條件下,SnO2含碳復合材料的形貌變化較為明顯,基于控制NaCl含量,可獲得更多不同形貌SnO2含碳復合材料,SnO2含碳復合材料的結晶度良好;基于控制NaOH含量,可獲得不同形貌SnO2含碳復合材料;通過電化學性能測試,表明添加含碳復合材料之后,電極容量與穩定可靠性都實現了顯著提升。

