轉化植物甾醇產22-羥基-23, 24-雙降甾-1,4-二烯-3-酮(HPD)工程菌株的構建及發酵培養基優化
馬治國,劉相岑,袁辰陽,杜桂林,鈕 冰 ,張保國, ,史吉平
(1.上海大學生命科學學院, 上海200444;2.中國科學院上海高等研究院, 上海201210;3.上海科技大學, 上海201210)
甾體藥物廣泛應用于各類疾病治療和健康保健等,如消炎、抗菌、抗腫瘤等[1],全球每年市場總銷售額超過100億美元[2?3],是除了抗生素外的第二大類藥物。22-羥基-23,24-雙降甾-1,4-二烯-3-酮(HPD)作為植物甾醇的側鏈不完全降解產物,可以作為重要的甾體藥物中間體[4],而植物甾醇主要來源于食品中,所有植物性的食物中都包含植物甾醇,它對人體健康很有好處,食品中植物甾醇攝入量越高,人們患心臟病和其他慢性疾病的危險相對越低,此外它還有降低膽固醇、抗癌等功效,植物甾醇以及植物甾醇的某些中間代謝產物也可以應用在食品、醫藥等領域[5],如用于油脂、面包主食、食物色拉和可口可樂等,利用HPD可以合成1-脫氫孕酮等孕激素、氫化可的松、地塞米松等皮質類激素[6?9],可以緩解類風濕性關節炎[10]等癥狀。傳統孕激素和皮質類激素以化學合成法合成,但是化學合成法存在很多問題,嚴重限制了甾體藥物在藥學領域的發展[11?12],隨著甾體藥物市場需求不斷擴大,利用微生物轉化植物甾醇來生產重要的甾體藥物中間體受到了越來越多的關注[13]。
3-甾酮-Δ1脫氫酶(KstD)是微生物轉化植物甾醇過程中一個關鍵酶[14],能夠催化22-羥基-23,24-雙降甾-4-烯-3-酮(4-HP)的A環C1,2脫氫形成雙鍵而制得HPD[15],比如皮質醇和可的松的1號位脫氫衍生物比其本身可表現出更強的抗風濕和抗過敏活性[16]。KstD不但可以催化4-HP上A環C1,2脫氫形成HPD,并且在植物甾醇代謝和其他甾體藥物合成中也起著重要的作用[17?18],Zhang等[19]在大腸桿菌異源表達KstD基因,直接將4-HP轉化成HPD。但是以4-HP為底物通過酶法轉化合成HPD的工藝,由于底物成本較高、酶催化工藝復雜[20?22],所以該路線并不適合工業化生產;Xu等[23]通過基因編輯改造獲得了能轉化植物甾醇產HPD的菌株,但摩爾產率較低,同時含有4-HP、ADD等副產物,需要進一步提高產量。而通過對菌株改造以植物甾醇為底物直接得到HPD,工藝簡單且成本很低,極具工業化生產的潛力,如何獲得可以直接轉化植物甾醇生產HPD的優良菌株,目前成為HPD產業化過程中研究的重點和難點。
為了提高HPD的產量,在一株基因突變菌株Mycobacterium neoaurumDSM 1381[24]中過表達KstD基因構建一株3-甾酮-Δ1脫氫酶過表達的菌株;再通過單因素篩選和響應面試驗來優化發酵培養基,進一步提高生產HPD的能力,實現生產HPD工藝的優化和產量的提升。
1 材料與方法
1.1 材料與儀器
新金分枝桿菌Mycobacterium neoaurumDSM 1381(DSM 1381)、大 腸 桿 菌Escherichia coliDH5α、整合表達質粒pMV306-Psmyc實驗室?80 ℃保藏;Phanta Max Master Mix、限制性內切酶EcoRI和SaIl TaKaRa公司;吐溫?80、卡那霉素上海麥克林有限公司;質粒提取試劑盒、4-HP、HPD標品 Axygen公司;玉米漿 山東佳達生物飼料有限公司;植物甾醇 云南生物制品有限公司;乙酸乙酯、正己烷等 國藥集團化學試劑有限公司;葡萄糖、蛋白胨、牛肉膏等 上海生工生物工程有限公司。
BSA 224S-CW型電子天平、PB-10型pH計德國Sartorius;LC-2010型高效液相色譜儀 日本島津公司;HWS-12型恒溫水浴鍋 上海一恒公司;Centrifuge5430低溫離心機 德國Eppendorf公司;EPS300型電泳儀 上海天能有限公司;DU730型紫外分光光度計 德國BecKman;MLS-3780型高壓蒸汽滅菌鍋 日本三洋;S1000TM型PCR儀 美國Thermal BIO-RAD公司。
1.2 實驗方法
1.2.1 培養基及植物甾醇母液配制 LB培養基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH7.0,115 ℃,滅菌30 min;種子培養基:NH4NO315 g/L,Glu 10 g/L,K2HPO41.0 g/L,NaNO32.0 g/L,吐溫?80 2 g/L,pH7.5~8.0,115 ℃,滅菌30 min;初始培養基:(NH4)2SO410 g/L,Glu 10 g/L,MgSO4·7H2O 1.0 g/L,K2HPO41.0g/L,吐溫?80 2 g/L,植物甾醇5 g/L,pH7.5-8.0,115 ℃,滅菌30 min;植物甾醇母液:稱取5 g的植物甾醇,加入1 g吐溫?80和20 g羥丙基-β-環糊精,用水定容至100 mL配成50 g/L,攪拌60 min,200 W超聲溶解20 min,115 ℃,滅菌30 min備用。
1.2.2 過表達整合質粒pMV306-Psmyc-KstD的構建 以實驗室構建pMV306-Psmyc質粒為模板;然后根據本實驗室測序得到的DSM 1381基因組上的KstD1基因序列為模板設計擴增引物KstD1-F/R(tatgggatccgaattcGTGTTCTACATGACTGCCCA/ta gttaactacgtcgacTCAGGCCTTTCCAGCGAGAT)擴增KstD1基因,將它同源重組到pMV306-Psmyc整合質粒的EcoRI和SalI位點之間,構建過表達質粒pMV306-Psmyc-KstD,過表達質粒構建方法如圖1所示,然后用pMV306質粒上的位點設計引物進行實驗,并送上海杰李測序公司測序驗證。
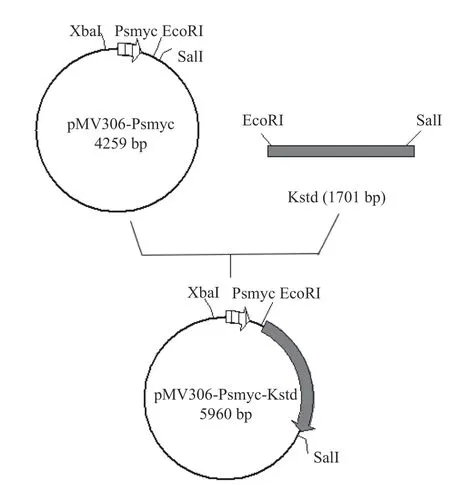
圖1 質粒pMV306-Psmyc-KstD的構建過程[25]Fig.1 Construction of plasmid pMV306-Psmyc-KstD[25]
1.2.3 新金分枝桿菌電轉及陽性菌株篩選 將構建好的過表達質粒pMV306-Psmyc-KstD電入新金分枝桿菌的感受態中[26],涂入含50 μg/mL的卡那霉素抗性的LB平板上,3~4 d后挑取單克隆進行PCR驗證,PCR擴增條件為:95 ℃,5 min,95 ℃,30 s,58 ℃,30 s,72 ℃,1 kb/min,35循環;72 ℃,5 min,16 ℃,5 min,PCR產物經過測序得到陽性菌株即構建的菌株。
1.2.4 重組菌株生長曲線 將重組菌株單克隆劃線于固體LB培養基,30 ℃恒溫培養箱培養3~5 d后挑取單克隆接種于10 mL種子培養基,30 ℃、200 r/min培養至對數后期(約60 h),得到液體菌種,然后以1:10體積的接種量接入50 mL種子培養基,30 ℃、200 r/min恒溫箱振蕩培養,每過4 h取樣檢測菌液的吸光度值OD600,然后以培養時間h為橫坐標,吸光度值OD600為縱坐標繪制菌株的生長曲線,每組做三個平行。
1.2.5 菌株培養和植物甾醇轉化條件過表達 菌和野生菌株液體種子培養方法如1.2.4,發酵培養基中接入10%體積的液體菌種;放置30 ℃、200 r/min恒溫振蕩箱培養120 h時取樣檢測產物。
1.2.6 產物檢測方法 具有共軛結構的甾體化合物4-HP和HPD在UV254 nm下有吸收值可以利用高效液相色譜檢測,然后比對標品建立的標準曲線,可以測定產物的相對含量[27?29],
HPD的標準曲線y=56.237X?0.139,R2=0.99914,4-HP的標準曲線y=44.398X?0.101,R2=0.99412,具有極好的線性關系。
高效液相色譜(HPLC)檢測條件[30]:采用C18反相層析柱(Agilent XDB-C18,4.6 mm×250 mm,5 μm);流動相為甲醇80%:水20%(V/V),流速0.8 mL/min;進樣體積為20 μL;紫外檢測波長為254 nm。
1.2.7 發酵培養基優化
1.2.7.1 有機氮源的選擇 根據預實驗[31?32]選擇玉米漿為有機氮源,HPD的產量作為指標,設置1、5、10、15、20、25 g/L的濃度梯度,其他條件都保持不變,篩選出最優的玉米漿濃度。
1.2.7.2 無機氮源的選擇 在最優的玉米漿濃度條件下添加無機氮源硝酸鈉,并設置0、2、4、6、8、10 g/L的濃度梯度,篩選出最適宜的硝酸鈉濃度,每組實驗做三組平行。
1.2.7.3 碳源的選擇 根據預實驗選擇葡萄糖為碳源,HPD的產量作為指標,設置1、3、6、9、12、15 g/L的濃度梯度,篩選出最適宜的葡萄糖濃度,其他條件都保持不變,每組實驗做三組平行。
1.2.7.4 磷酸鹽的選擇 根據預實驗選擇磷酸氫二鉀為磷酸源,HPD的產量作為指標,設置它的濃度梯度為1、2、3、4、5、6 g/L,篩選最適宜的磷酸鹽濃度,其他條件都保持不變,每組實驗做三組平行。
1.2.7.5 響應面設計 根據前面單因素實驗的結果,選擇玉米漿、磷酸氫二鉀、硝酸鈉和葡萄糖的濃度作為考察因素,HPD的產量作為指標,利用Design-Expert 8.0.6.1軟件設計出4因素3水平的響應面試驗,試驗因素和編碼水平如表1所示。

表1 響應面試驗的因素水平設計Table 1 Factor levels for response surface experiments
1.3 數據整理
本實驗中每個樣品做三組平行,使用Design-Expert 8.0.6.1軟件進行響應面優化試驗的設計以及數據分析,并預測出最優結果,使用Origin 2018軟件進行數據處理及作圖并進行顯著性分析,標有相同小寫字母者表示組間差異不顯著(P>0.05),反之表示組間差異顯著(P<0.05)。
2 結果與分析
2.1 過表達質粒的驗證與重組菌株篩選
使用pMV306的專用引物p306-F(ggcggagcctatggaaaaac)/p306-R(gcgttcgccctgtcgttcac)對pMV306-Psmyc-KstD進行PCR驗證,結果如圖2所示,1,4條帶為空載即空白對照,2,5條帶為陽性對照,3,6為構建質粒,結果送測驗證正確。
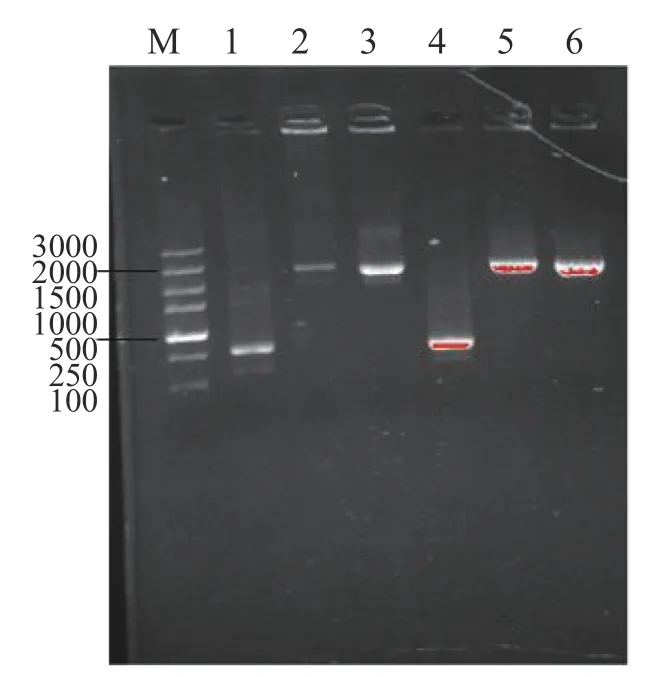
圖2 過表達質粒的電泳圖Fig.2 Electrophoretic images of PCR products
2.2 過表達菌株和原始菌株的生長狀況
KstD過表達菌株為Mycobacterium neoaurumDSM 1381Z(DSM 1381Z)與初始菌DSM 1381的生長情況如圖3所示,可以看出轉入3-甾酮-Δ1脫氫酶的DSM 1381Z菌株和初始菌株DSM 1381的生長狀況大致相同,0~16 h緩慢生長期,16~40 h為對數生長期,40~55 h穩定生長期之后進入衰退期,兩株菌株生長情況大致相同,說明過表達質粒pMV306-Psmyc-KstD的轉入不會對過表達菌株DSM 1381Z的生長產生負面影響。
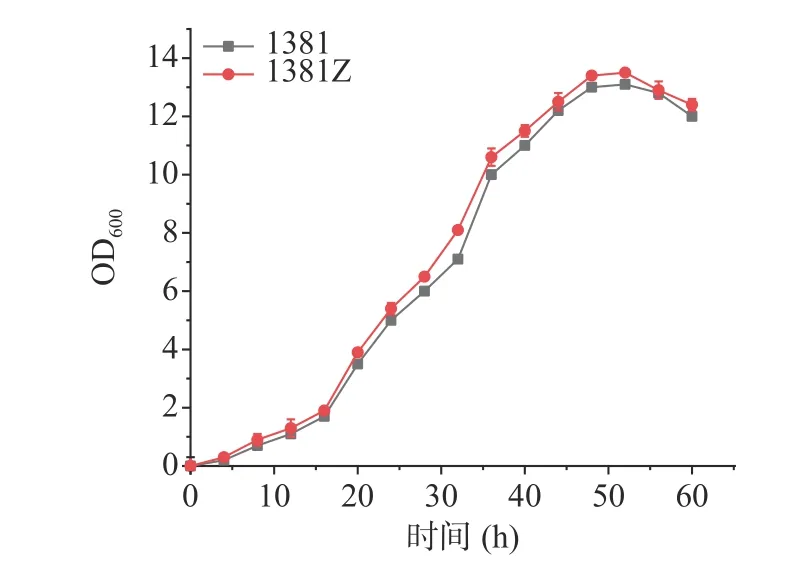
圖3 DSM 1381Z和DSM1381的生長曲線Fig.3 Growth curve of DSM 1381Z and DSM 1381
2.3 過表達菌株植物甾醇轉化
過表達菌株DSM1381Z和初始菌株DSM 1381對植物甾醇的轉化結果如圖4所示,橫坐標代表時間,縱坐標代表產量,DSM 1381Z菌株發酵液中比DSM 1381菌株HPD產量提高了約50%,說明過表達菌株構建成功。

圖4 1381和1381Z對植物甾醇的生物轉化Fig.4 Bioconversion of phytosterols by 1381 and 1381Z
2.4 單因素實驗篩選
2.4.1 有機氮源的選擇 氮源是微生物生長需求量非常大的元素,適當的氮源水平對微生物生物量的積累以及甾醇轉化有著非常重要的影響。預實驗中多種有機氮源的存在下,DSM 1381Z都可以生成HPD,在幾種有機氮源中以玉米漿時HPD濃度最高,可能是因為玉米漿中含有豐富的營養物質,有利于植物甾醇轉化,后續實驗在對它的濃度進行優化。
如圖5所示,隨著玉米漿濃度不斷增加,產物HPD的產量也逐漸增加,當玉米漿濃度達到10 g/L時,HPD的產量最高3.2 g/L;但隨著濃度繼續增加,HPD積累量逐漸降低,可能是因為營養過剩導致轉化甾醇不充分,接下來選擇10 g/L的玉米漿繼續實驗。

圖5 玉米漿濃度的影響Fig.5 Effect of corn steep liquor concentration
2.4.2 無機氮源的選擇 預實驗中幾種無機氮源中以硝酸鈉時HPD濃度最高,微生物轉化植物甾醇中既要有機氮源又要無機氮源,在玉米漿10 g/L濃度時,篩選出硝酸鈉濃度對產物的影響。
由圖6可以看到在硝酸鈉2 g/L時,HPD產量最高3.4 g/L,隨著硝酸鈉濃度逐漸增加,HPD產量降低,可能是因為少量的硝酸根離子可以促進代謝,從而提高產量,而高濃度時可能會影響微生物生長從而抑制微生物的代謝,因此玉米漿作為主要有機氮源時,再加入一些無機氮源硝酸鈉會促進植物甾醇轉化,接下來選擇玉米漿10 g/L和硝酸鈉2 g/L作為合適的氮源濃度繼續后續實驗。
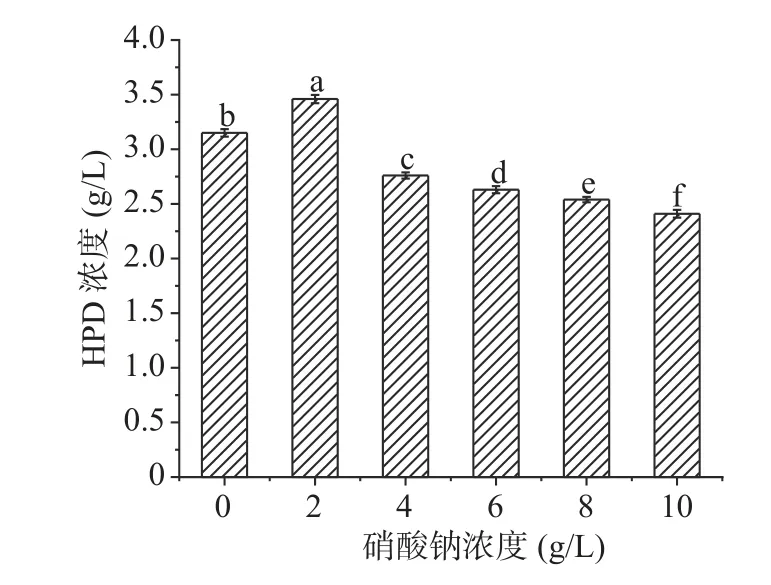
圖6 硝酸鈉濃度的影響Fig.6 Effect of sodium nitrate concentration
2.4.3 碳源的選擇 碳源作為培養基必不可少的基本成分,可以為微生物的生長及代謝提供必要的能量,選擇適宜的碳源有助于促進某些酶的合成,增強微生物的某些生物活性[33],預實驗中DSM 1381Z可以利用不同的碳源,當葡萄糖為碳源時,HPD的產量最高,可能因為葡萄糖是單糖,DSM1381Z相對更容易利用,故選用葡萄糖作為DSM 1381Z發酵培養基的最佳碳源,然后再對其濃度進行優化。
如圖7所示,隨著葡萄糖濃度的增加HPD積累量先增加后減少,當濃度為6 g/L時,產物濃度達到最大3.3 g/L,后續選擇6 g/L的葡萄糖作為碳源繼續研究。

圖7 葡萄糖濃度的影響Fig.7 Effect of glucose concentration
2.4.4 磷酸鹽的選擇 磷作為核酸、蛋白質的主要成分,可以改變菌體的能荷狀態,還是培養基中重要的緩沖鹽,對維持發酵培養基中pH穩定有重要作用[34]。預實驗中選擇磷酸氫二鉀作為最適合磷酸鹽,對其濃度進行優化,結果如下圖8,當磷酸氫二鉀濃度為2 g/L的發酵液中HPD的積累量最大。

圖8 磷酸氫二鉀濃度的影響Fig.8 Effect of phosphate source concentration
2.5 響應面試驗優化結果
2.5.1 模型的建立和顯著性分析 使用軟件Design-Expert 8.0.6.1對表2進行分析,方差的分析結果如表3所示。對得到的數據進行多元回歸擬合,得到DSM 1381Z轉化植物甾醇產HPD濃度(Y)對玉米漿(A)、磷酸氫二鉀(B)、硝酸鈉(C)、葡萄糖(D)的多項回歸方程:

表2 響應面分析結果Table 2 Results of response surface analysis
Y=3.56?0.43A?0.024B?0.096C?1.908E?003D+0.21AB+0.10AC?0.16AD+0.014BC?0.039BD+0.34CD?1.20A2?1.09B2?0.51C2?0.62D2
由表3可知,本試驗的回歸模型極顯著(P<0.001),失擬項P=0.0515>0.05不是很顯著,說明模型較正確,擬合度較高,復決定系數R2=0.9883,表明預測值和實測值具有較好的相關性;調整性決定系數說明方程模型的可信度較高,能夠較好地描述試驗結果。由表3可知,對HPD產量影響最大的因素依次是A、C、B、D,CD的交互作用極顯著(P<0.001),此外,AB、AD也有顯著性影響,二次項A2、B2、C2、D2對HPD產量的影響極顯著(P<0.001)。

表3 HPD產量多項式回歸模型方差分析Table 3 Analysis of variance(ANOVA)of HPD yield polynomial regression model
2.5.2 響應面優化與分析 根據回歸模型做出響應面圖,考察各個因素之間的交互作用[35]對HPD產量的影響,交互作用的大小可由等高線的形狀來反映,兩因素的交互作用越顯著形狀越橢圓,若呈圓形則相反,并且響應面曲線較陡也能說明兩因素交互作用顯著,結果如圖9所示。
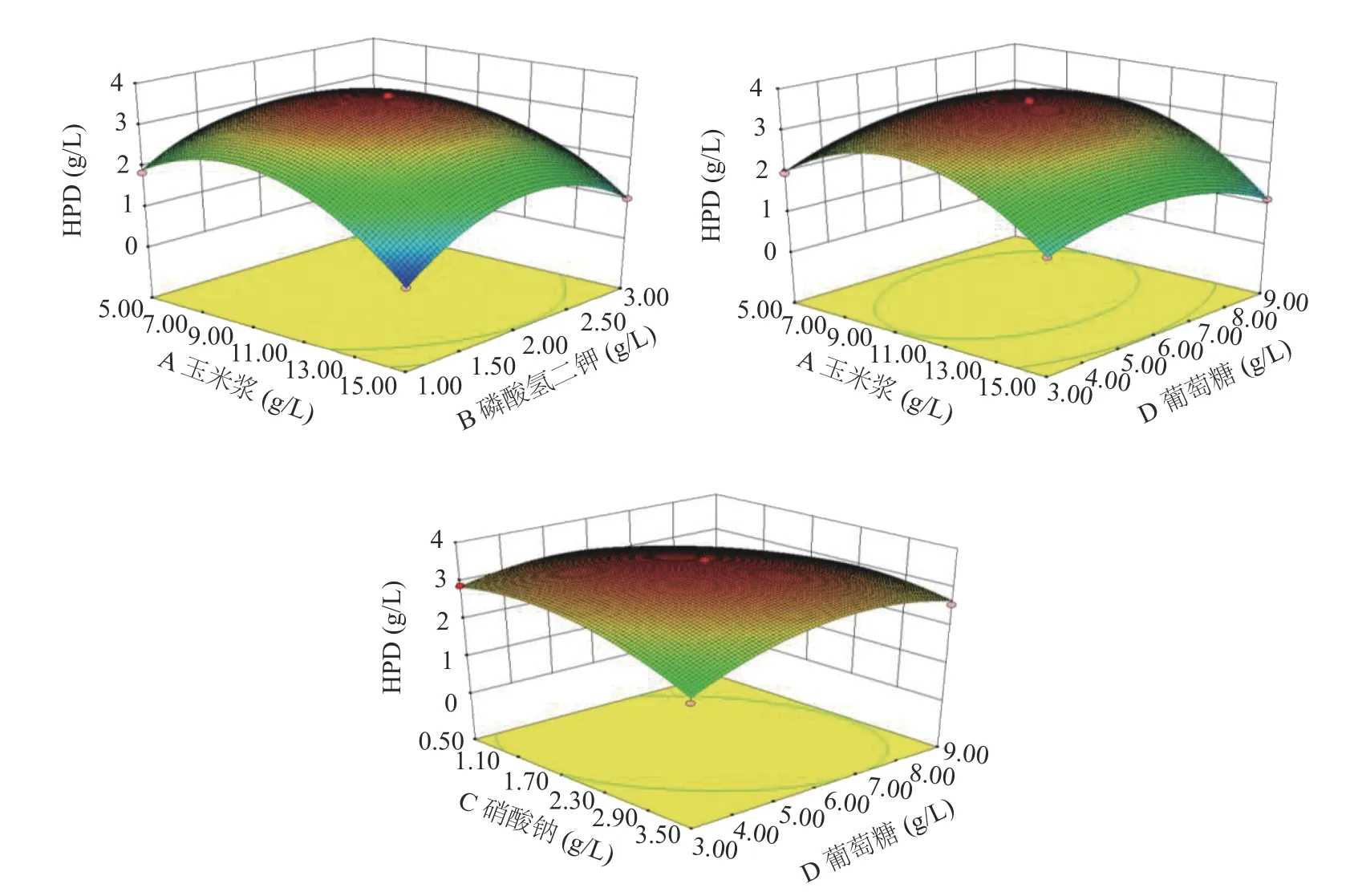
圖9 因素間交互作用的響應面分析Fig.9 Response surface analysis of the interaction of different factors
通過Design-Expert 8.0.6.1軟件對響應面結果分析計算,得到Mycobacterium neoaurumDSM 1381Z轉化植物甾醇產HPD的最佳發酵培養基配方:玉米漿9.08 g/L、硝酸鈉1.82 g/L、葡萄糖5.98 g/L、磷酸氫二鉀1.97 g/L,此條件下HPD的產量預測值可達3.61 g/L。
2.5.3 響應面優化結果驗證 考慮到實際操作情況,將響應面優化結果校正為玉米漿9 g/L、硝酸鈉1.8 g/L、葡萄萄糖6 g/L、磷酸氫二鉀2 g/L,在此條件下進行驗證(3組平行實驗),發酵120 h后得到實際HPD的積累量最大值為(3.73±0.12) g/L,與軟件預測值3.61 g/L的誤差約為3.22%,說明上述方程和實際的擬合度較好,很好的驗證了模型,與原始菌株DSM 1381相比,HPD產量提高了約2.7倍,為提高甾體藥物中間體的生產提供了一定的工業基礎。
3 結論
本實驗通過在出發菌株Mycobacterium neoaurumDSM 1381中過表達高活性的3-甾酮-Δ1-脫氫酶基因KstD獲得一株直接轉化植物甾醇高產HPD的菌株Mycobacterium neoaurumDSM 1381Z。為了進一步提高其產量,通過單因素篩選出Mycobacterium neoaurumDSM 1381Z發酵培養基成分;然后利用響應面優化設計實驗,得到最優發酵培養基玉米漿9 g/L、葡萄糖6 g/L、硝酸鈉1.8 g/L、磷酸氫二鉀2 g/L。此條件下HPD預測產3.61 g/L,對優化后的培養基進行驗證得到實際結果為(3.73±0.12) g/L,與理論預測值接近,說明模型比較合適。通過培養基響應面優化,比初始菌DSM 1381的HPD產量提高了約2.7倍,產量由原來的71%提高到92%左右,具有一定的工業化應用價值。
目前利用微生物直接轉化植物甾醇生產HPD的研究較少[36],本研究通過在DSM 1381體內過表達3-甾酮-Δ1脫氫酶,進一步獲得更多的HPD,發酵過程中植物甾醇幾乎都被微生物所利用,但是還有少量雜質,因此下一步工作應通過代謝工程等手段進一步改造菌種,減少雜質生成,提高HPD的純度和產量。

